Похожие презентации:
Валентные возможности атомов
1. ОБЛАСТНОЙ ЦЕНТР ПО РАБОТЕ С ОДАРЕННЫМИ ДЕТЬМИ КАФЕДРА ХИМИИ СУНЦ НГУ
ВОСКРЕСНАЯ НАУЧНАЯ ШКОЛАХИМИЯ
07 ноября 2010 г.
2. Всё состоит из веществ
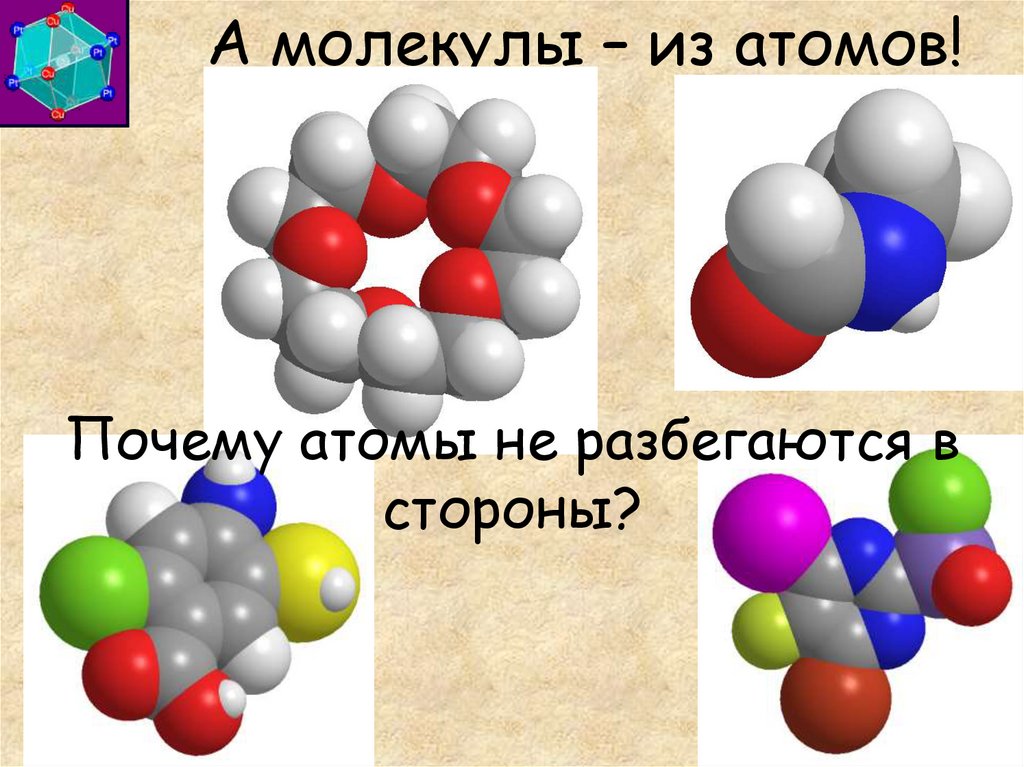
Вещества состоят из молекул…3. А молекулы – из атомов!
Почему атомы не разбегаются встороны?
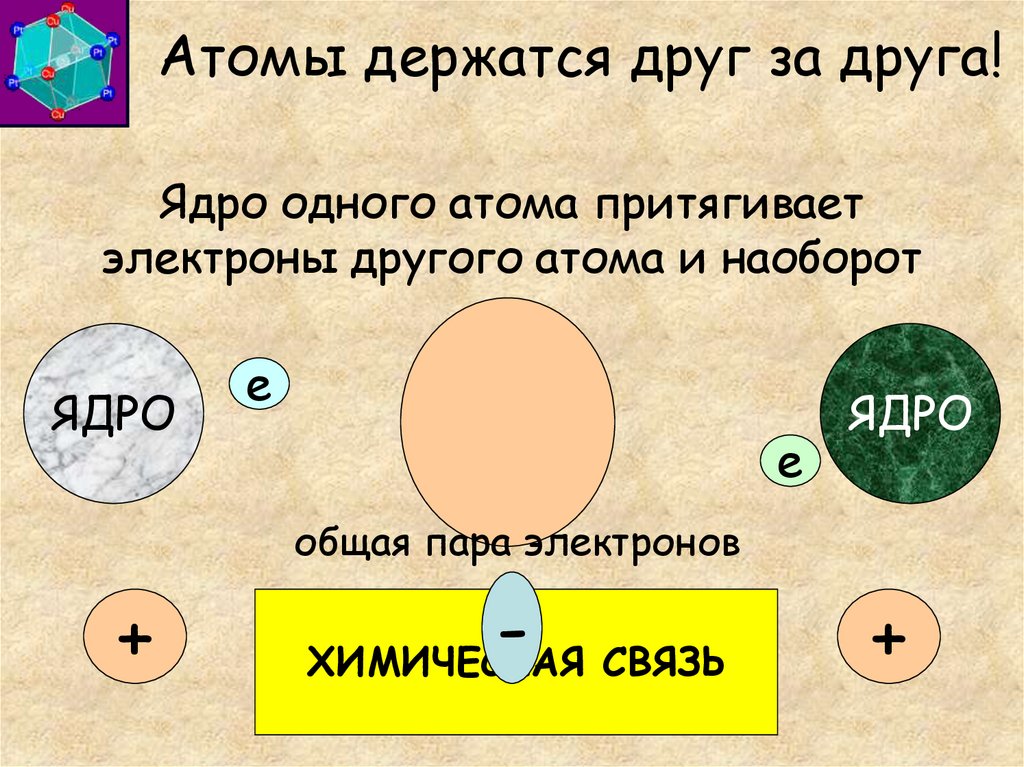
4. Атомы держатся друг за друга!
Ядро одного атома притягиваетэлектроны другого атома и наоборот
ЯДРО
e
e
ЯДРО
общая пара электронов
+
ХИМИЧЕСКАЯ СВЯЗЬ
+
5. Атомы держатся за руки
АммиакH
O
Cl
H
C
H
H
Вода
Бромоводород
H
Cl
Cl
H Br
Трихлорметан (Хлороформ)
N
H
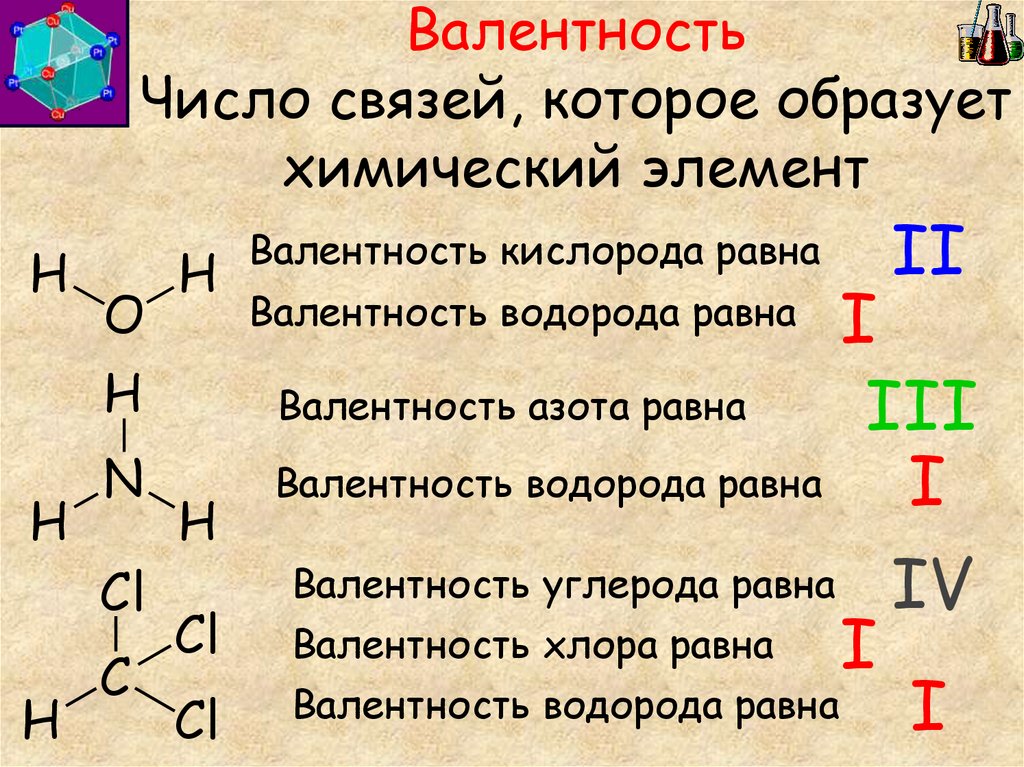
6. Валентность Число связей, которое образует химический элемент
HO
H
H
H
H
N
Cl
C
H
Cl
Cl
Валентность кислорода равна
II
I
Валентность азота равна
III
Валентность водорода равна
I
Валентность углерода равна IV
Валентность хлора равна
I
Валентность водорода равна
I
Валентность водорода равна
7. Почему у водорода В. I, а у кислорода - II ?
В основе лежит электронная конфигурация!!!H
1s1
один неспаренный электрон
O
2p4
I
II
2s2
два неспаренных электрона
1s2
1s22s22p4
8.
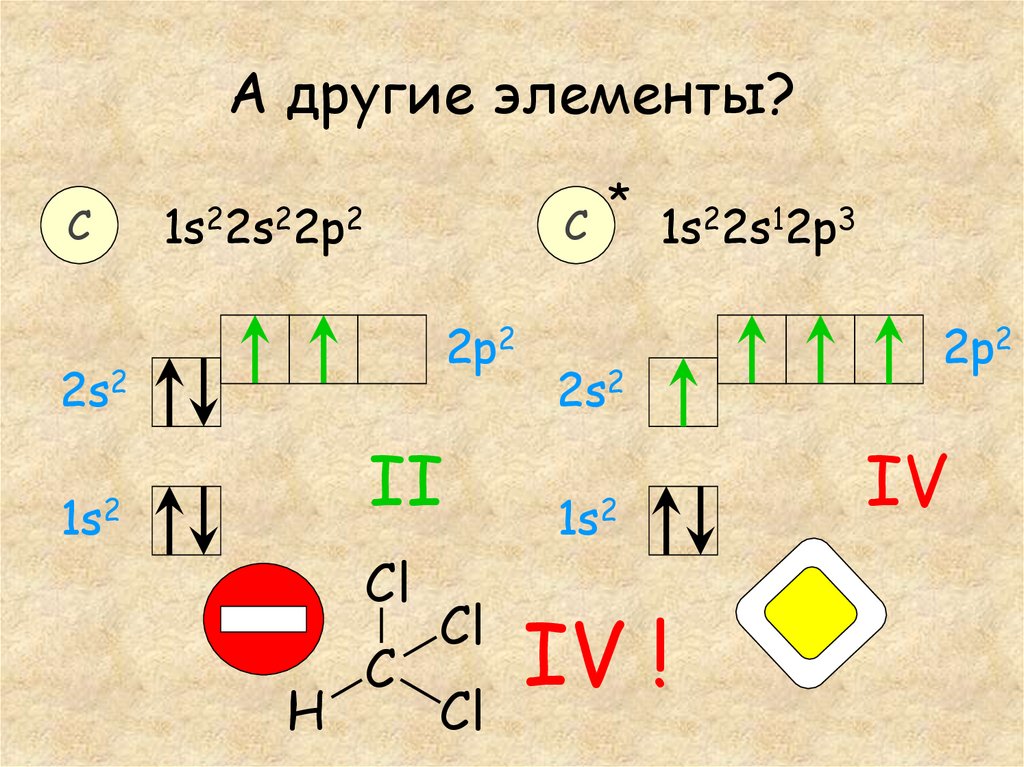
9. А другие элементы?
С*
С
1s22s12p3
1s22s22p2
2p2
2s2
II
1s2
Cl
H
C
Cl
Cl
2s2
1s2
IV !
2p2
IV
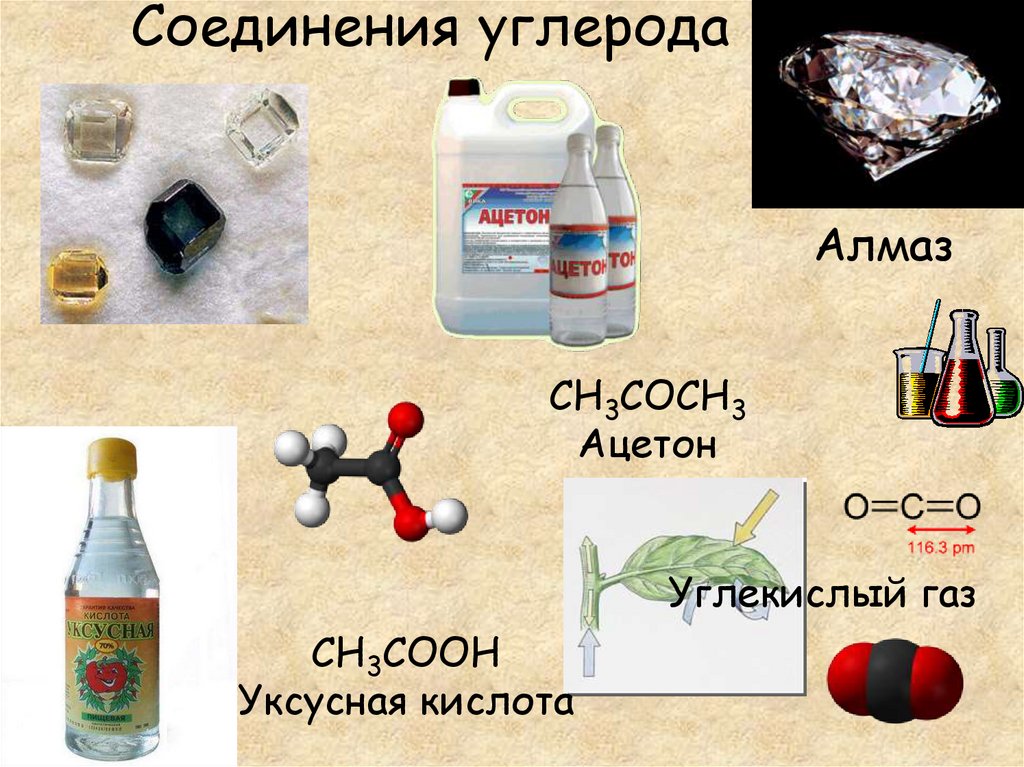
10. Соединения углерода
АлмазCH3COCH3
Ацетон
Углекислый газ
CH3COOH
Уксусная кислота
11. Нефть и природный газ – тоже соединения углерода
12. АЗОТ
N1s22s22p3
2p3
2s2
1s2
III
ЖИДКИЙ АЗОТ
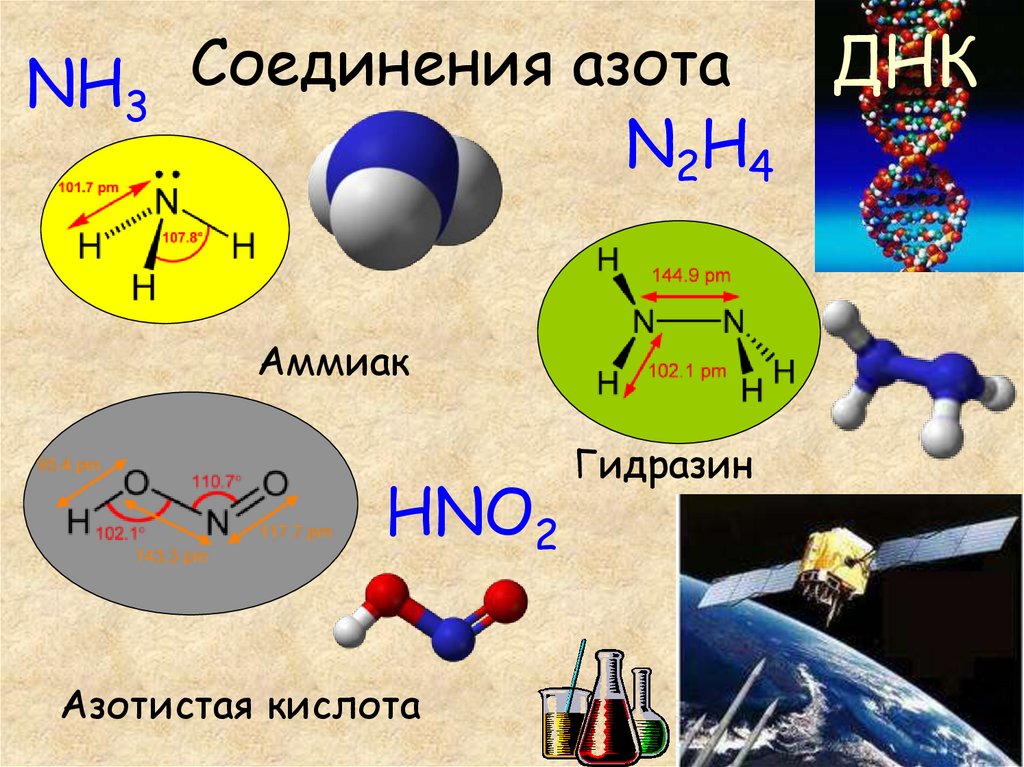
13. Соединения азота
ДНКNH3 Соединения азота
N2H4
Аммиак
HNO2
Азотистая кислота
Гидразин
14. Фосфор
электронные аналогиN
1s22s22p3
P
1s22s22p63s23p3
3s2
2s2
1s2
* 2 2 6 1 3 1
P 1s 2s 2p 3s 3p 3d
3d
3p3
2p6
III
V
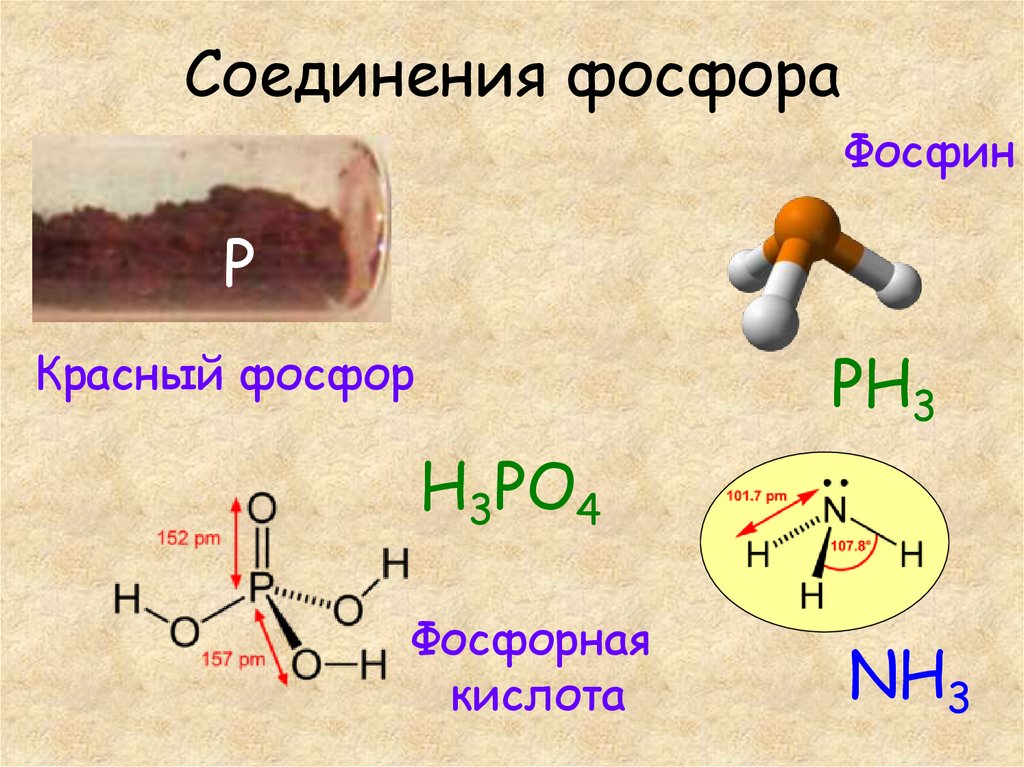
15. Соединения фосфора
ФосфинP
PH3
Красный фосфор
H3PO4
Фосфорная
кислота
NH3
16. Сера
S3s2
3s2
3s1
Электронный аналог
кислорода!
1s22s22p63s23p4
3p3
3p3
3p4
II
H
O
H
S
H
H
Вода Сероводород
3d1
3d2
IV
VI
17.
Самостоятельнаяработа
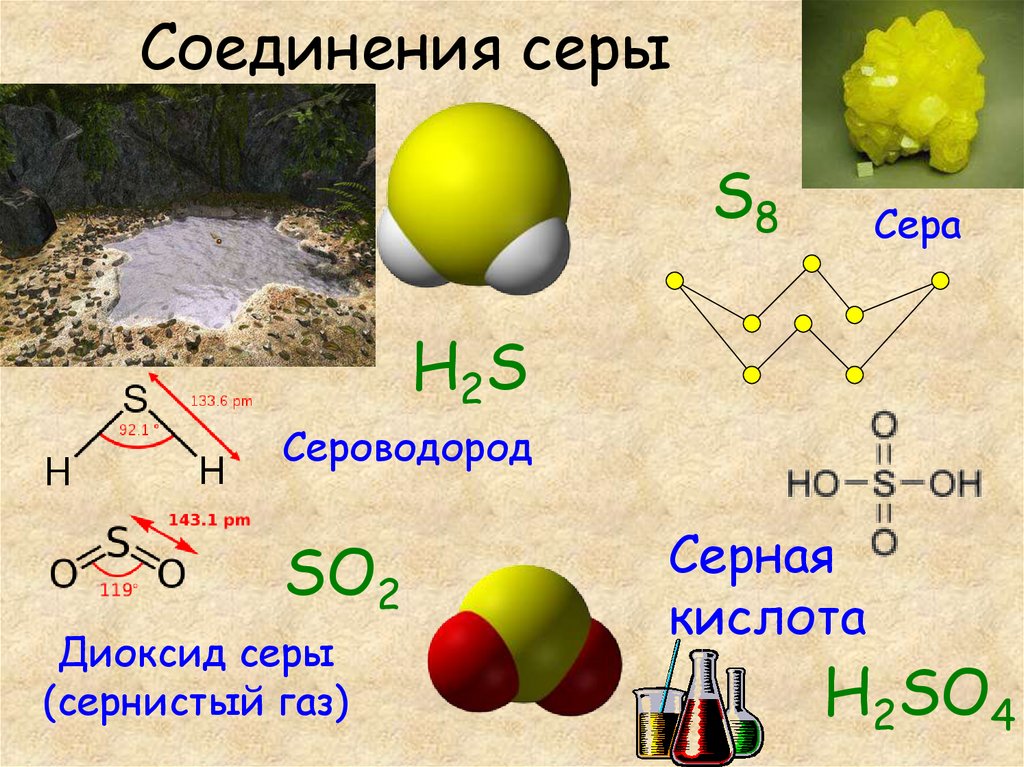
18. Соединения серы
S8Сера
H2S
Сероводород
SO2
Диоксид серы
(сернистый газ)
Серная
кислота
H2SO4










 Химия
Химия








