Похожие презентации:
Сернистый газ. Сернистая кислота и её соли
1. Сернистый газ. Сернистая кислота и её соли
2.
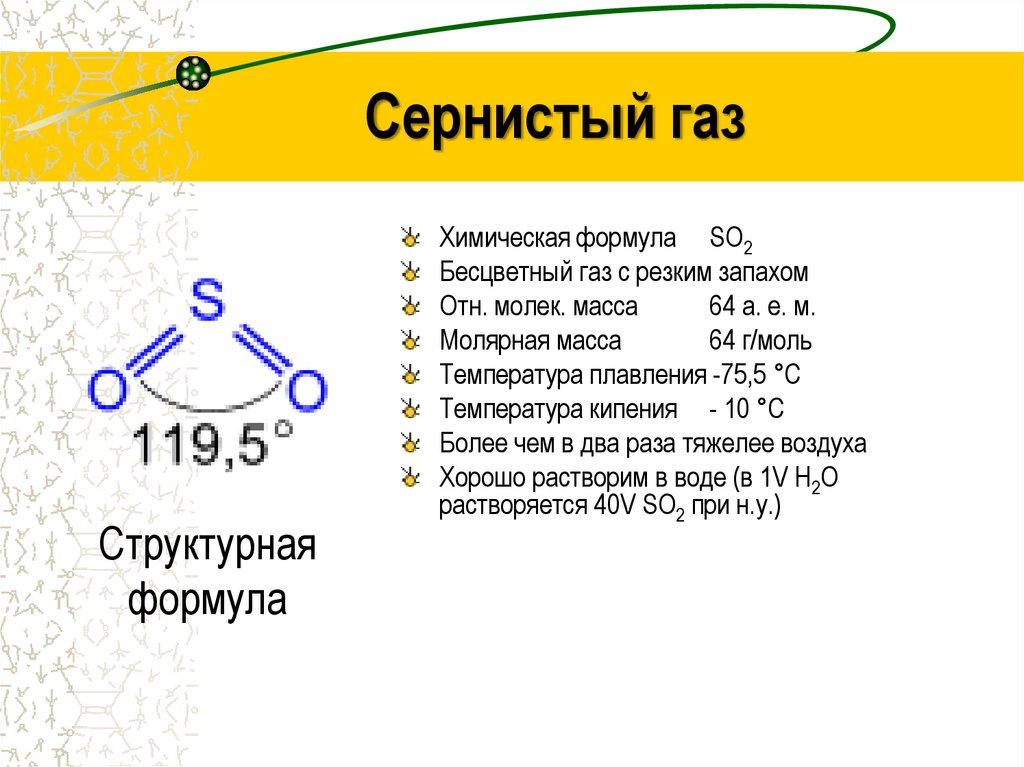
Сернистый газСтруктурная
формула
Химическая формула SO2
Бесцветный газ с резким запахом
Отн. молек. масса
64 а. е. м.
Молярная масса
64 г/моль
Температура плавления -75,5 °C
Температура кипения - 10 °C
Более чем в два раза тяжелее воздуха
Хорошо растворим в воде (в 1V H2O
растворяется 40V SO2 при н.у.)
3. Получение SO2
В промышленности: обжиг сульфидов:FeS2 + O2 → Fe2O3 + SO2↑
В лабораторных условиях: взаимодействие сульфитов с
сильными кислотами:
Na2SO3 + 2HCl → 2NaCl + SO2↑ + H2O
При окислении металлов концентрированной серной кислотой:
Cu + H2SO4(конц) → CuSO4 + SO2↑ + H2O
4. Химические свойства
Взаимодействие с водойПри растворении в воде образуется слабая и неустойчивая
сернистая кислота H2SO3 (существует только в водном растворе)
SO2 + H2O ↔ H2SO3
5. Химические свойства
Взаимодействие со щелочами:Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2O
Ba(OH)2 + 2SO2 (избыток) → Ba(HSO3)2(гидросульфит бария)
Взаимодействие с основными оксидами (образуется соль):
SO2 + CaO = CaSO3
Реакции окисления, SO2 – восстановитель:
SO2 + O2 → SO3 (катализатор – V2O5)
Реакции восстановления, SO2 - окислитель
SO2 + С → S + СO2 (при нагревании)
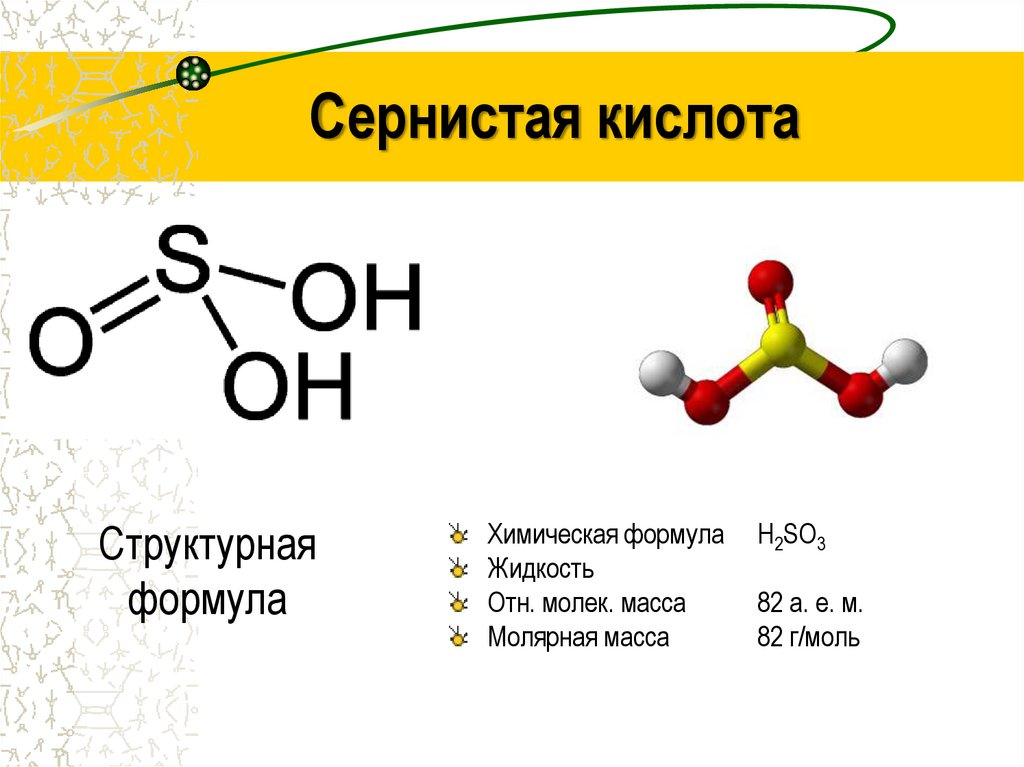
6.
Сернистая кислотаСтруктурная
формула
Химическая формула
Жидкость
Отн. молек. масса
Молярная масса
Н2SO3
82 а. е. м.
82 г/моль
7. Химические свойства
Сернистая кислота диссоциирует ступенчато:+
H2SO3 ↔ H + HSO3 (первая ступень, образуется
гидросульфит – анион)
-
+
2-
HSO3 ↔ H + SO3 (вторая ступень, образуется анион
сульфит)
H2SO3 образует два ряда солей:
- средние (сульфиты)
- кислые (гидросульфиты)
8. Химические свойства
Раствор сернистой кислоты обладает восстановительнымисвойствами:
H2SO3 + I2 + H2O = H2SO4 + НI
9. Самоконтроль
Осуществите превращения по схеме:S → H2S → SO2 → Na2SO3 → BaSO3 → SO2
Уравнения реакций ионного обмена напишите в полном
и кратком ионном виде.








 Химия
Химия








