Похожие презентации:
Скорость химических реакций. 11 класс
1. Скорость химических реакций
11 класс2.
Что такое химическая реакция?Что такое гомогенная и гетерогенная
реакция?
Что происходит с молекулами при
протекании химических реакций?
Какими энергетическими процессами
сопровождается химическая реакция?
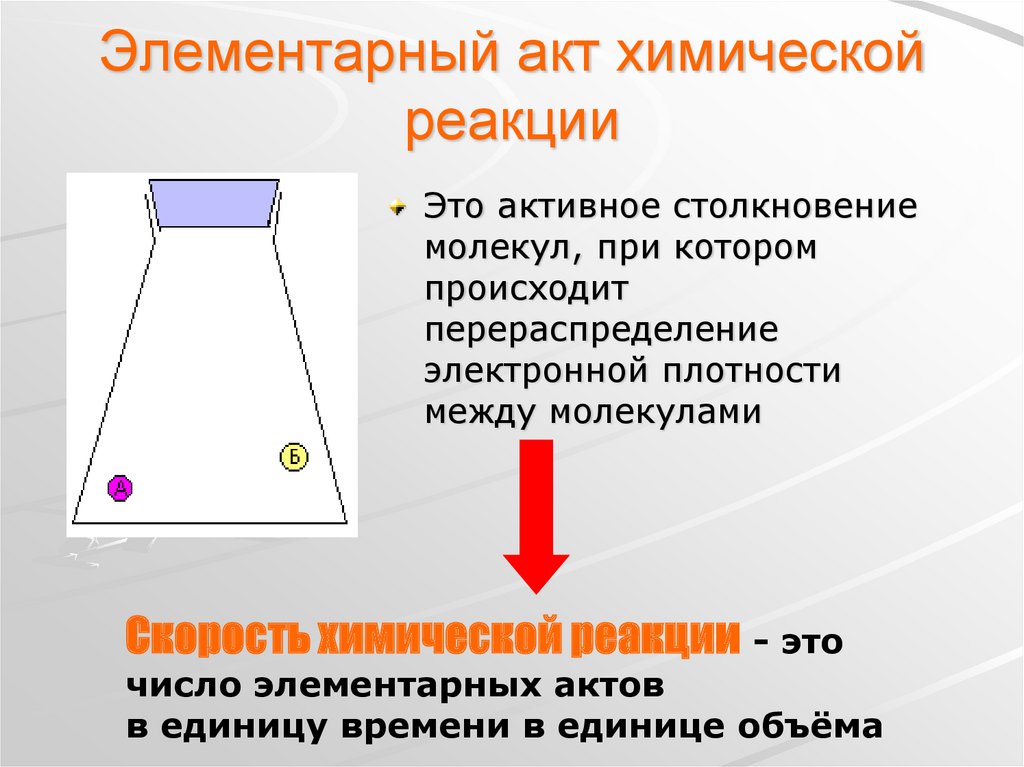
3. Элементарный акт химической реакции
Это активное столкновениемолекул, при котором
происходит
перераспределение
электронной плотности
между молекулами
Скорость химической реакции - это
число элементарных актов
в единицу времени в единице объёма
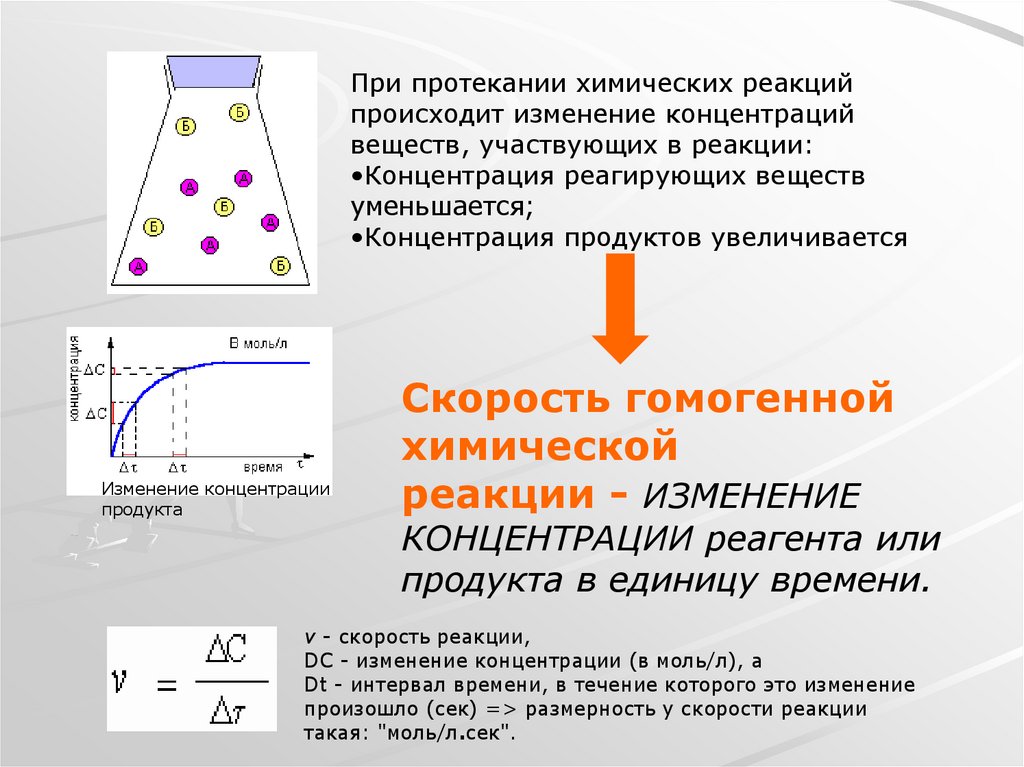
4.
При протекании химических реакцийпроисходит изменение концентраций
веществ, участвующих в реакции:
•Концентрация реагирующих веществ
уменьшается;
•Концентрация продуктов увеличивается
Изменение концентрации
продукта
Скорость гомогенной
химической
реакции - ИЗМЕНЕНИЕ
КОНЦЕНТРАЦИИ реагента или
продукта в единицу времени.
v - скорость реакции,
DC - изменение концентрации (в моль/л), а
Dt - интервал времени, в течение которого это изменение
произошло (сек) => размерность у скорости реакции
такая: "моль/л.сек".
5. Факторы, влияющие на скорость реакции
Природа реагирующих веществПлощадь поверхности твердого
вещества
Концентрация реагирующих
веществ
Температура
Катализатор
6. Природа реагирующих веществ (Попробуй сам)
Напиши уравненияхимических реакций.
Налейте в пробирку
соляную кислоту и
добавьте несколько
гранул цинка
во вторую пробирку с
гранулами цинка
прилейте уксусную
кислоту.
В какой пробирке реакция
протекала быстрее?
Почему?
7. Площадь поверхности твердого вещества (попробуй сам)
Налейте в 2пробирки уксусную
кислоту
В одну пробирку
добавьте кусочек
мрамора
Растолките кусочек
мела и высыпьте в
вторую пробирку
Напишите уравнение
реакции
Как зависит скорость
реакции от площади
поверхности
твердого вещества?
Каким образом вы
увеличили площадь
поверхности
твердого вещества?
8. Концентрация реагирующих веществ. (подумай сам)
в две пробирки налейтесоляную кислоту:
В 1-ую – добавьте объем
воды, равный объёму
кислоты и киньте
несколько гранул цинка;
Во 2-ую – добавьте
гранулы цинка без
добавления воды.
Как влияет концентрация
кислоты на скорость
реакции?
Как влияет
концентрация
реагирующих веществ
на скорость
химической реакции?
Почему?
9. Закон действующих масс
Математически зависимостьскорости от концентрации для
реакции: А + Б = АБ
выражается следующим образом:
v = k[А][Б], где
V – скорость реакции;
K – константа скорости;
[А] и [Б] – концентрации веществ А
и Б соответственно
10. Думай самостоятельно
Напиши выражение закона действующих массдля реакции:
2Н2 + О2 = 2Н2О
(подсказка: представь реакцию в следующем
виде Н2 + Н2 + О2 = 2Н2О)
Напиши выражение закона действующих масс
для реакции:
аА + bВ = С
11. Догадался… Молодец!
Для реакции: 2Н2 + О2 = 2Н2ОV = k[Н2]2[О2]
Для реакции: аА + bВ = С
Скорость химической реакции прямо пропорциональна произведению
концентраций реагирующих веществ в степенях их стехиометрических
коэффициентов. Это определение относится к гомогенным реакциям. Если
реакция гетерогенная (реагенты находятся в разных агрегатных состояниях),
то в уравнение ЗДМ входят только жидкие или только газообразные реагенты,
а твердые исключаются, оказывая влияние только на константу скорости k.
12.
Константа скорости k численно равна скорости, есликонцентрации реагентов постоянны и равны единице.
Константа скорости k дает химикам возможность
КОЛИЧЕСТВЕННО обсуждать вопросы, связанные с
изучением скоростей реакций. Приведем пример.
Реакция
Условия
Кинетическое
уравнение
k
H+ + OH- = H2O
20 oC
v = k[H+][OH-]
1,4.1011
л/моль.сек
NH4+ = NH3 + H+1
20 oC1
v = k[NH4+]1
24 л/моль.сек
Измеренные константы скоростей приведенных реакций
позволяют уже не просто говорить о том, что реакция
нейтрализации (H+ + OH-) протекает намного быстрее
реакции разложения иона аммония. Можно рассуждать
количественно: при 20оС реакция нейтрализации протекает в
6*109 раз быстрее, чем реакция распада иона аммония на
аммиак и ион водорода.
13. Задачи
1. 2 л раствора вещества А (концентрация 0,6моль/л) смешали для реакции с 3 л раствора
вещества Б (1 моль/л). Какова начальная
концентрация веществ А и Б в полученном
растворе?
2. Оксид азота (II) NO окисляется кислородом О2 с
образованием оксида азота (IV) NO2 (в газовой
фазе). Кинетическое уравнение этой реакции
соответствует полному химическому уравнению.
Как изменится скорость реакции, если давление
увеличить в два раза?
3. Реакция А + Б = В является бимолекулярной.
Начальные концентрации веществ таковы: [А]н =
2,5 моль/л, [Б]н = 1,5 моль/л. Константа скорости
реакции k = 0,8 л/моль.сек. Вычислите
концентрацию вещества [А] и скорость реакции к
моменту, когда концентрация вещества [Б] составит
0,5 моль/л.
14. Влияние температуры на скорость реакции
В 2 пробирки налейтеуксусной кислоты и добавьте
несколько гранул цинка;
Одну пробирку нагрейте.
Вопрос. В какой из пробирок
реакция пойдет быстрее?
Почему? Как влияет
температура на скорость
реакции?
15. Правило Вант - Гоффа
При увеличении температура накаждые 100 скорость реакции
увеличивается в 2-4 раза. Число,
показывающее, во сколько раз
увеличится скорость, называется
температурный коэффициент (Υ)
Подумай! Если температуру
увеличить на 300 (Υ= 2), во
сколько раз увеличится скорость
реакции?
16. Математическое выражение правила Вант- Гоффа
V2/ V1 =Задача.
t/10
Υ
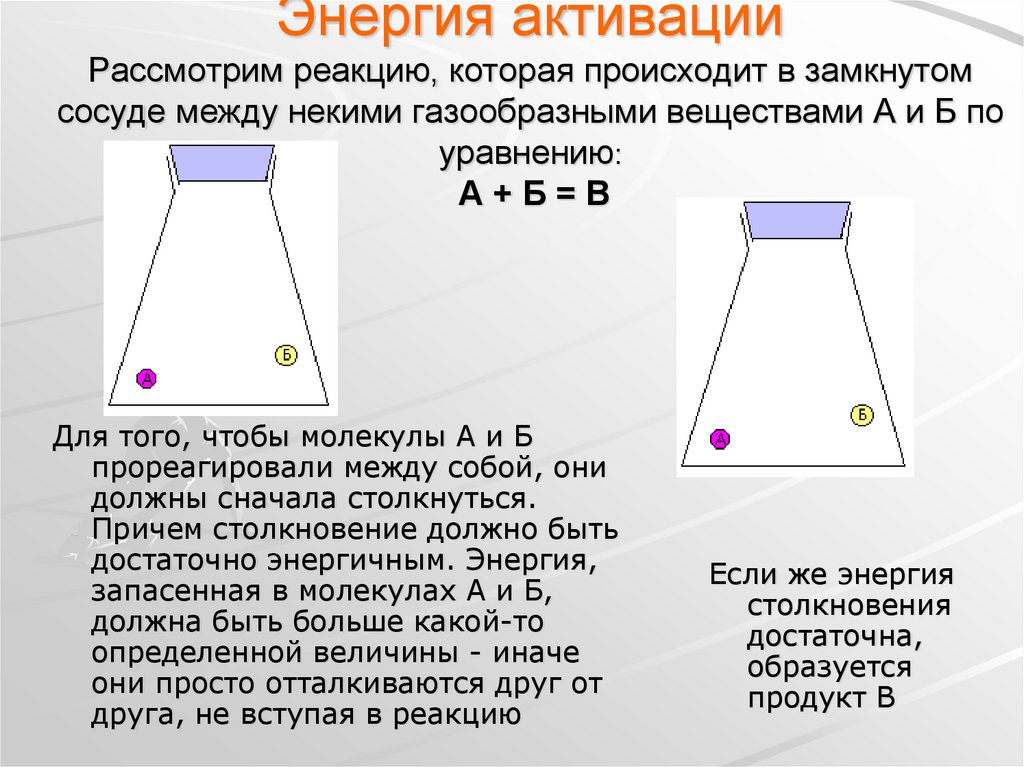
17. Энергия активации Рассмотрим реакцию, которая происходит в замкнутом сосуде между некими газообразными веществами А и Б по
уравнению:А+Б=В
Для того, чтобы молекулы А и Б
прореагировали между собой, они
должны сначала столкнуться.
Причем столкновение должно быть
достаточно энергичным. Энергия,
запасенная в молекулах А и Б,
должна быть больше какой-то
определенной величины - иначе
они просто отталкиваются друг от
друга, не вступая в реакцию
Если же энергия
столкновения
достаточна,
образуется
продукт В
18. Энергия активации
Мерой "энергичности" молекулможет служить, например, скорость
их движения, которая возрастает с
повышением температуры газа.
Кстати, тепло или холод мы
воспринимаем именно как
результат столкновений
окружающих нас "быстрых" или
"медленных" молекул атмосферы с
нашей кожей.
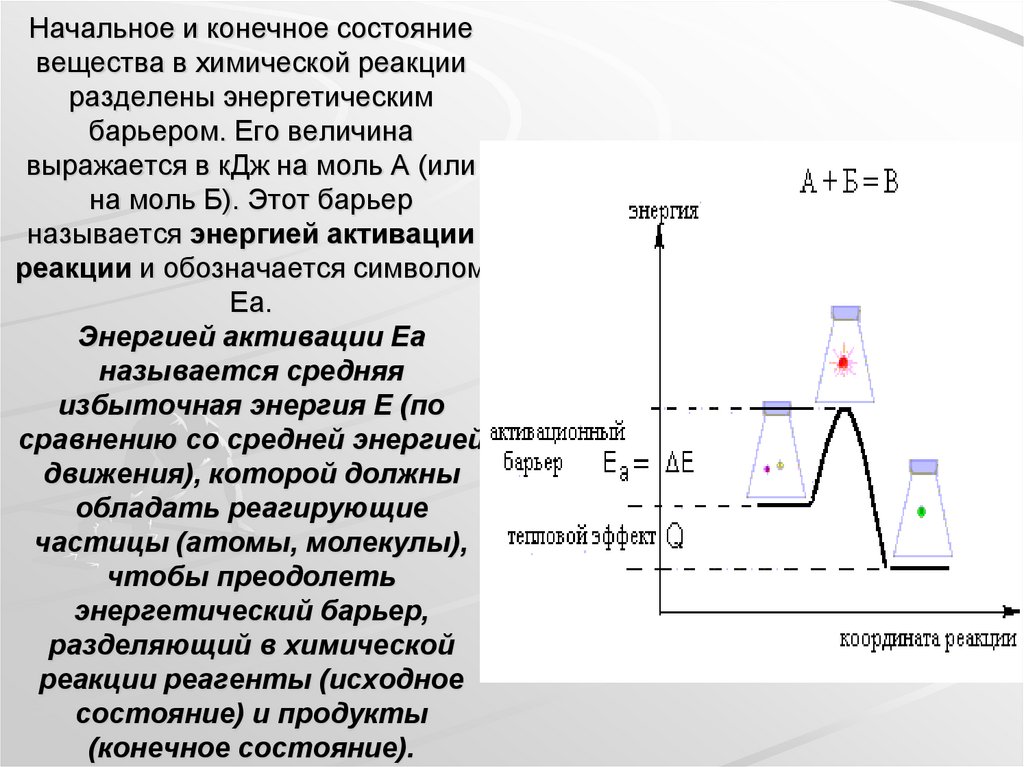
19. Начальное и конечное состояние вещества в химической реакции разделены энергетическим барьером. Его величина выражается в кДж
на моль А (илина моль Б). Этот барьер
называется энергией активации
реакции и обозначается символом
Еа.
Энергией активации Еа
называется средняя
избыточная энергия Е (по
сравнению со средней энергией
движения), которой должны
обладать реагирующие
частицы (атомы, молекулы),
чтобы преодолеть
энергетический барьер,
разделяющий в химической
реакции реагенты (исходное
состояние) и продукты
(конечное состояние).
20. Энергия активации и скорость реакции
До сих пор мы сравнивали ОДНУ И ТУ ЖЕ реакцию при разныхтемпературах. Если же сравнить между собой РАЗЛИЧНЫЕ
химические реакции, протекающие в одинаковых условиях, то
выясняется следующее.
Для каждой химической реакции характерно свое собственное
значение Еа (не зависящее от температуры). В большинстве
случаев энергия активации химических реакций между
нейтральными молекулами составляет от 80 до 240 кДж/моль.
Чем НИЖЕ активационный барьер Еа какой-либо химической
реакции, тем БЫСТРЕЕ она идет в данных условиях, потому что
большее число молекул А и Б способны преодолевать барьер в
единицу времени.
Если в другой химической реакции активационный барьер
ВЫШЕ, то такая реакция в тех же условиях идет МЕДЛЕННЕЕ.
Если барьер очень высок, в системе вообще нет молекул,
способных преодолеть активационный барьер и реакция не
происходит.
Подумай! Какие реакции протекают мгновенно, так как их
энергия активации равна нулю?
21. Почему все возможные реакции ещё не произошли?
Итак, мы видим, что для протекания химической реакциимолекулы исходных веществ должны сначала преодолеть
активационный барьер Еа. Таким образом, активационный
барьер может являться препятствием для
самопроизвольного протекания даже очень "выгодных" с
энергетической точки зрения экзотермических реакций.
Например, если бы не было активационного барьера,
реакция горения метана в кислороде начиналась бы сразу
после соприкосновения метана с воздухом. В этом случае
не только природный газ (в нем 95% метана), но и нефть,
бензин, уголь, бумагу, одежду, мебель, деревянные
постройки и все, что в принципе может гореть, пришлось
бы тщательно изолировать от воздуха. К счастью, на пути
самопроизвольного протекания этих экзотермических
реакций стоит активационный барьер Еа.
Когда мы подносим горящую спичку к открытой конфорке
газовой плиты, мы заставляем какую-то часть молекул
метана и кислорода "перескочить" активационный барьер,
не преодолимый при комнатной температуре. В
дальнейшем энергия активации для взаимодействия все
новых и новых молекул метана и кислорода черпается уже
из тепла самой экзотермической реакции.
22. Катализ (попробуй сам)
Налейте в пробирку небольшое количествоперекиси водорода и добавьте оксида
марганца(IV). Что вы наблюдаете? Чтобы
определить газ, опустите в пробирку тлеющую
лучинку.
Оксид марганца является катализатором
реакции разложения перекиси водорода.
Подумай! 1.Почему стало возможно протекание
данной реакции при комнатной температуре?
2. Почему тлеющая лучинка вспыхнула в
пробирке? Что повлияло на скорость реакции
горения?
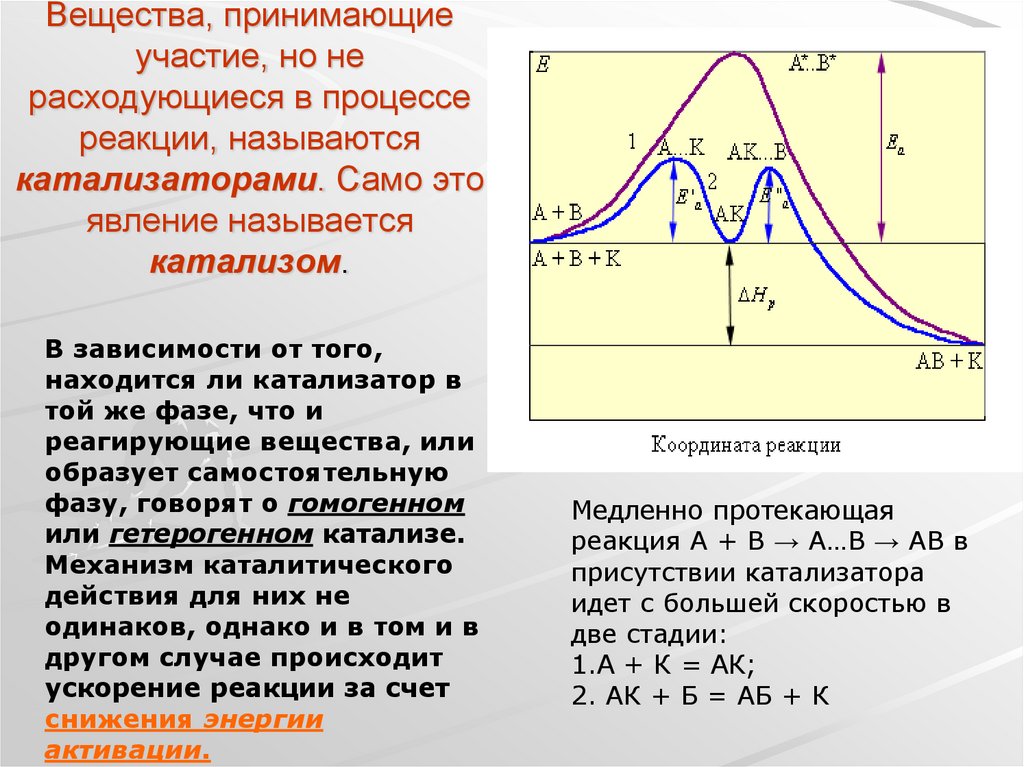
23. Вещества, принимающие участие, но не расходующиеся в процессе реакции, называются катализаторами. Само это явление называется
катализом.В зависимости от того,
находится ли катализатор в
той же фазе, что и
реагирующие вещества, или
образует самостоятельную
фазу, говорят о гомогенном
или гетерогенном катализе.
Механизм каталитического
действия для них не
одинаков, однако и в том и в
другом случае происходит
ускорение реакции за счет
снижения энергии
активации.
Медленно протекающая
реакция A + B → А…B → AB в
присутствии катализатора
идет с большей скоростью в
две стадии:
1.А + К = АК;
2. АК + Б = АБ + К
24. Проверь себя
А1. Катализатор повышает скорость реакции, так как:А) увеличивает число столкновений молекул в единицу времени;
Б) увеличивает скорость движения молекул;
В) увеличивает энергию активации реакции;
Г) уменьшает энергию активации реакции.
А2. Для какой реакции кинетическое уравнение имеет вид: V=k О2
А) S + O2 = SO2
Б) 2Н2 + О2 = 2Н2О
В) N2 + O2 = 2NO
Г) 2СО + О2 = 2СО2
А3. Константа скорости химической реакции зависит от:
А) температуры и концентрации реагирующих веществ;
Б) концентрации и природы реагирующих веществ;
В) концентрации и площади соприкосновения реагирующих веществ;
Г) температуры и природы реагирующих веществ.
25. Проверь себя
Б1. Скорость синтеза аммиака при повышенииконцентраций азота и водорода в три раза
увеличивается в … раз. (Ответ запишите цифрами).
Б2. Для того, чтобы скорость реакции 2NO + O2 = 2NO2
возросла в 1000 раз, давление в системе нужно
увеличить в … раз. (Ответ запишите цифрами).
Б3. При повышении температуры на 600 скорость
химической реакции увеличилась в 64 раза.
Следовательно, температурный коэффициент этой
реакции равен … (Ответ запишите цифрами).
Б4. Две реакции протекают при 200 с одинаковой
скоростью. Температурный коэффициент скорости
первой реакции равен 2, а второй – 4. Отношение
скоростей этих реакций при 700 равно…(Ответ
запишите цифрами).




















 Химия
Химия








