Похожие презентации:
Сероводород. Сульфиды
1.
Сероводород. Сульфиды.2.
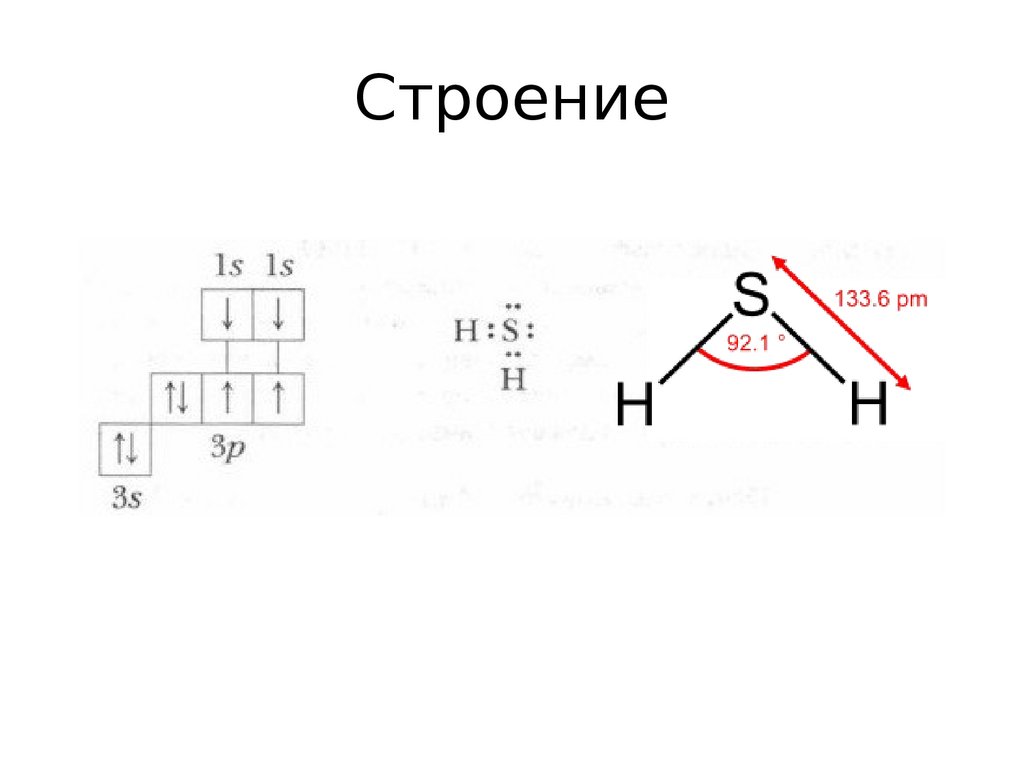
Строение3.
Физические свойства• Бесцветный газ с запахом тухлых
яиц
• Растворим в воде (в 1V H2O
растворяется 3V H2S при н.у.)
• Тяжелее воздуха
• t°пл. = -86°C
• t°кип. = -60°С.
4.
Влияние на организмВнимание!
Ядовит. При вдыхании этого газа в
большом количестве быстро наступает
паралич дыхательных нервов и человек
перестает ощущать запах.
Какой вывод из этого следует? Какие
меры безопасности нужно
предпринимать при работе с
сероводородом?
5.
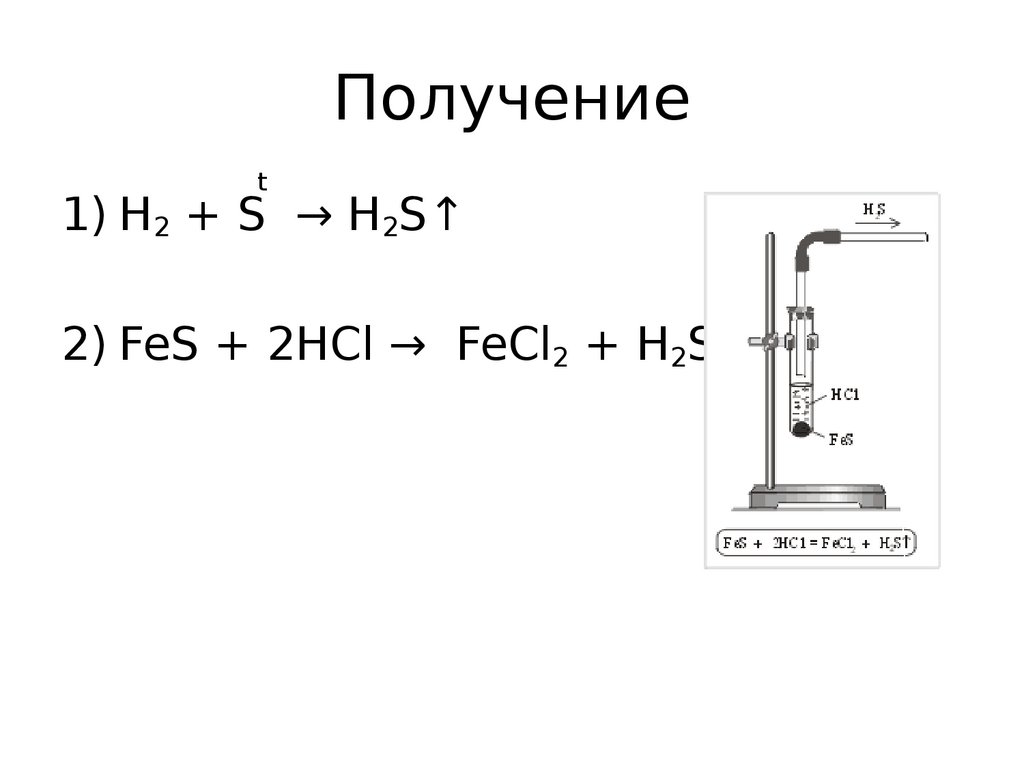
Получениеt
1) H2 + S → H2S↑
2) FeS + 2HCl → FeCl2 + H2S↑
6.
Химические свойствасероводорода
1) Взаимодействие с водой.
(Диссоциация)
1 ступень: H2S → H+ + HS(образуется гидросульфид
- ион)
2 ступень: HS- → H+ + S2(образуется сульфид ион)
7.
Химические свойства2)
Взаимодействие с основаниями.(Образуются
средние (сульфиды) и кислые (гидросульфиды)
соли):
H2S + NaOH → H2O + NaHS – гидросульфид натрия;
H2S + 2NaOH → 2H2O + Na2S – сульфид натрия;
Какая соль образуется в первую очередь?
А как можно превратить кислую соль в среднюю?
Добавить основание:
NaHS + NaOH → H2O + Na2S
8.
Химические свойства3)
Сильный восстановитель.
H2S + Br2 → S + 2HBr
4)
Горение (окисление) сероводорода.
при избытке O2 : 2H2S + 3O2 → 2S02 + 2H2O
при недостатке O2 : 2H2S + O2 → 2H2O + 2S
5)
Серебро при контакте с
сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
9.
Химические свойства6) Качественная реакция на сероводород и растворимые
сульфиды - образование темно-коричневого (почти
черного) осадка PbS или черного осадка сульфида меди
CuS:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Запишите эту реакцию в полной и сокращенной ионной
форме:
2H+ + S2- + Pb2+ + 2NO3- → PbS↓+ 2H+ + 2NO3-- Полная
форма
Pb2+ + S2- → PbS↓ - Сокращенная форма
Предложите свою химическую реакцию, которая отвечала
бы этому сокращенному ионному уравнению.
10.
В искусствеЗагрязнение атмосферы вызывает
почернение поверхности картин,
написанных масляными красками, в
состав которых входят свинцовые
белила.
Свинцовые белила – это пигмент,
представляющий собой карбонат свинца
Черный
(II).
PbCO3 + H2S = PbS↓ + CO2 + H2O
11.
Реставрация: При обработке сульфидасвинца (II) пероксидом водорода
происходит реакция:
PbS + 4H2O2 = Белый
PbSO4 + 4H2O
12.
Химические свойствасульфидов
1) Гидролиз (взаимодействие ионов соли с водой
с образованием малодиссоциирующих веществ)
K2S + H2O → KHS + KOH
S2- + H2O → HS- + OHвследствие чего их водные растворы имеют
щелочную реакцию
2) С сильными кислотами
ZnS + H2SO4 → ZnSO4 + H2S
3) С концентрированной азотной кислотой.
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
13.
Решим задачу• Сероводород пропустили через
18%-ый раствор сульфата меди (II)
массой 200 г. Вычислите массу
осадка, выпавшего в результате
этой реакции.
14.
Домашнее задание• Параграф 18
• Задание №1:
Сероводород пропустили через 25%-ый
раствор нитрата свинца массой 450 г.
Вычислите массу осадка, выпавшего в
результате этой реакции.
• Задание №2:
Определите объём сероводорода (н.у.),
образовавшегося при взаимодействии
соляной кислоты с 25% - ым раствором
сульфида железа (II) массой 2 кг?












 Химия
Химия








