Похожие презентации:
Кислородсодержащие соединения серы (VI)
1.
Кислородсодержащиесоединения серы (VI).
2.
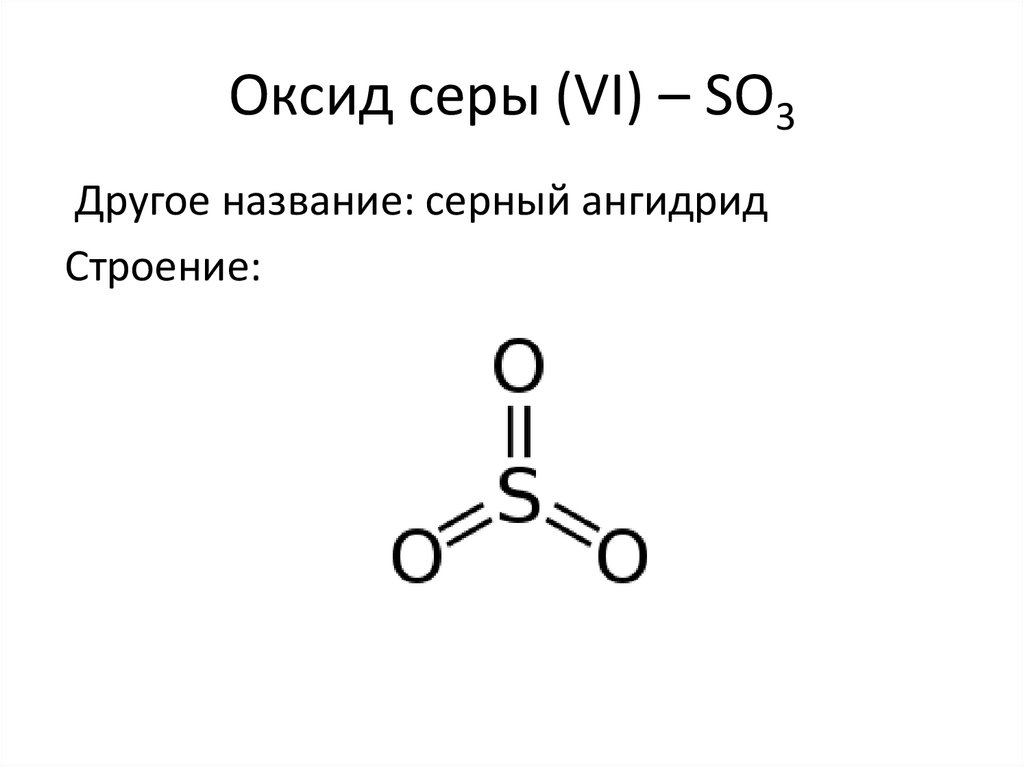
Оксид серы (VI) – SO3Другое название: серный ангидрид
Строение:
3.
Физические свойства- бесцветная жидкость
- при температуре ниже 17°С превращается
в белую кристаллическую массу
- очень гигроскопичен (хорошо поглощает
влагу)
- растворяется в воде с выделением
большого количества тепла.
4.
ПолучениеКаталитическое окисление оксида серы (VI)
t, кат.
SO2 + O2
SO3
Реакция обратима!
5.
Химические свойства:1) SO3 - кислотный оксид.
SO3 + H2O → H2SO4 + Q
Реакция необратима!
2) SO3 - сильный окислитель:
5SO3 + 2P → 5SO2 + P2O5
Обычно восстанавливается до SO2.
6.
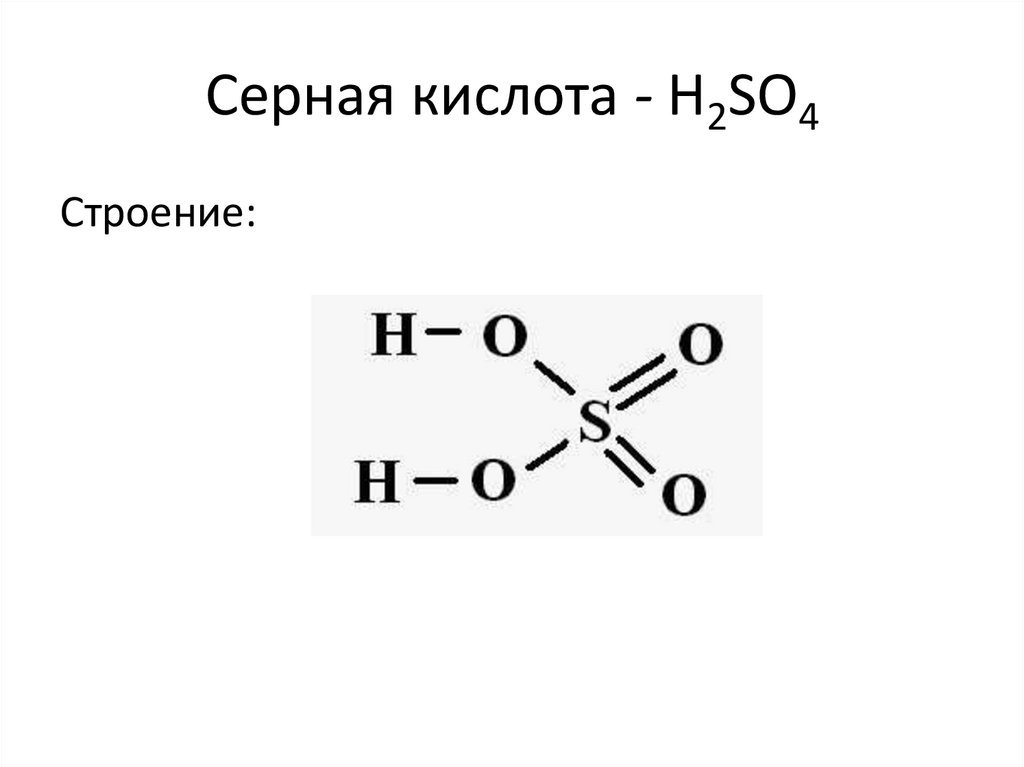
Серная кислота - H2SO4Строение:
7.
Физические свойства- безводная H2SO4 - бесцветную маслянистую
жидкость без запаха
- при температуре ≈ 10°С переходит в твердое
состояние
- Ткип. = 280°С
- плотность серной кислоты почти в два раза
больше чем у воды
- смешивается с водой в любых соотношениях
- очень гигроскопична (хорошо поглощает
влагу из окружающего воздуха)
- при растворении серной кислоты в воде
выделяется большое количество тепла
8.
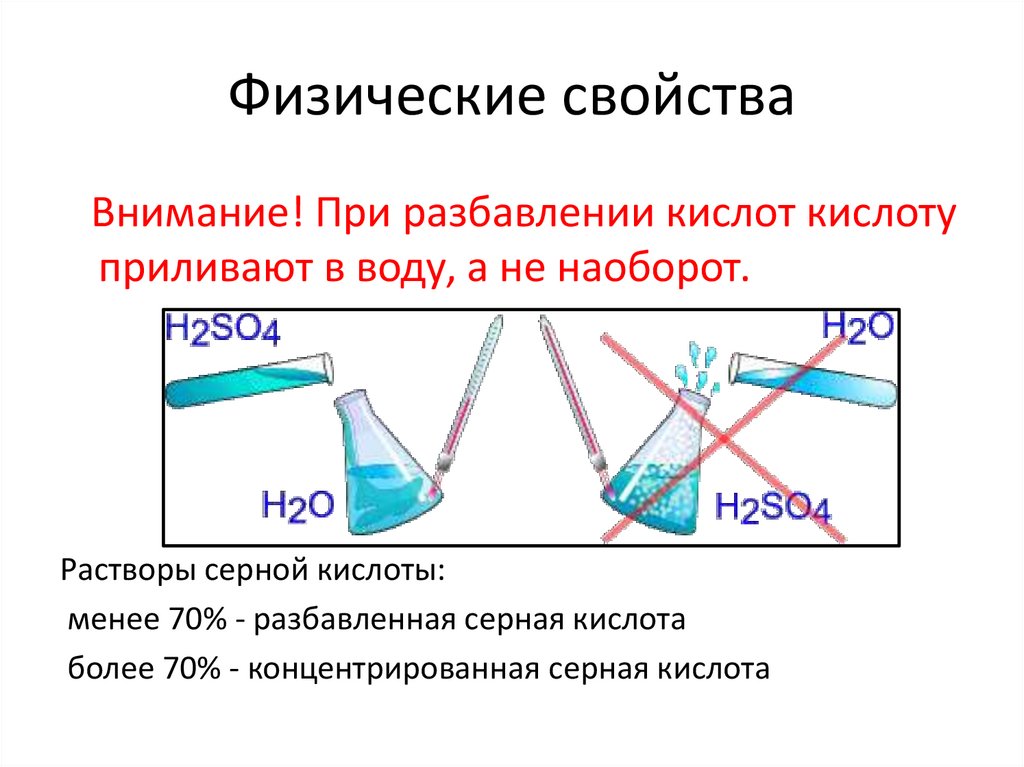
Физические свойстваВнимание! При разбавлении кислот кислоту
приливают в воду, а не наоборот.
Растворы серной кислоты:
менее 70% - разбавленная серная кислота
более 70% - концентрированная серная кислота
9.
Получение в промышленностиКонтактный способ:
• Первая стадия
S + O2 → SO2
или
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
• Вторая стадия
2SO2 + O2 → 2SO3
• Третья стадия
SO3 + H2O → H2SO4 + Q
10.
Получение в промышленностиПрактически образующийся SO3 растворяют
не в воде, а в ранее полученной
концентрированной серной кислоте.
Раствор SO3 в H2SO4 называют олеумом. При
разбавлении олеума водой получают
серную кислоту той или иной
концентрации.
11.
Домашнее задание• § 20
• Задача: Сколько грамм углерода
прореагировало с концентрированной
серной кислотой, если в ходе реакции
выделилось 4л углекислого газа.
12.
Химические свойства сернойкислоты
13.
Химические разбавленной сернойкислоты свойства
1) Растворы кислот имеют кислую среду, т.е. [H+] > [OH-] и
меняют окраску индикаторов:
лакмус – красный
метилоранж – красный,
фенолфталеин – бесцветный
2) Разбавленная серная кислота реагирует с металлами (с
образованием солей – сульфатов и водорода):
H2SO4 (разб.) + Zn → ZnSO4 + H2 ↑
3) Реагирует с основными и амфотерными оксидами:
H2SO4 + MgO → MgSO4 + H2O
3H2SO4 + Al2O3 → 3H2O + Al2(SO4)3
14.
Химические разбавленной сернойкислоты свойства
4) Взаимодействует с основаниями (со
щелочами - реакция нейтрализации):
H2SO4 + 2KOH → K2SO4 + 2H2O
Если кислота взята в избытке – образуется
кислая соль:
H2SO4 (изб.) + KOH → KНSO4 + H2O
5) Реагирует с солями:
3H2SO4 + Сa3(PO4)2 → 3CaSO4 + 2H3PO4
15.
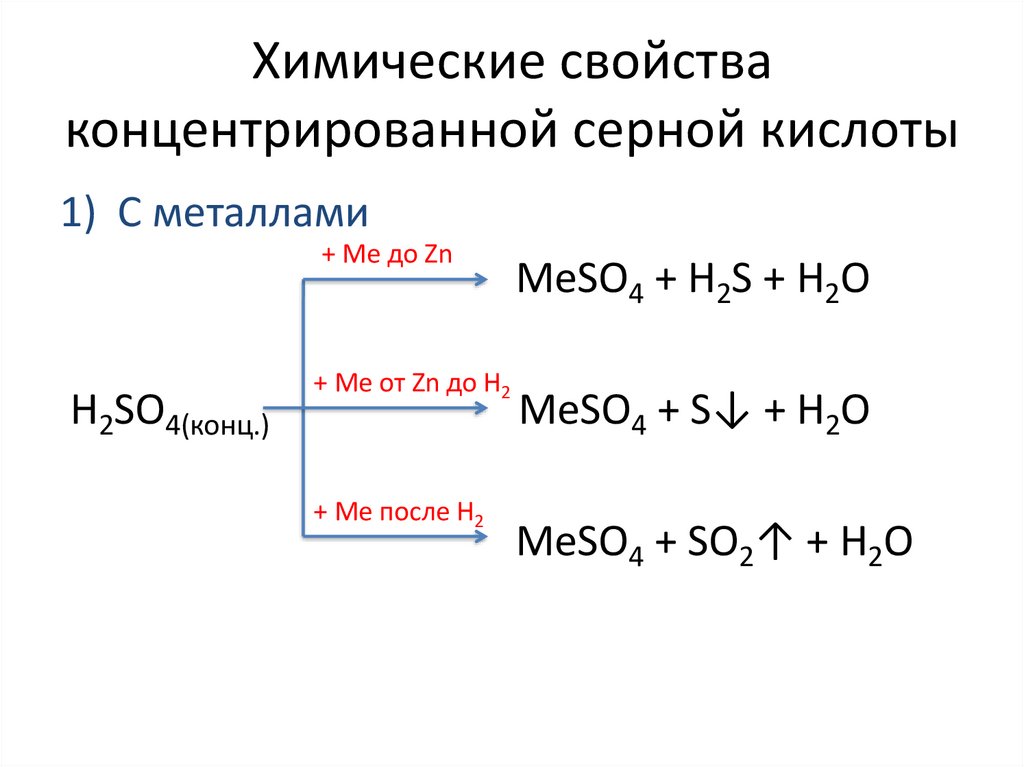
Химические свойстваконцентрированной серной кислоты
1) С металлами
+ Ме до Zn
H2SO4(конц.)
+ Ме от Zn до H2
+ Ме после H2
MeSO4 + H2S + H2O
MeSO4 + S↓ + H2O
MeSO4 + SO2↑ + H2O
16.
1. "Ничего непонятно, ноочень интересно".
Объясните мем
2. Придумайте свою
версию мема! Какие
металлы можно
подставить на место
принцессы так, чтобы
смысл сохранился?
3. А что будет, если увеличить температуру или разбавить
кислоту?
Бонус: напишите по уравнению реакции на оба случая и
уравняйте их методом электронного баланса.
17.
2) С неметалламиC + 2H2SO4(конц.) → CO2 + 2SO2 + 2H2O
S + 2H2SO4(конц.) → 3SO2 + 2H2O
3) Со сложными веществами
C12H22O22 + H2SO4(конц.) → 12C + H2SO4*11H2O
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
18.
1. Представьте, чтоВы увидели этот мем в сети,
а под ним комментарий
"Ничего не понятно,
вызываю пояснительную
бригаду!". Как бы Вы
помогли комментатору?
2. Какое уравнение реакции может доказать ваше
объяснение? Напишите уравнения реакций в
молекулярном и ионном виде
3. Придумайте свою версию мема! Какие ионы можно
подставить на место персонажей так, чтобы смысл
сохранился?
19.
Закрепление материалаЗадача: Вычислите какой объем (при н.у.)
диоксида серы образуется при
взаимодействии 320г серы с
концентрированной серной кислотой.
20.
Закрепление материалаОсуществите превращения по схеме:
S → SO2 → SO3 → H2SO4 → K2SO4
21.
Домашнее задание• § 20 (до стр. 101)
• стр. 105 №5

















 Химия
Химия








