Похожие презентации:
Ковалентная связь и ее виды
1.
КОВАЛЕНТНАЯСВЯЗЬ И ЕЕ ВИДЫ.
2.
«Ум заключается не только взнании, но и в умении применять
знание на деле»
Аристотель
3.
Задание:1. составьте схемы строения атомов Na, Cl, Ar
2. ответьте на вопросы:
■ Вид атомов с одинаковым зарядом ядра.
■ Мельчайшая, химически неделимая, частица
■ В центре атома находится заряженное ……
■ Ядра атомов состоят из ………и…….
■ Вокруг ядра по замкнутым орбитам вращаются отрицательно заряженные……
4.
Причиной образования химической связиявляется стремление атомов путем
взаимодействия с другими атомами
достичь более устойчивой электронной
структуры, подобной структуре инертных
элементов
5.
Сила, соединяющая два или нескольковзаимодействующих атомов в молекулы
или другие частицы, называется
химической связью
6.
■В виде свободных (изолированных) атомовсуществуют только…
Гелий He, неон Ne, аргон Ar, криптон Kr,
ксенон Xe и радон Rn.
Из-за высокой устойчивости их электронных
структур
■Все другие вещества состоят из связанных
атомов.
7.
В зависимости от способа соединенияатомов различают:
■ 1. Ковалентную – между атомами за счет
образования общих электронных пар;
■ 2.Ионную – образуется между ионами;
■ 3. Металлическую - между атомами
элементов металлов.
8.
Ковалентная связь (КС)■ Химическая связь между атомами, осуществляемая общими
электронными парами называется ковалентной
■ Главную роль при образовании химической связи между атомами
играют их валентные электроны (электроны, участвующие в
образовании химической связи, которые находятся на внешнем
электронном слое и наименее прочно связаны с ядром атома).
Валентные электроны неспаренные. Их число определяют по
формуле:
■ 8 - № группы, в которой находится элемент = число неспаренных
электронов.
■ Валентность – способность атомов образовывать определенное
число связей с атомами других химических элементов
9.
Существует ковалентная неполярная и ковалентнаяполярная связь
Рассмотрим образование молекулы Н2
Каждый атом водорода имеет по одному неспаренному
электрону. При взаимодействии атомов электроны образуют
общую электронную пару. При этом, каждый атом
приобретает завершенный энергетический уровень.
10.
Образование ковалентной связи вмолекуле Cl2
■ Электронная формула: 3s23p5
■ Электронно-графическая формула:
Образование молекулы Cl2:
11.
Образование кратных связей напримере молекулы N2
■ электронная формула: 2s22p3
■ электронно-графическая формула:
■ Образование молекулы N2 (в результате атом азота
приобретает устойчивую структуру 2s22p6)
12.
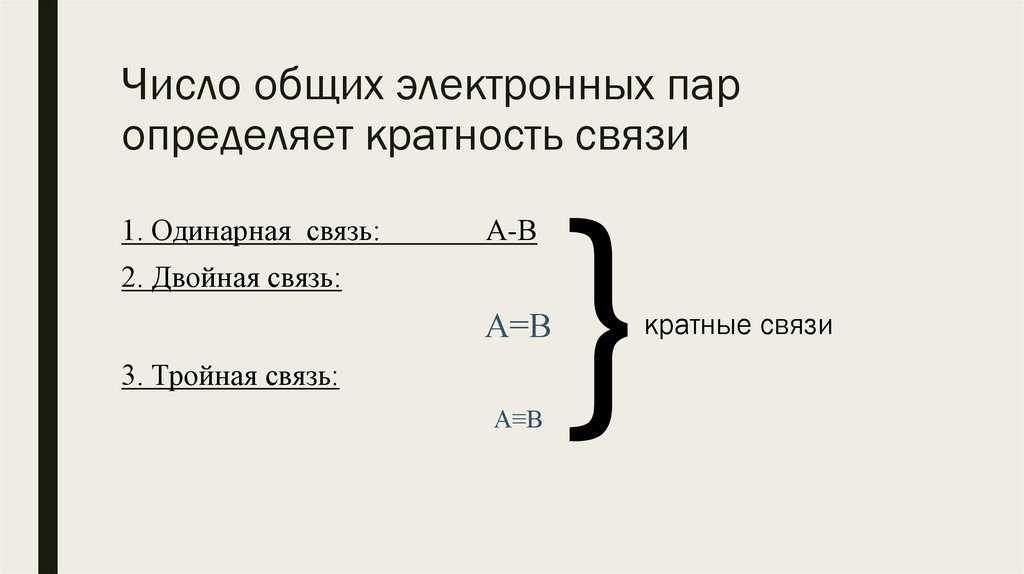
Число общих электронных паропределяет кратность связи
1. Одинарная связь:
А-В
2. Двойная связь:
А=В
3. Тройная связь:
А≡В
кратные связи
13.
Подводя итог, можно сделать вывод:■ Химическая связь между атомами одного
элемента в простом веществе,
осуществляемая общей электронной парой
(парами), расположенной на равном
удалении от ядер связывающихся атомов,
называется ковалентной неполярной.
14.
Ковалентная полярная связь■ Образуется между разными атомами элементов –
неметаллов
■ Электороотрицательность (ЭО) – это способность
атомов химического элемента смещать к себе общие
электронные пары, участвующие в образовании
химической связи.
Ряд химических элементов, расположенных в
соответствии с уменьшением их
электроотрицательности:
■ F→O→ N → CI → Br → I → S → C → Si →P → H
15.
Рассмотрим схему образованиямолекул HCl, H2O,NH3
16.
Подведем итог:■ Ковалентная химическая связь между атомами
разных элементов – неметаллов, при которой
общая электронная пара (пары)смещена в
сторону наиболее электроотрицательного
элемента, в результате чего в молекуле
появляются частичные заряды, называется
ковалентной полярной.
17.
Ответьте на вопросы:■ 1. Какую химическую связь называют ковалентной?
..............................................................................................
■ 2. Из перечисленных формул выпишите сначала соединения с ковалентной
неполярной связью, а затем – с ковалентной полярной связью (не ионной): Н2, Н2О,
Н2SO4, NaCl, O2, CO2, NH3, Cl2, MgO.
..............................................................................................
■ 3. Напишите молекулярные формулы перечисленных веществ:
а) озон (молекула состоит из трех атомов кислорода);
б) угольная кислота (молекула состоит из двух атомов водорода, одного атома углерода и
трех атомов кислорода);
в) сернистый газ (молекула состоит из атомов серы и кислорода, причем отношение масс
атомов этих элементов в молекуле 1 : 1).
18.
Рефлексия.Какую задачу ставили?
Чем занимались на уроке?
Какие сложности возникли?
Как оцениваете свою работу? Работу класса в целом?
19.
Домашнее задание:■§ 44,45, упр.3


















 Химия
Химия








