Похожие презентации:
Химическая связь. Ковалентная связь
1.
10 классХимическая связь.
Ковалентная связь.
Бозаджи Н.М.
учитель химии
высшей категории
2.
В результате изучения темы, выбудете способны:
1.Определять понятие химическая связь
(характеристику связи).
2. Рассматривать классификацию ХС.
3. Рассматривать общий механизм образования
ковалентной связи.
4. Рассматривать механизм образования
ковалентной неполярной связи.
5. Рассматривать механизм образования
ковалентной полярной связи.
6. Графически представлять методы образования ков.
связи (с помощью точек, условно обозначающих валентные
электроны)
5.Осуществлять рефлексию своей деятельности
3.
«Вопрос о природе химическойсвязи
– сердце всей химии»
Брайк Кроунфорд-мл.
4.
От берега до берегаМожно сделать мост.
Соединить два атома
В молекулу – вопрос…
5.
Почему атомы соединяются друг с другом?Всегда ли молекулы образованы по одному механизму?
Зависит ли прочность молекул от того из каких атомов они
«сделаны»?
Влияет ли природа атомов на свойства веществ?
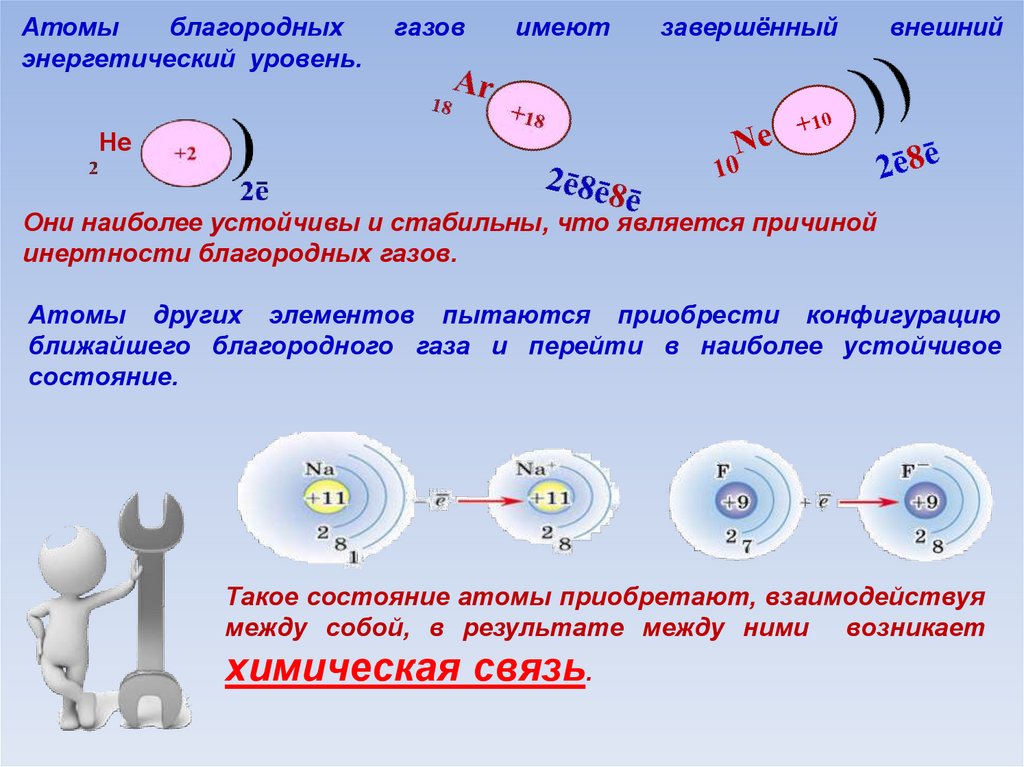
6.
Атомыблагородных
энергетический уровень.
газов
имеют
завершённый
внешний
Не
Они наиболее устойчивы и стабильны, что является причиной
инертности благородных газов.
Атомы других элементов пытаются приобрести конфигурацию
ближайшего благородного газа и перейти в наиболее устойчивое
состояние.
Такое состояние атомы приобретают, взаимодействуя
между собой, в результате между ними возникает
химическая связь.
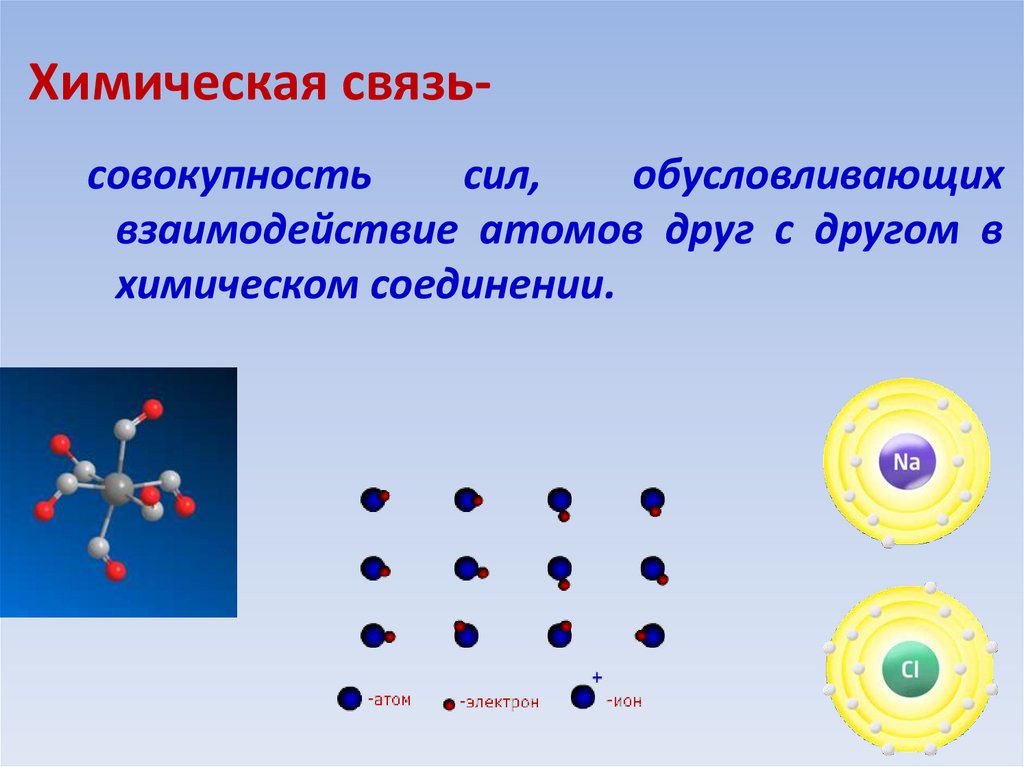
7. Химическая связь-
Химическая связьсовокупностьсил,
обусловливающих
взаимодействие атомов друг с другом в
химическом соединении.
8.
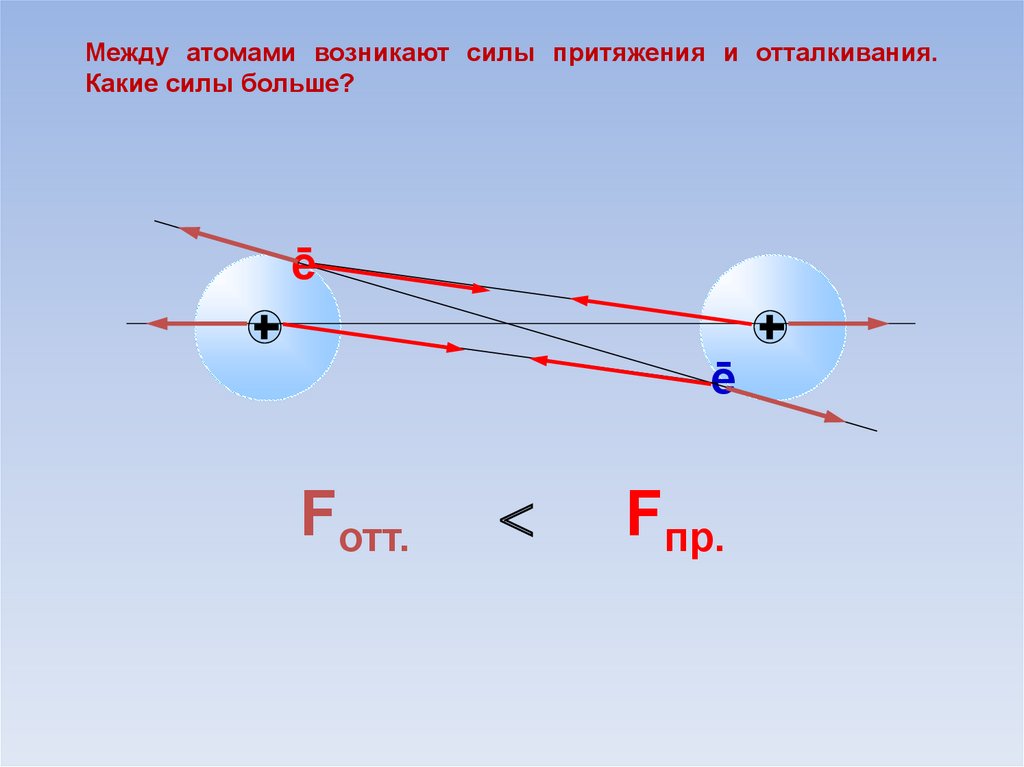
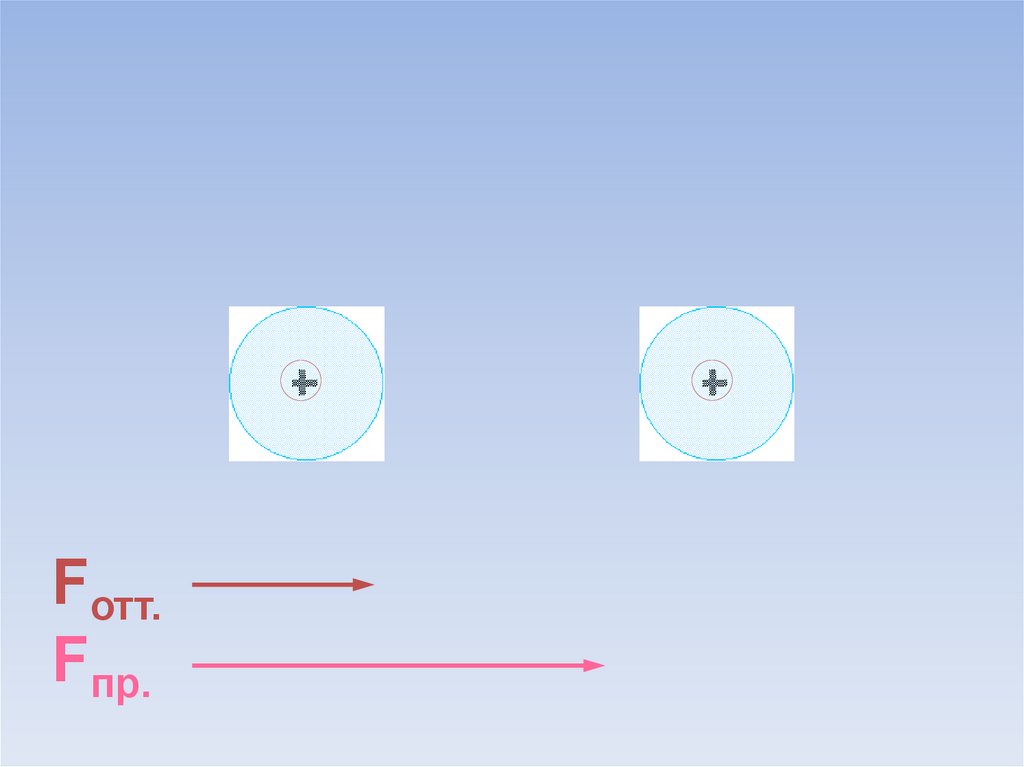
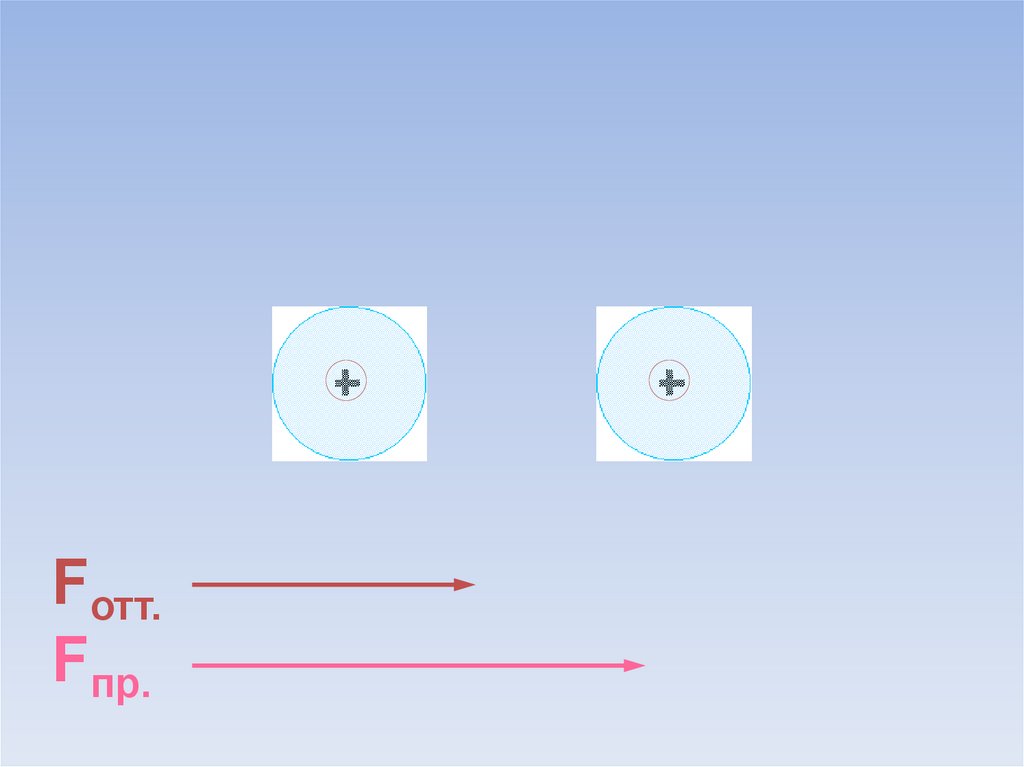
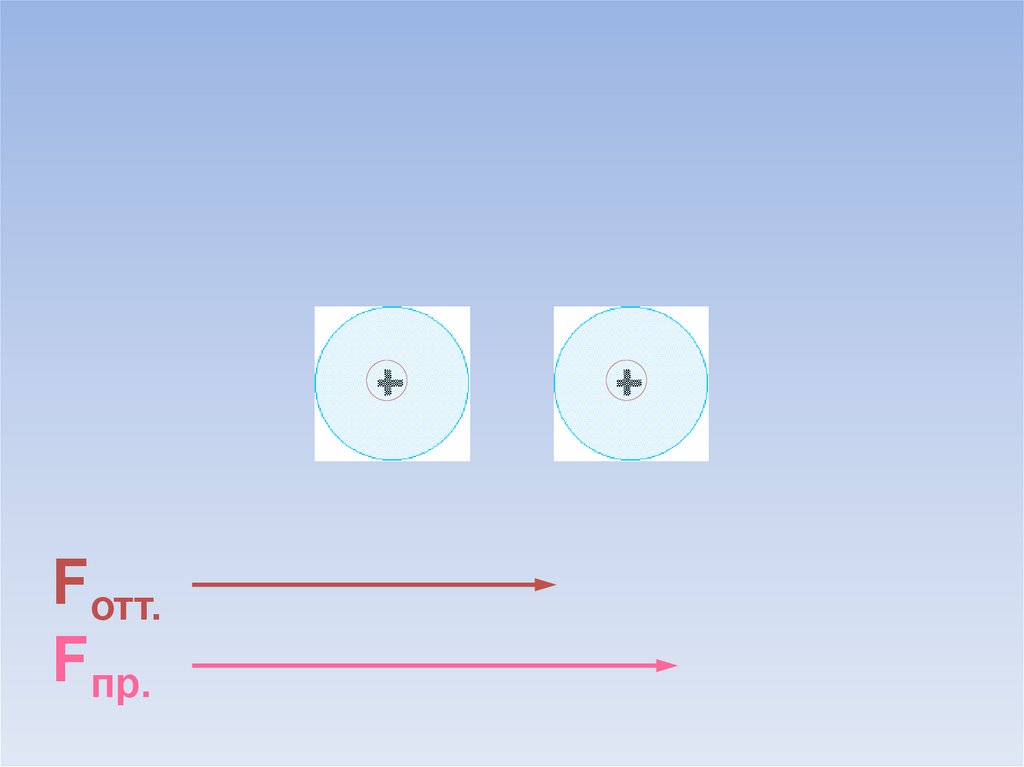
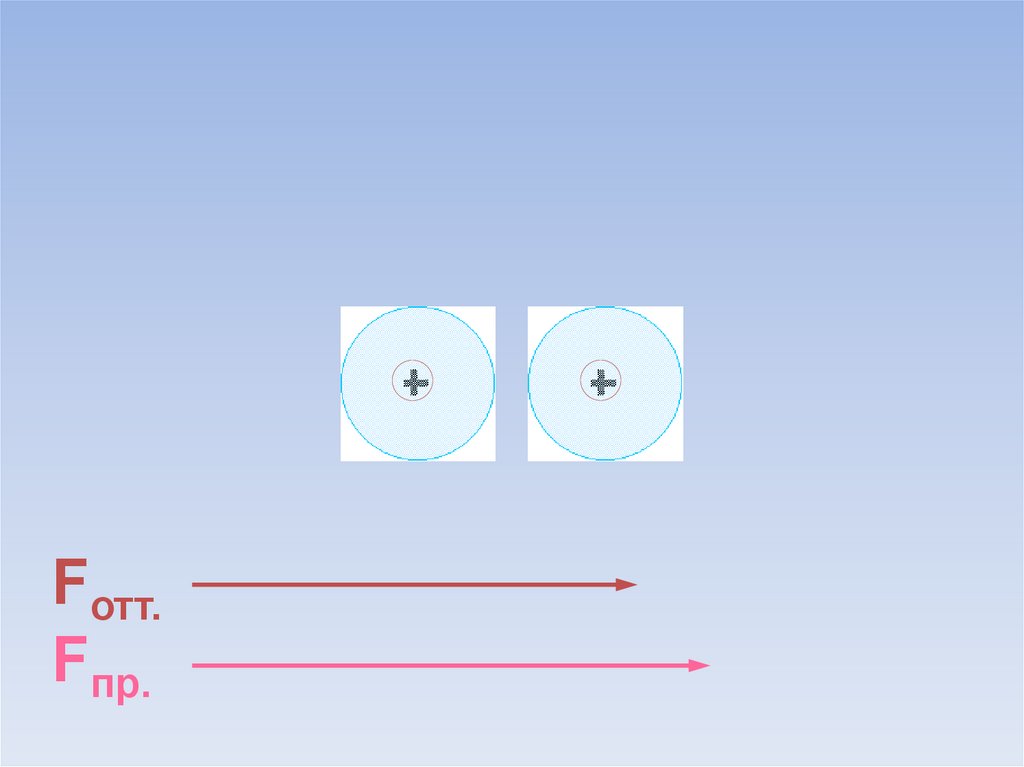
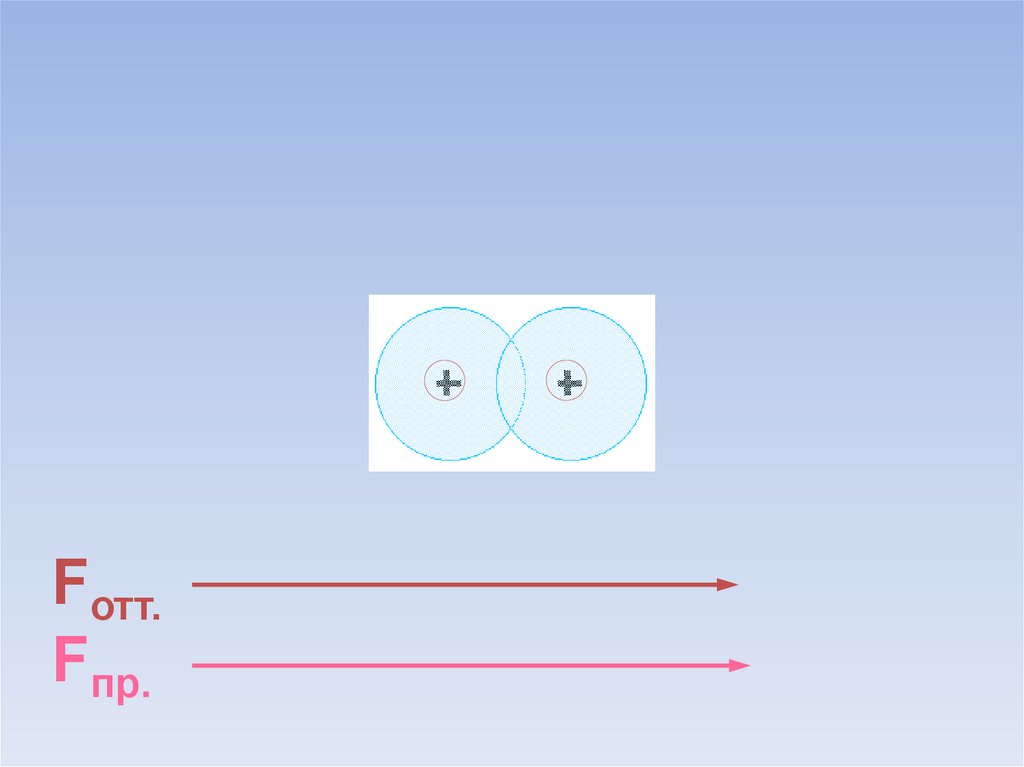
Между атомами возникают силы притяжения и отталкивания.Какие силы больше?
ē
ē
Fотт.
Fпр.
9.
Fотт.Fпр.
10.
Fотт.Fпр.
11.
Fотт.Fпр.
12.
Fотт.Fпр.
13.
Fотт.Fпр.
14.
Fотт.Fпр.
15.
Fотт.Fпр.
16.
Fотт.Fпр.
17.
Fотт.Fпр.
18.
Fотт.Fпр.
19.
Fотт.Fпр.
20.
Fотт.Fпр.
21.
Fотт.Fпр.
22.
Fотт.Fпр.
23.
Fотт.Fпр.
24.
Fотт.Fпр.
25.
Fотт.Fпр.
26.
Fотт.Fпр.
27.
Fотт.Fпр.
28.
Fотт.Fпр.
29.
Fотт.Fпр.
30.
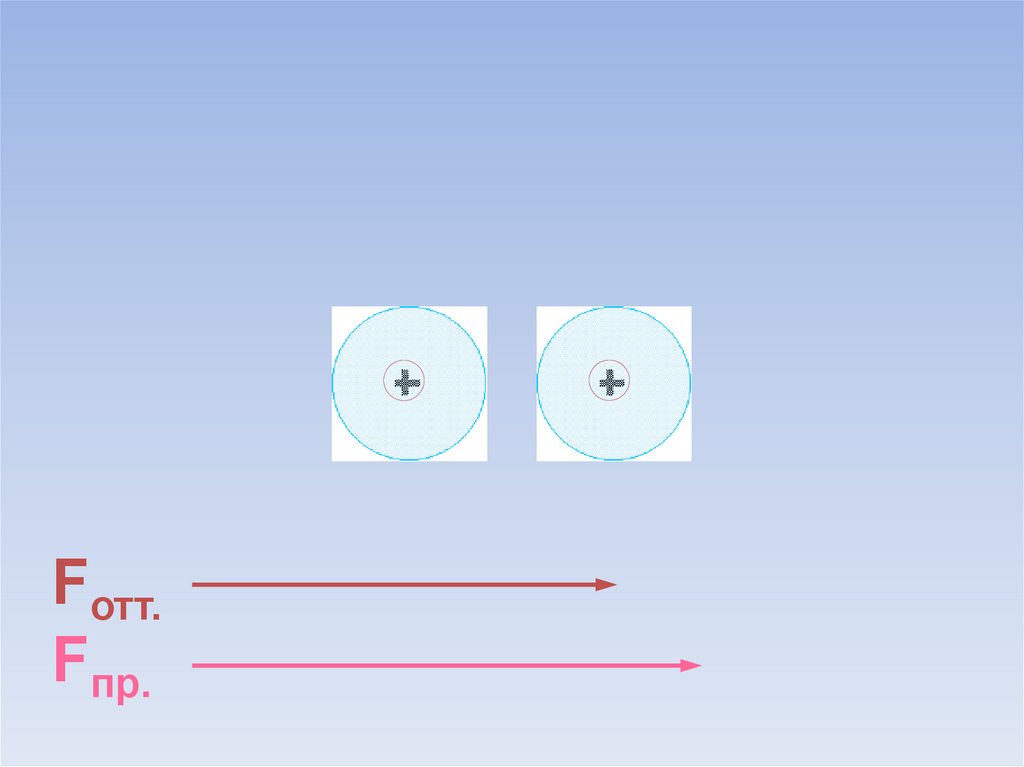
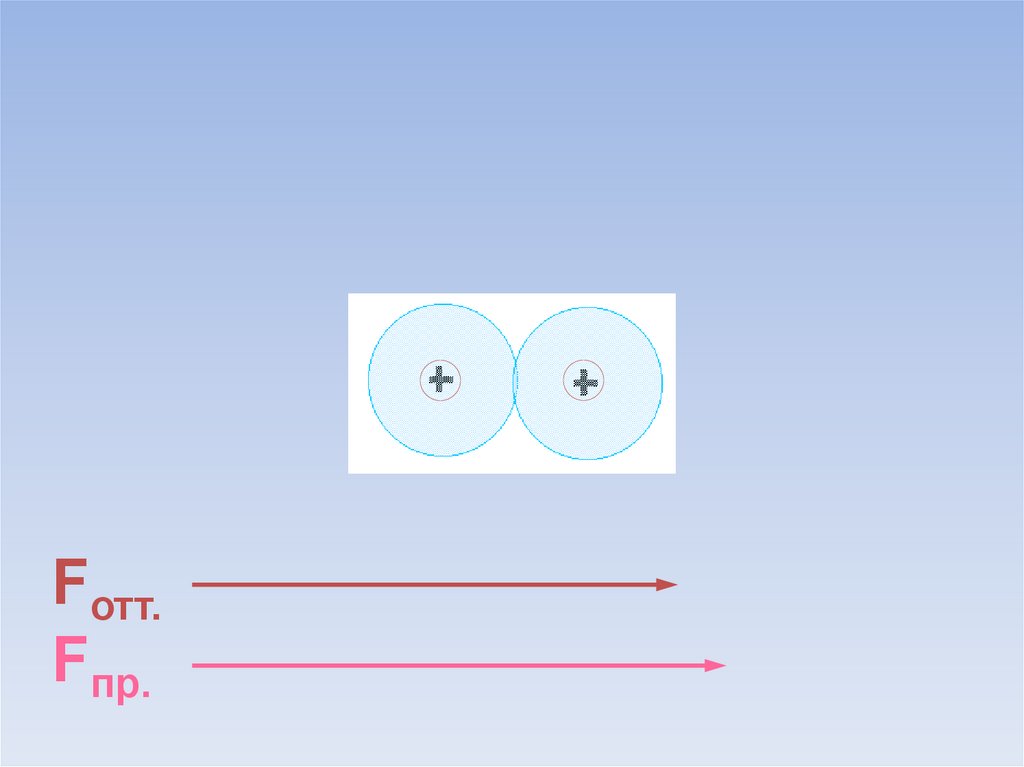
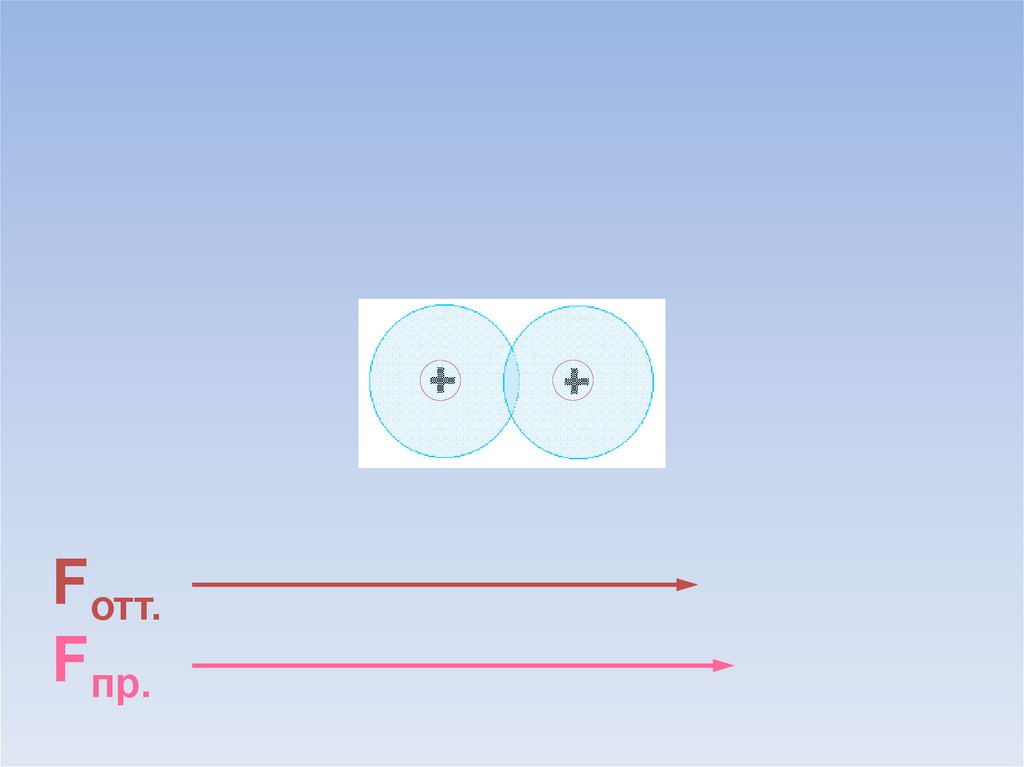
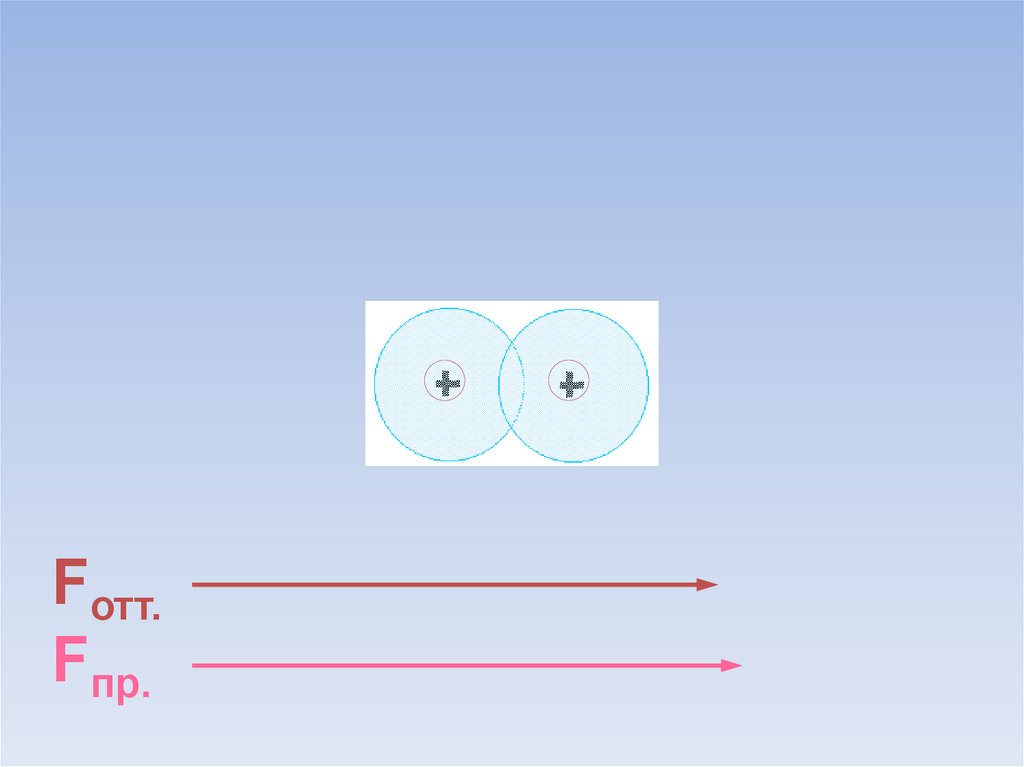
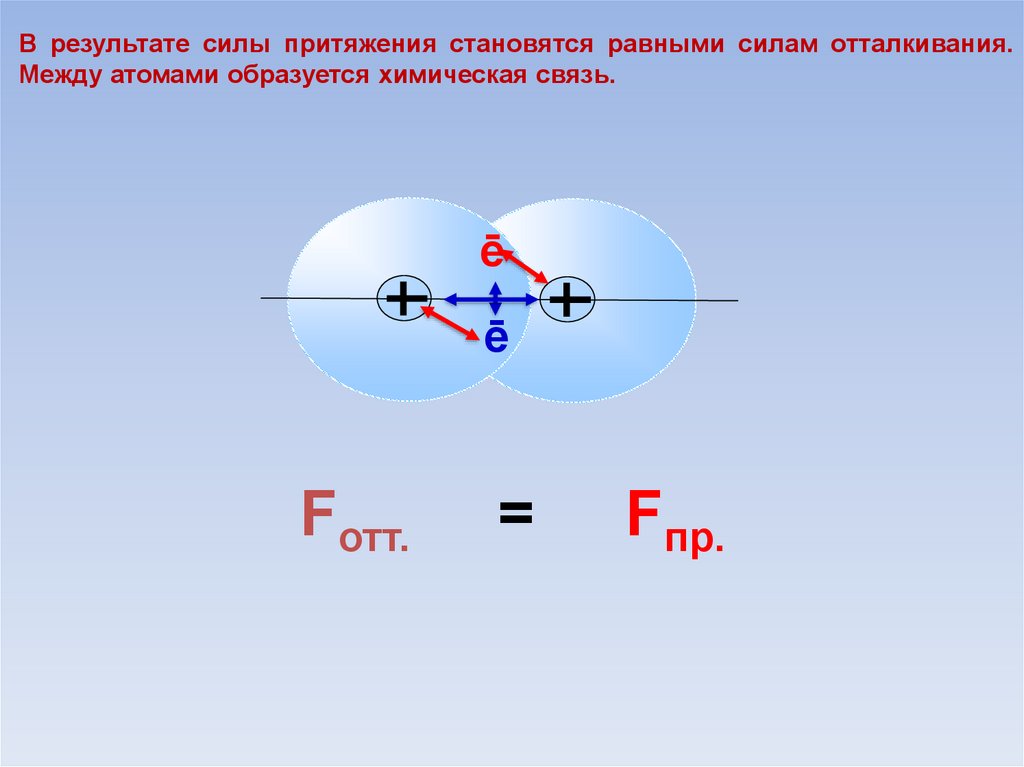
В результате силы притяжения становятся равными силам отталкивания.Между атомами образуется химическая связь.
ē
ē
Fотт.
=
Fпр.
31.
В области нахождения двух электроновнаибольшая электронная плотность.
32. Химическая связь
-это связь между атомамиХимическая связь
- это силы взаимодействия,
которые соединяют отдельные
атомы в молекулы, ионы,
кристаллы.
33.
Понятия, необходимые дляопределения типа химической
связи:
Электроотрицательность - свойство атомов
данного элемента оттягивать на себя электроны
атомов других элементов.
Валентность - свойство атомов одного элемента
соединяться с определенным количеством других
атомов.
Валентные электроны - электроны внешнего
уровня (№ группы), при чем те, которые могут
быть неспаренными.
Ме и НеМе - деление элементов на основе ПС
34.
Расположение металлов и неметаллов в ПС35. ВЗАИМОДЕЙСТВИЯ АТОМОВ
Для атомов присуще стремление приобрестиболее устойчивую и энергетически выгодную
электронную конфигурацию, характерную
для благородных газов (завершённый внешний
энергетический уровень – «электронный
октет»). В результате взаимодействия между
собой, атомы более электроотрицательных
элементов захватывают электроны на
внешний уровень, а атомы менее
электроотрицательных элементов – отдают
свои внешние электроны.
36.
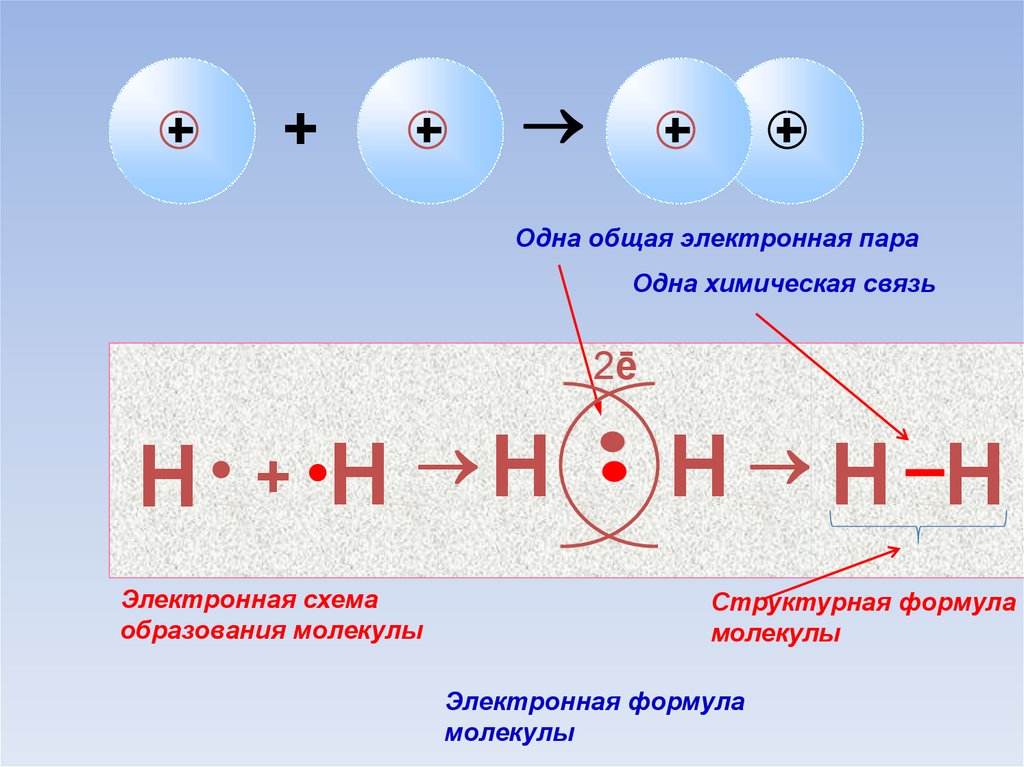
+Одна общая электронная пара
Одна химическая связь
2ē
Н
+
Н
Н
Электронная схема
образования молекулы
Н Н Н
Структурная формула
молекулы
Электронная формула
молекулы
37.
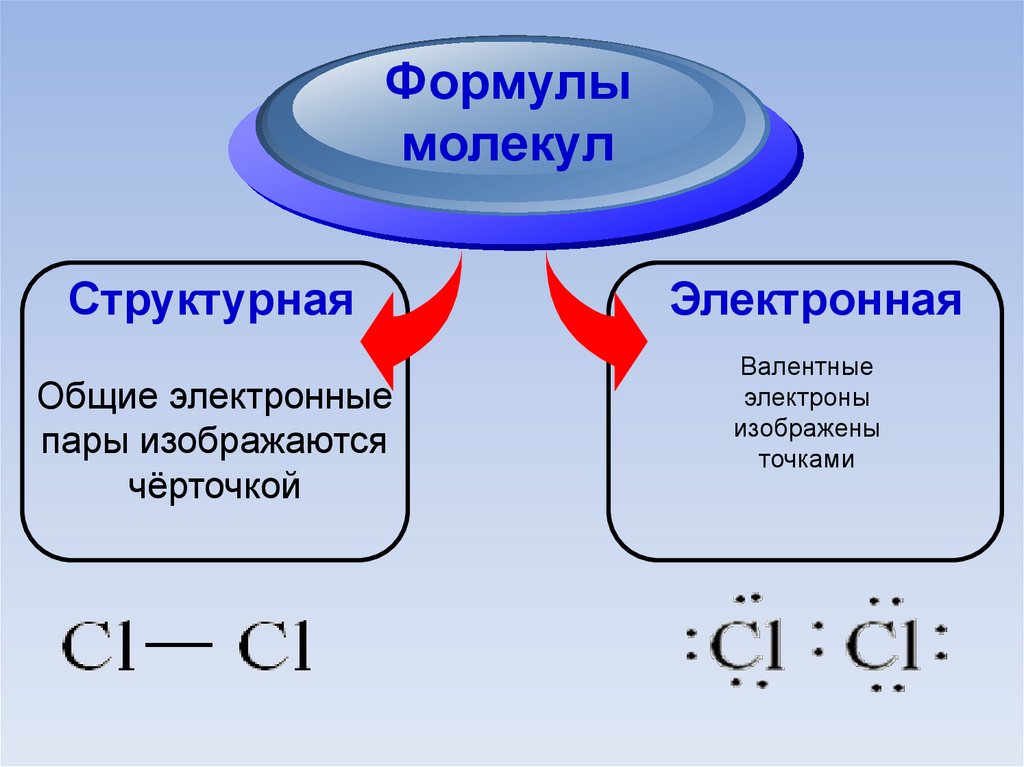
Формулымолекул
Структурная
Общие электронные
пары изображаются
чёрточкой
Электронная
Валентные
электроны
изображены
точками
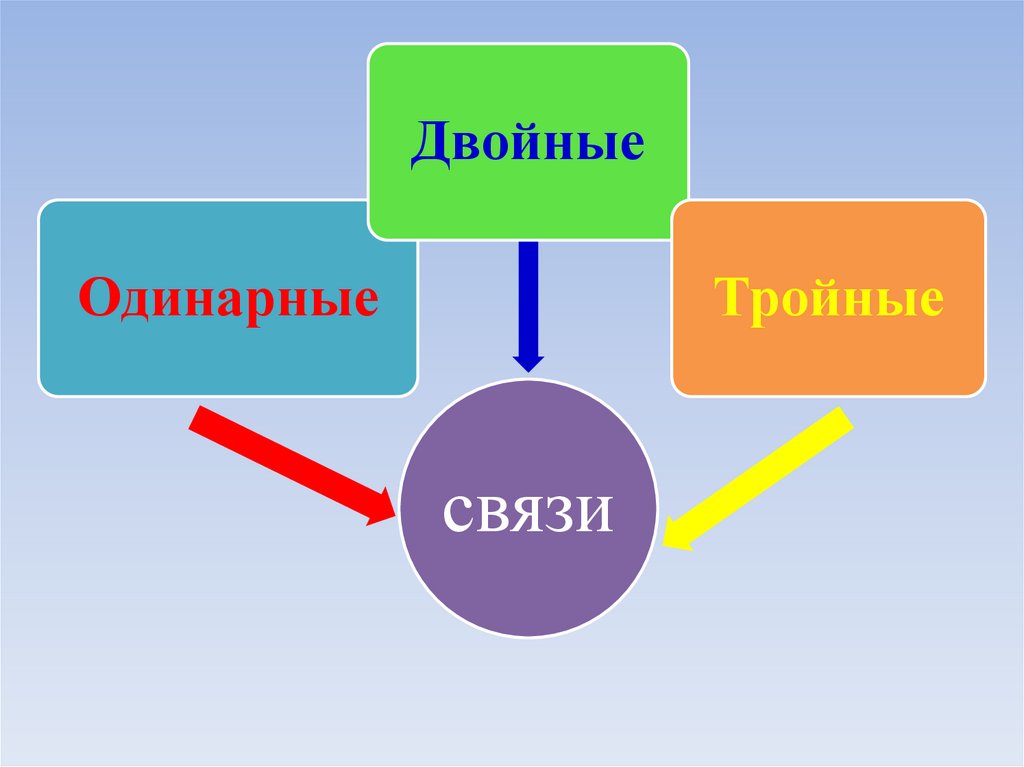
38.
ДвойныеОдинарные
Тройные
связи
39. Тест
Задание №1Тест
1. Что такое электроотрицательность?
2. Пользуясь ПСХЭ распределите
перечисленные элементы в порядке
возрастания значений
электроотрицательности:
фосфор, магний, бор, кислород, кремний,
калий, углерод, водород, литий , фтор,
сера, алюминий ,кальций.
Ответ: K Li Ca Mg Al B H Si P C S O F
40. Тест
Задание №1Тест
3. В ряду элементов
F→ Cl→ Br→ I с увеличением порядкового
номера химического элемента ЭО
1. Увеличивается
2. Уменьшается
3. Не изменяется
4. Изменяется периодически
Ответ: 2
41. Тест
Задание №1Тест
4.В приведенных ниже формулах
подчеркните атомы наиболее ЭО элементов
KCl ; Na2O; N2 ; HI ; H2S ; AlBr3
Ответ:Cl,O,I,S,Br
42.
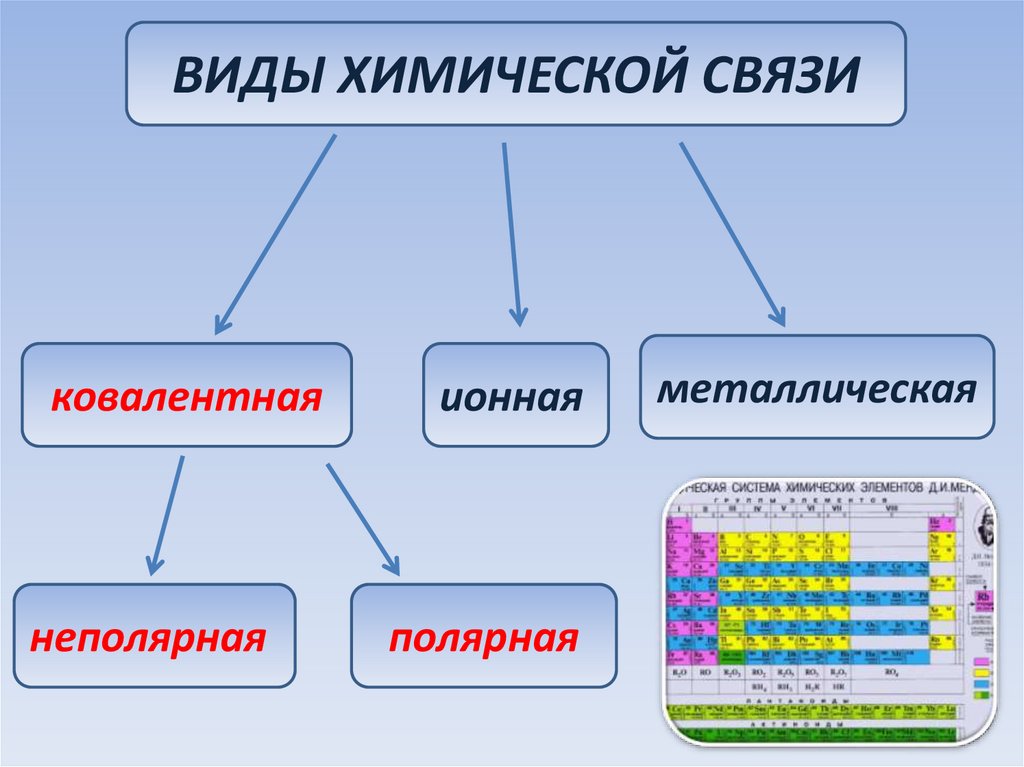
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИковалентная
неполярная
ионная
полярная
металлическая
43.
Как определить вид связи в веществе?Определите природу химических
элементов
если
металл и неметалл
только металл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь
ковалентная
неполярная
связь ионная
связь
ковалентная
если
ЭО элементов
различна
связь
ковалентная
полярная
44.
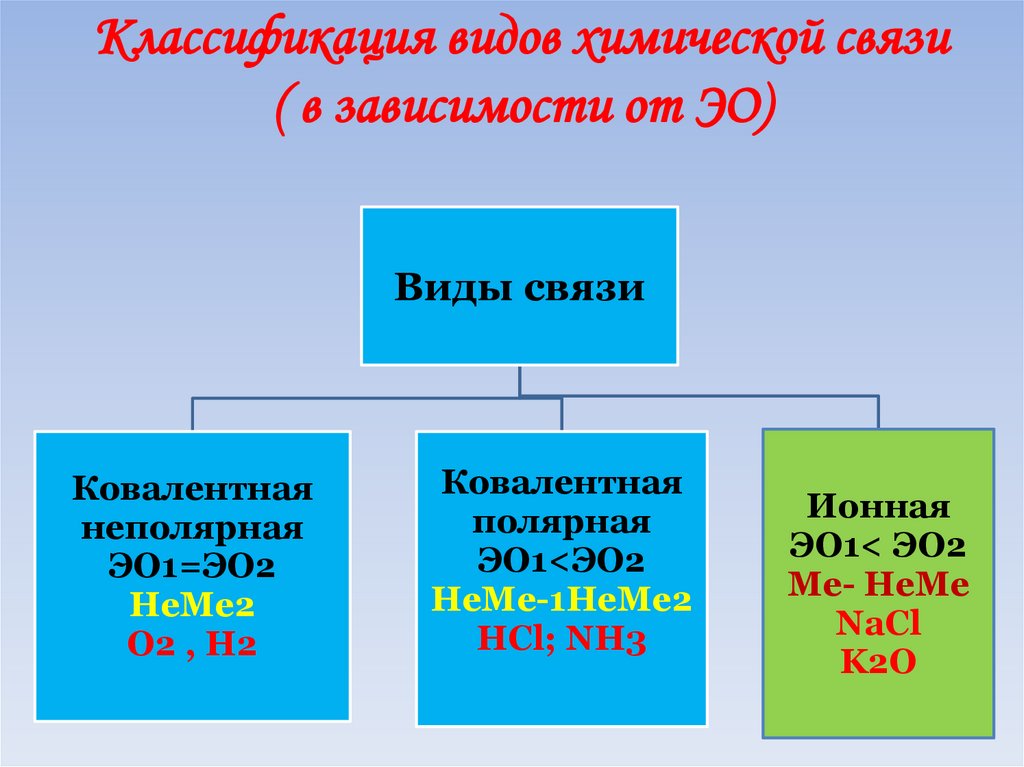
Классификация видов химической связи( в зависимости от ЭО)
Виды связи
Ковалентная
неполярная
ЭО1=ЭО2
НеМе2
О2 , Н2
Ковалентная
полярная
ЭО1<ЭО2
НеМе-1НеМе2
HCl; NH3
Ионная
ЭО1< ЭО2
Ме- НеМе
NaCl
K2O
45. Ковалентная связь:
- это связь между атомами, врезультате образования общих
электронных пар.
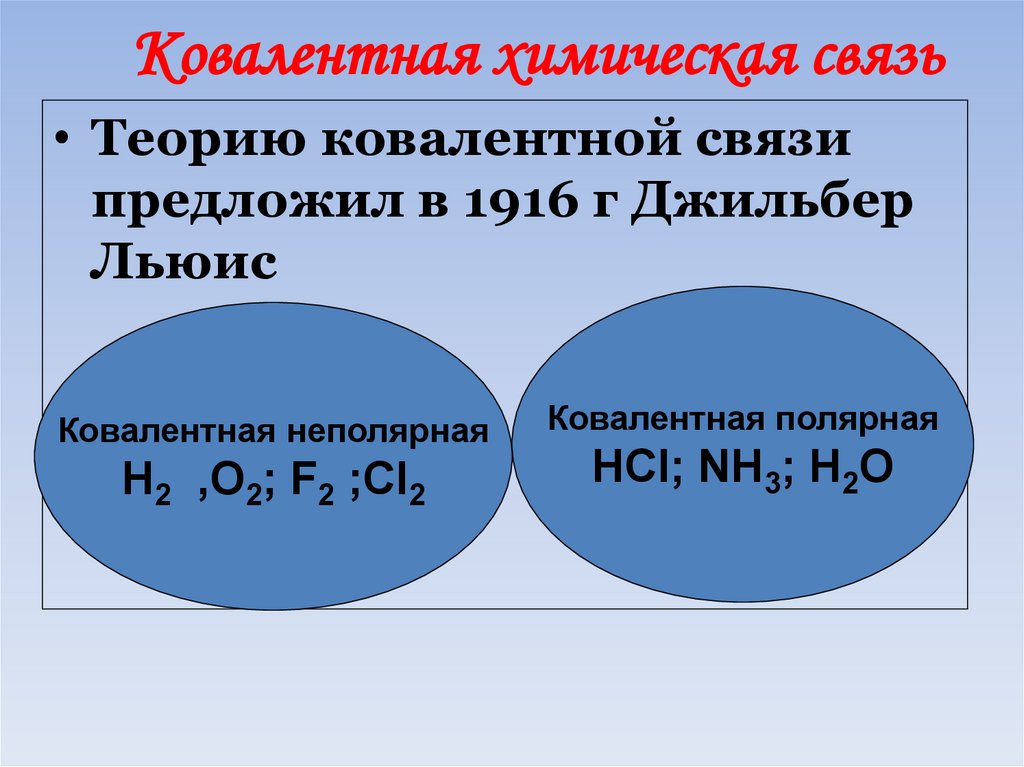
46. Ковалентная химическая связь
• Теорию ковалентной связипредложил в 1916 г Джильбер
Льюис
Ковалентная неполярная
Ковалентная полярная
Н2 ,О2; F2 ;Cl2
HCl; NH3; H2O
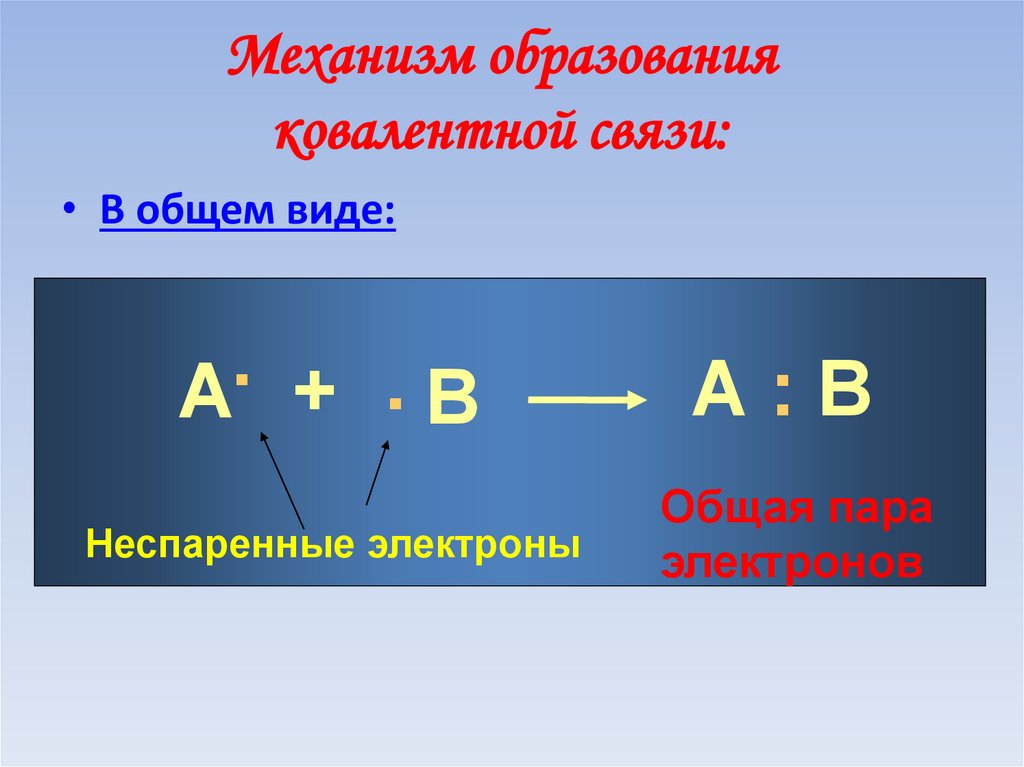
47. Механизм образования ковалентной связи:
• В общем виде:.
А + .В
Неспаренные электроны
А:В
Общая пара
электронов
48. Виды ковалентной связи
Неполярная• Образуется между
атомами с одинаковой
ЭО
• Например: H2 Cl2 O2 N2
• Общая электронная
пара, образующая
связь в равной степени
принадлежит обоим
атомам
Полярная
Образуется между
атомами, которые
незначительно
отличаются по ЭО
Например: H2О НCl NН3
Общая электронная
пара, образующая
связь, смещается к
атому более
электроотрицательного
элемента
49.
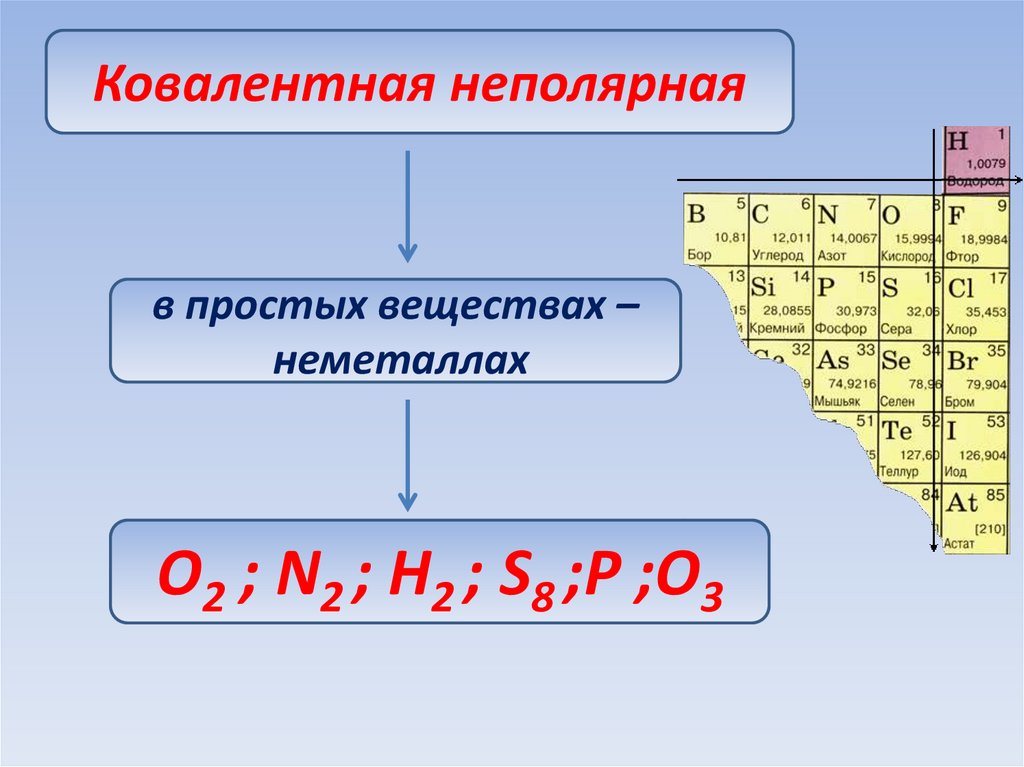
Ковалентная неполярнаяв простых веществах –
неметаллах
O2 ; N2 ; H2 ; S8 ;P ;O3
50. Образование ковалентной неполярной связи в молекуле H2
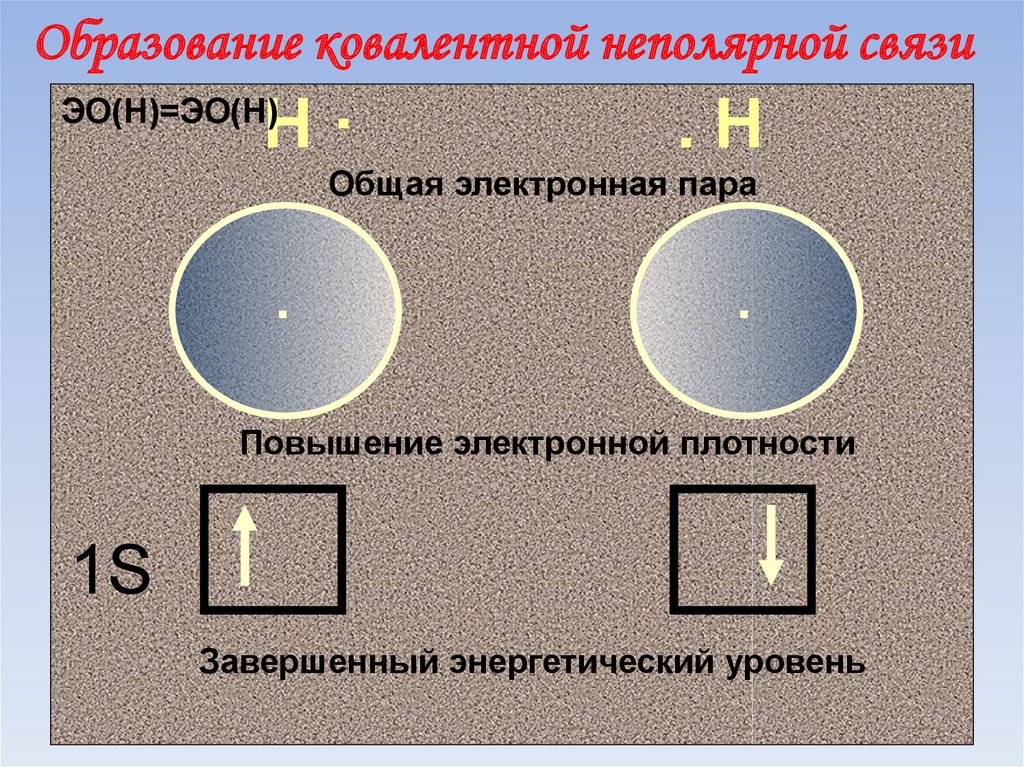
51. Образование ковалентной неполярной связи
Н·ЭО(Н)=ЭО(Н)
.Н
Общая электронная пара
.
.
Повышение электронной плотности
1S
Завершенный энергетический уровень
52.
КНС образуют атомы одного и того же химическогоэлемента.
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование
другому атому наружные неспаренные электроны.
Образуются общие электронные пары. Электронная
пара принадлежит в равной мере обоим атомам.
Примеры образования КНС:
H.+.H
H:H
H-H H2
53.
Задание №2Показать механизм
образования химической
связи в молекуле О2
..
..
:O.+.O:
O=O
O2
..
..
:O :: O :
54. Образование ковалентной неполярной связи в молекуле O2
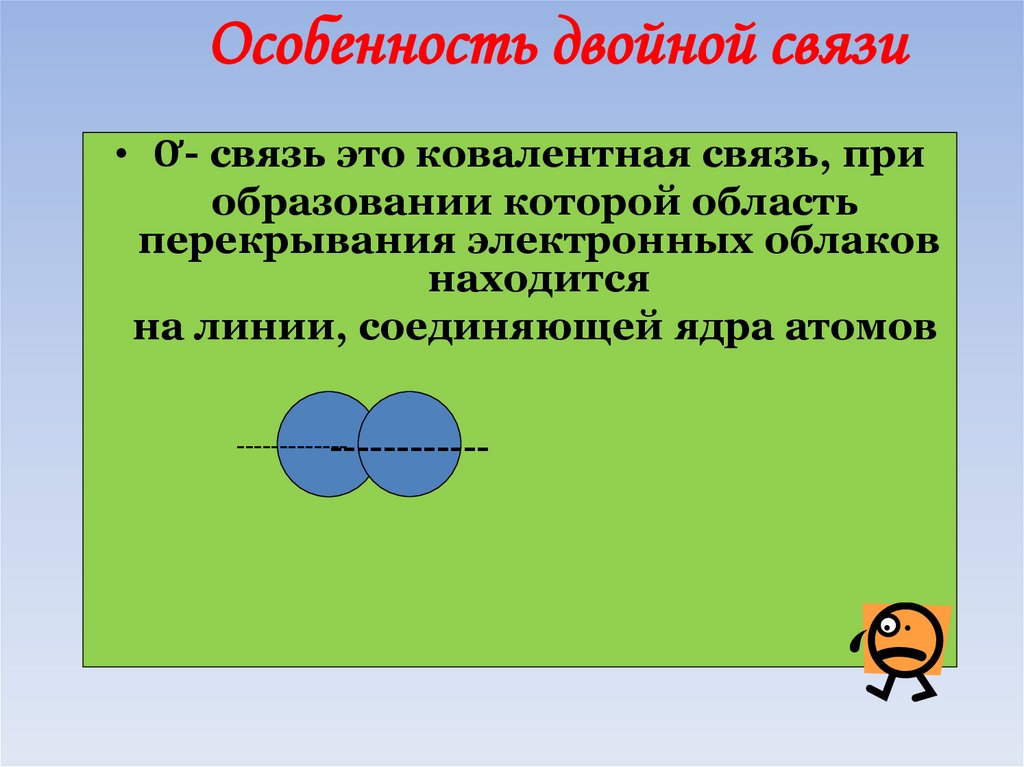
55.
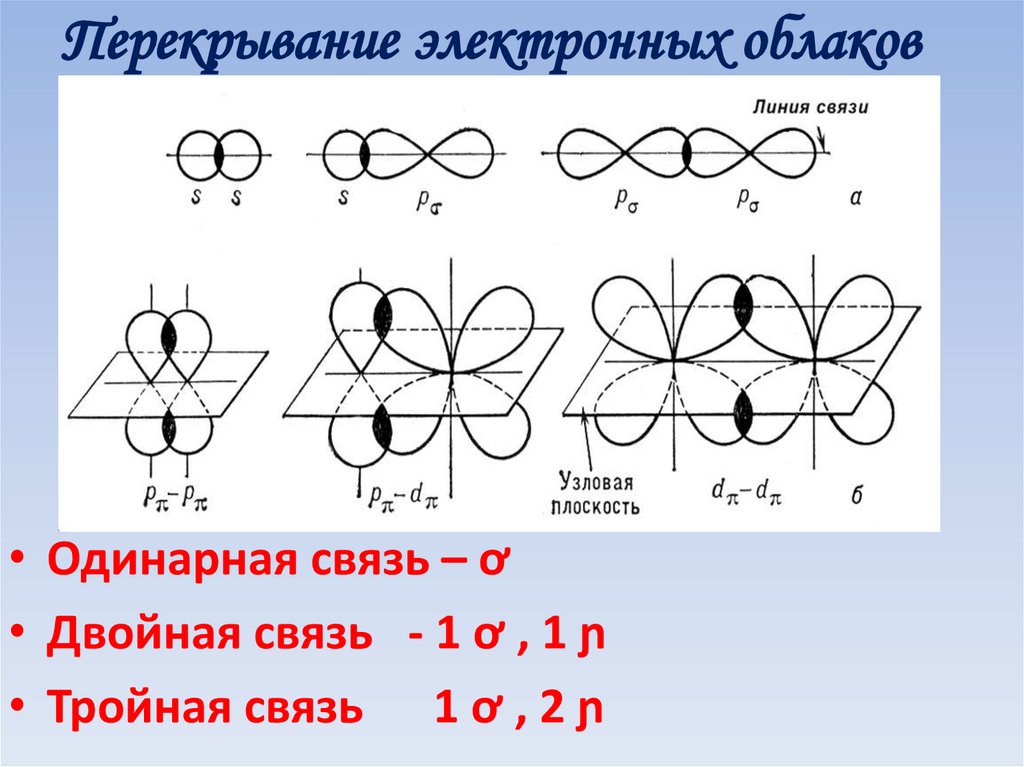
Особенность двойной связи• Ơ- связь это ковалентная связь, при
образовании которой область
перекрывания электронных облаков
находится
на линии, соединяющей ядра атомов
------------------------
56.
Особенность двойной связи• ɲ - это связь , при
образовании которой
область перекрывания
электронных облаков
находится по обе стороны по
линии соединяющий ядра
атомов
57.
Перекрывание электронных облаков• Одинарная связь – ơ
• Двойная связь - 1 ơ , 1 ɲ
• Тройная связь 1 ơ , 2 ɲ
58.
Задание №3Показать механизм
образования химической
связи в молекуле N2
59.
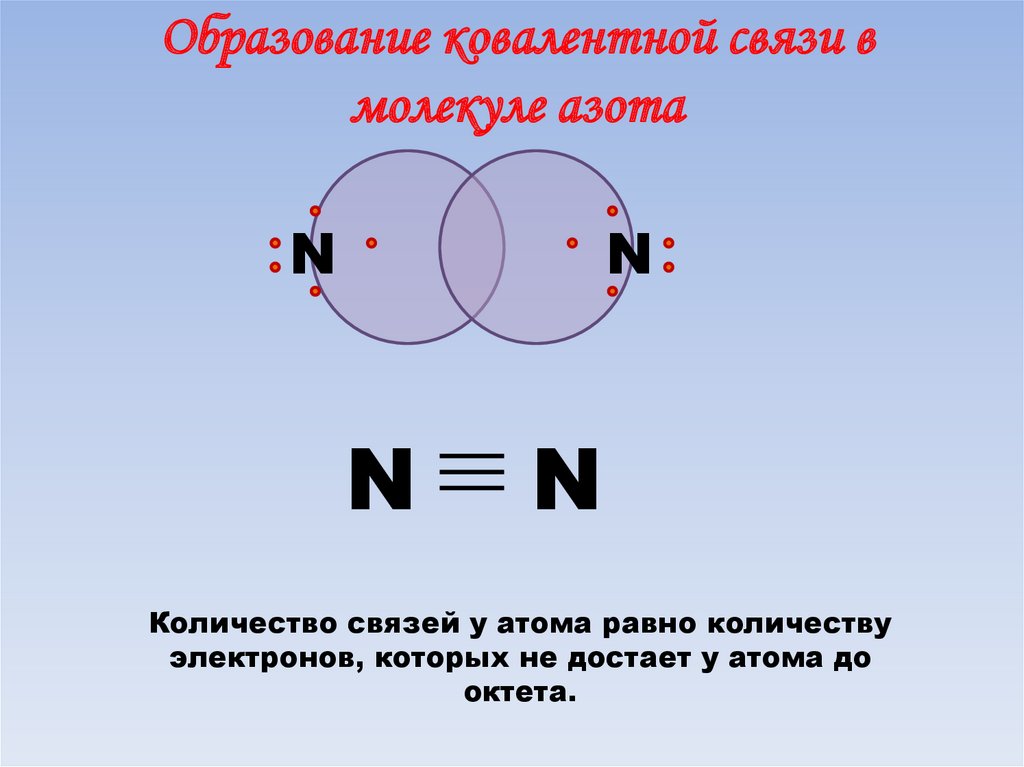
Образование ковалентной связи вмолекуле азота
N
N
N
N
Количество связей у атома равно количеству
электронов, которых не достает у атома до
октета.
60. Образование ковалентной неполярной связи в молекуле N2
61.
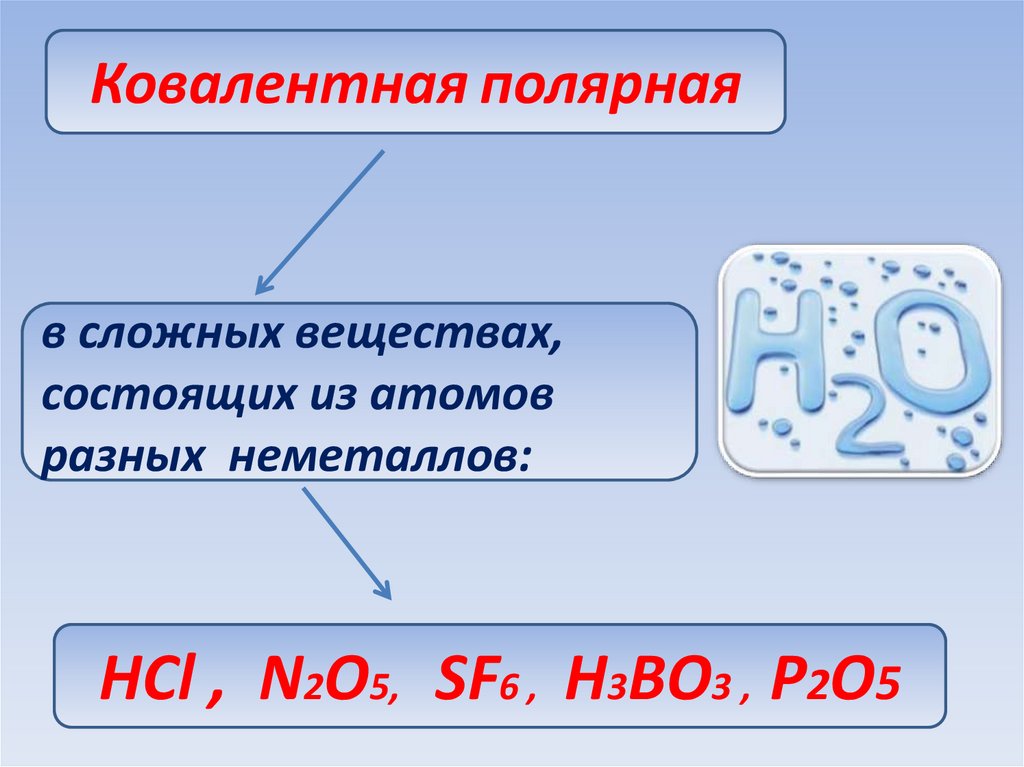
Ковалентная полярнаяв сложных веществах,
состоящих из атомов
разных неметаллов:
НСl , N2O5, SF6 , H3BO3 , Р2О5
62.
КПС образуют атомы разных неметаллов (с разнойэлектороотрицательностью).
Самый электроотрицательный элемент – F.
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование
другому атому свои наружные неспаренные электроны.
Образуются общие электронные пары. Общая
электронная пара смещена к более
электроотрицательному элементу.
Примеры образования связи.
..
H• + .Cl
..
..
H : Cl :
..
+
H
-
Cl
+
-
Диполь
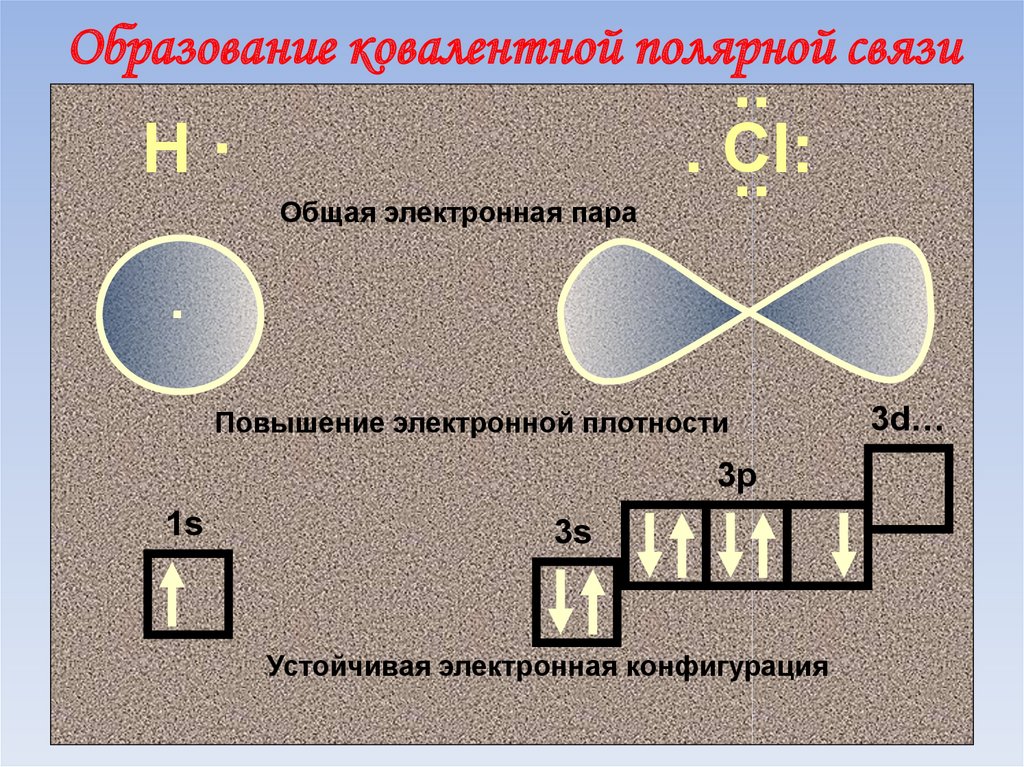
63. Образование ковалентной полярной связи
Н·Общая электронная пара
..
. Сl:
..
.
Повышение электронной плотности
3p
1s
3s
Устойчивая электронная конфигурация
3d…
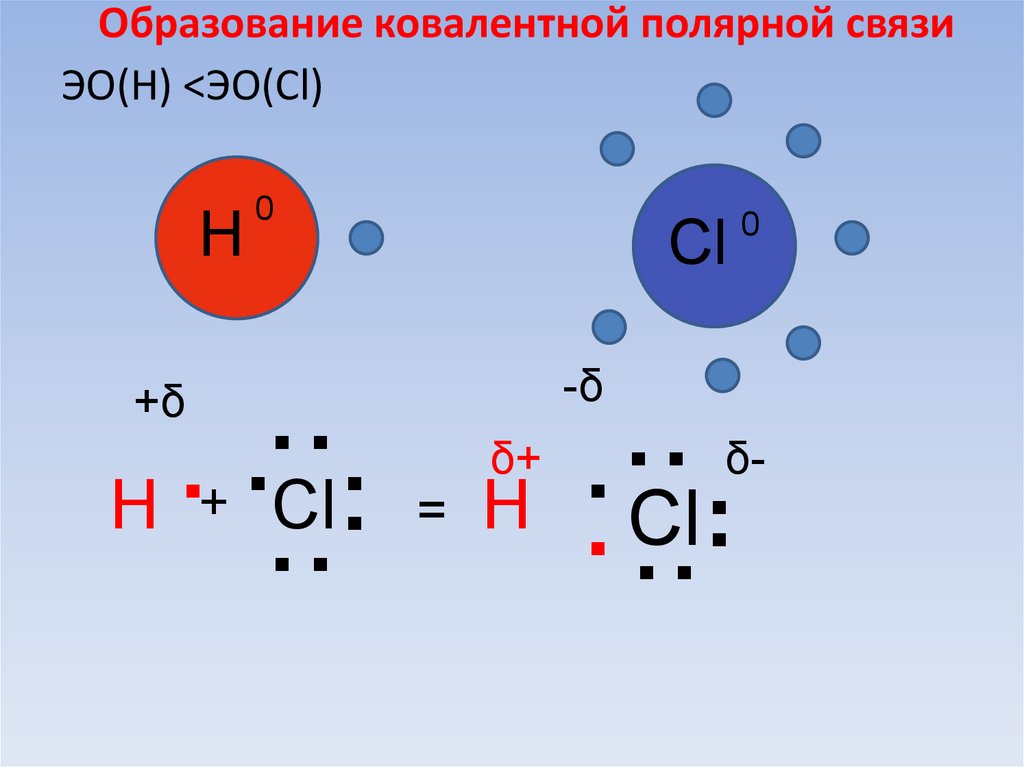
64. Образование ковалентной полярной связи
ЭО(Н) <ЭО(Cl)H
0
..
.
.
.
Н
Cl.
..
Сl
-δ
+δ
+
..
.. Cl..
..
0
δ+
=
Н
δ-
65.
H+δ
Общая
электронная
пара
смещена к
хлору
Cl
..
+δ .
-δ
.
(
.
)
.
H Cl
..
+δ
-δ
→
H Cl
-δ
66.
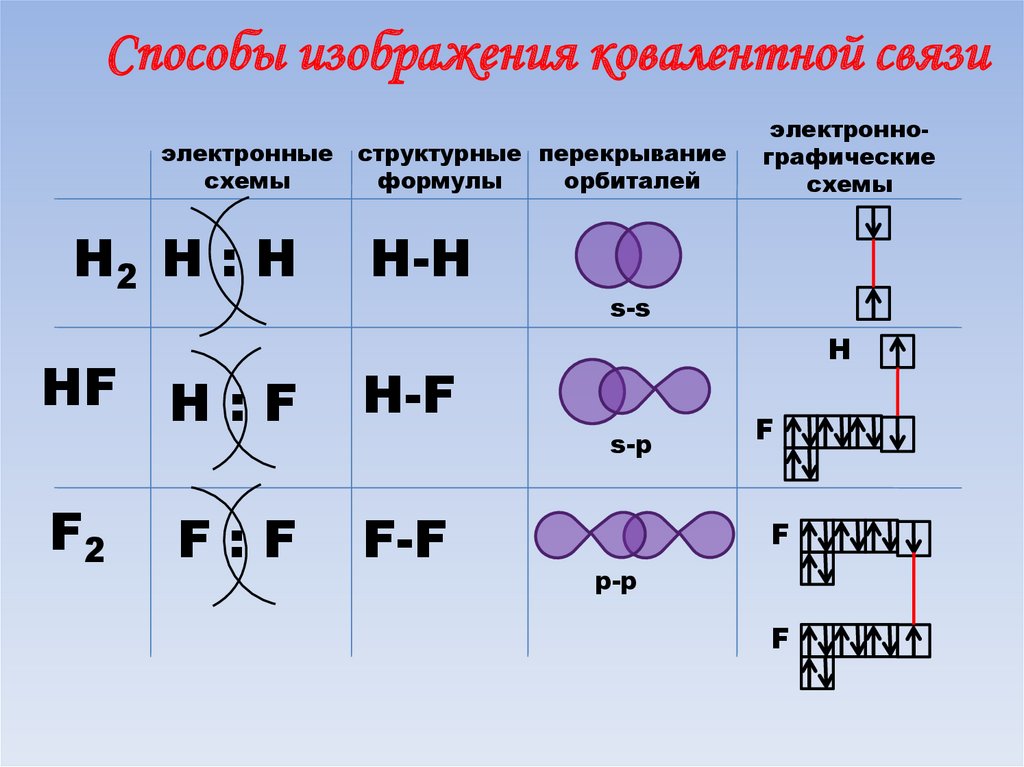
Способы изображения ковалентной связиэлектронные
схемы
Н2 Н : Н
структурные перекрывание
формулы
орбиталей
Н-H
s-s
НF Н : F
Н-F
F2
F-F
F:F
электроннографические
схемы
H
s-p
F
F
p-p
F
67. Энергия связи
• Энергия, которую надо затратить наразрыв связи ( мера ее прочности)
• Измеряется в кдж/моль
• Зависит от
1.Природы взаимодействующих атомов
2.Их размеров
3. ЭО
4. Прочность ơсвязи больше ɲсвязи.
68.
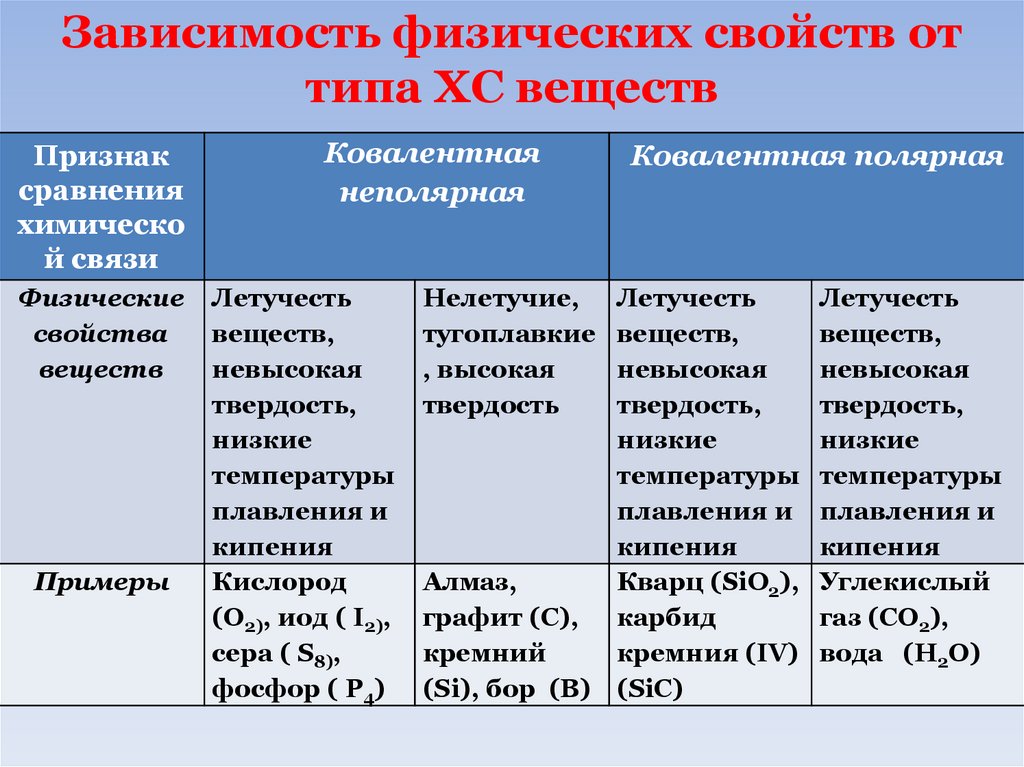
Зависимость физических свойств оттипа ХС веществ
Признак
сравнения
химическо
й связи
Физические
свойства
веществ
Примеры
Ковалентная
неполярная
Летучесть
веществ,
невысокая
твердость,
низкие
температуры
плавления и
кипения
Кислород
(O2), иод ( I2),
сера ( S8),
фосфор ( P4)
Нелетучие,
тугоплавкие
, высокая
твердость
Ковалентная полярная
Летучесть
веществ,
невысокая
твердость,
низкие
температуры
плавления и
кипения
Алмаз,
Кварц (SiO2),
графит (C), карбид
кремний
кремния (IV)
(Si), бор (B) (SiC)
Летучесть
веществ,
невысокая
твердость,
низкие
температуры
плавления и
кипения
Углекислый
газ (CO2),
вода (H2O)
69.
H2OCaO
70.
Задание №1. Связь, идущая собразованием общих
электронных пар:
1)ионная;
2) ковалентная;
3) металлическая?
71.
Задание №2. Ковалентнаяполярная связь возникает
между:
1) одинаковыми атомами
неметаллов;
2)одинаковыми атомами
металлов;
3) разными атомами неметаллов;
4) разными атомами металлов.
72.
Задание №3.Электроотрицательность –
это способность атомов:
1) образовывать общие
электронные пары;
2) принимать электроны;
3) отдавать электроны;
4) притягивать к себе общие
электронные пары.
73.
Задание № 4. При образованииковалентной полярной связи
общая электронная пара
смещается:
1) к более ЭО элементу;
2)к менее ЭО элементу;
3) располагается посредине;
4) не образуется.
74.
Задание № 5. Наиболее ЭОэлементом является:
1) хлор;
2) азот;
3) фтор;
4) фосфор
75.
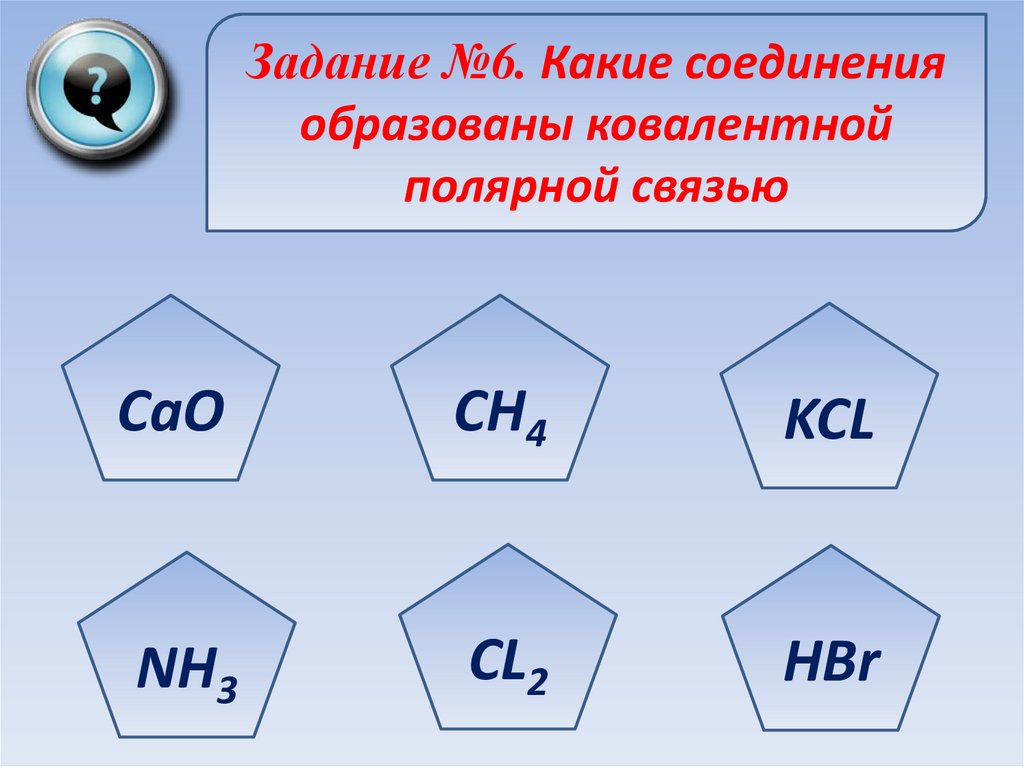
Задание №6. Какие соединенияобразованы ковалентной
полярной связью
CaO
CH4
KCL
NH3
CL2
HBr
76.
Задание №7. Из перечня веществвыберите формулы с
ковалентной неполярной связью
Cl2
CO2
H 2O
Mg
O3
N2
77. Задание №8. Выберите группу веществ, в состав которой входят только вещества с ковалентной неполярной связью:
Выберите группу веществ,в состав которой входят только
вещества с ковалентной неполярной
связью:
Задание №8.
N2 , NH3, H2, KF
CO2, NH3, H2O, NaCl
N2, H2, F2, Cl2
Na, H2, HF, CaCO3
78. Задание №9. Выберите группу веществ, в состав которой входят только вещества с ковалентной полярной связью:
N2 , NH3, H2, KFCO2, NH3, H2O, НCl
N2, H2, F2, C
Na, H2, HF, CaCO3
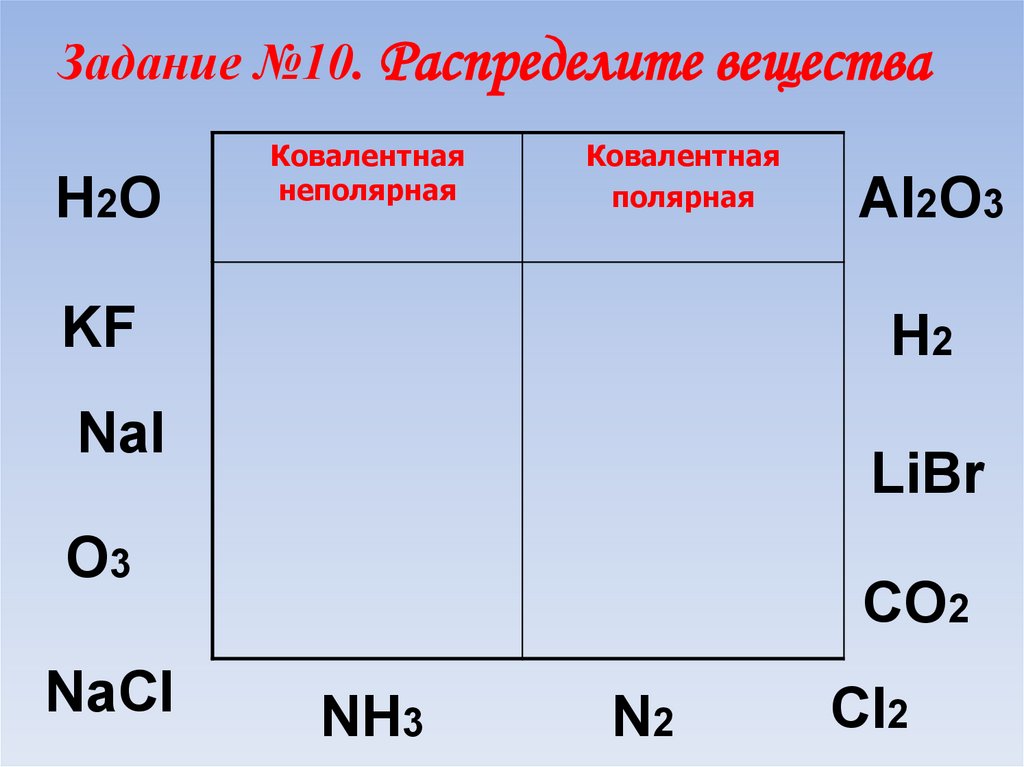
79. Задание №10. Распределите вещества
H2OКовалентная
неполярная
Ковалентная
полярная
KF
H2
NaI
LiBr
О3
NaCl
Al2О3
CO2
NH3
N2
Cl2
80.
СПАСИБО ЗА ВНИМАНИЕ!!!81. Рефлексия
1.На уроке я работал…2.Своей работой на уроке я…
3.Урок для меня показался…
4.За урок я…
5.Мое настроение…
6.Материал урока мне был…
активно, доволен, коротким, не устал,
полезен, стало лучше, понятен, интересен,
легким.
82.
Домашнее заданиеРазобрать
конспект.
Повторить параграф: § 3.2.1;3.2.3
Выполнить задания:
упр. стр.74 №1,3-6*,8 –задача
Упр.стр.80 №1-4,7(а,б),9(а,б),10*









































 Химия
Химия








