Похожие презентации:
Основание
1.
Работа выполнина группой20-113
Тема “Основание”
2.
“Строение”Основания могут содержать одну или несколько гидроксо-групп.
Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а
количество гидроксильных групп зависит от валентности металла.
При этом валентность группы ОН всегда I. Например, в соединении
NaOH валентность натрия равна I, следовательно, присутствует одна
гидроксильная группа. В основании Mg(OH)2 валентность магния –
II, Al(OH)3 валентность алюминия – III.
3.
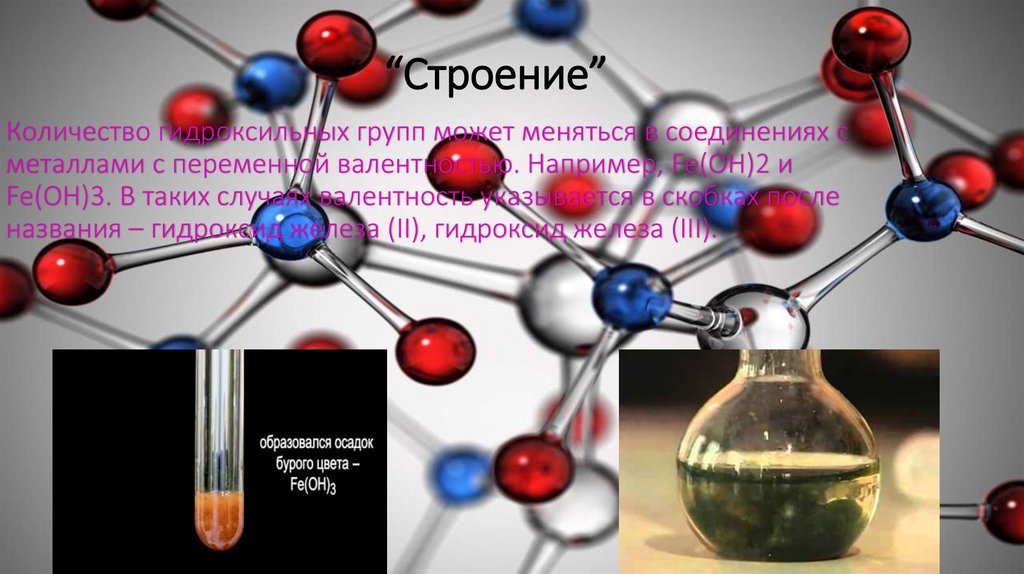
“Строение”Количество гидроксильных групп может меняться в соединениях с
металлами с переменной валентностью. Например, Fe(OH)2 и
Fe(OH)3. В таких случаях валентность указывается в скобках после
названия – гидроксид железа (II), гидроксид железа (III).
4.
“Физические свойства”Характеристика и активность основания зависит от металла.
Большинство оснований – твёрдые вещества белого цвета без
запаха. Однако некоторые металлы придают веществу характерную
окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светлозелёный, Fe(OH)3 – красно-коричневый.
5.
“Виды”Основания классифицируются по двум признакам:
По количеству групп ОН – однокислотные и многокислотные;
По растворимости в воде – щёлочи (растворимые) и
нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием
(Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят
щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий
(Ba).
6.
7.
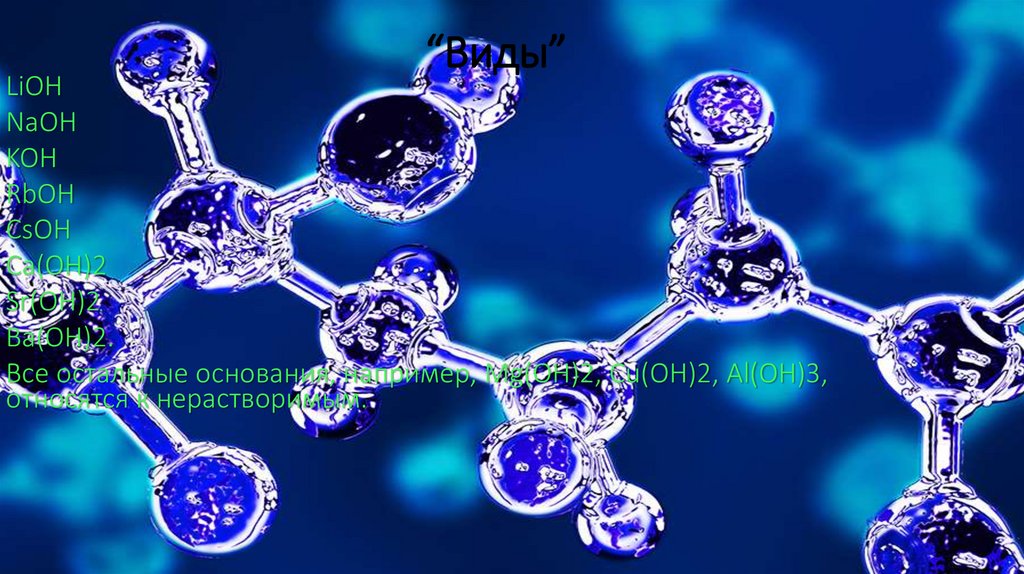
“Виды”LiOH
NaOH
KOH
RbOH
CsOH
Ca(OH)2
Sr(OH)2
Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3,
относятся к нерастворимым.
8.
9.
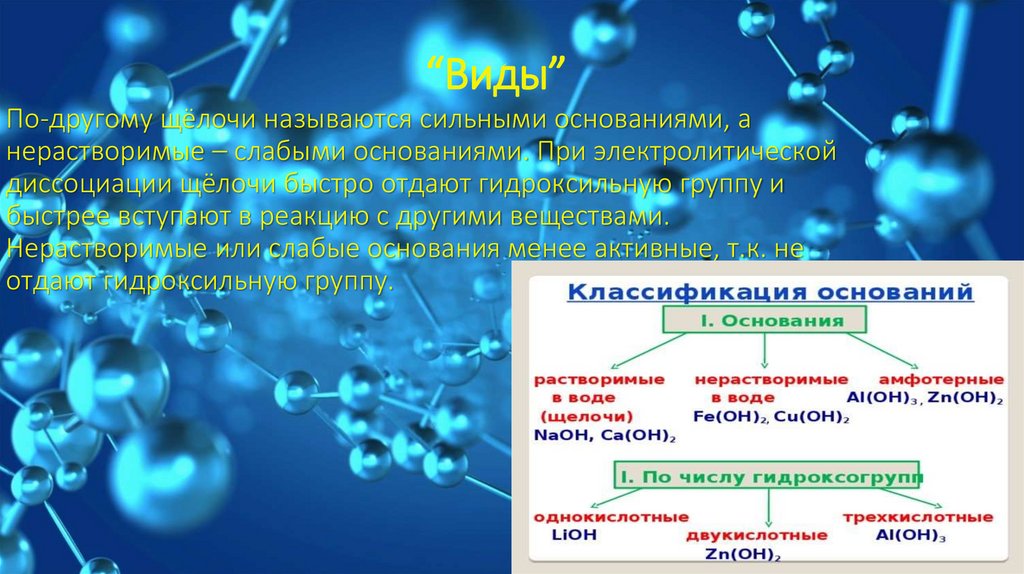
“Виды”По-другому щёлочи называются сильными основаниями, а
нерастворимые – слабыми основаниями. При электролитической
диссоциации щёлочи быстро отдают гидроксильную группу и
быстрее вступают в реакцию с другими веществами.
Нерастворимые или слабые основания менее активные, т.к. не
отдают гидроксильную группу.
10.
“Получение”Основания получают различными способами. Самый простой –
взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате
взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
11.
“Химические свойства”Реакции
Что образуется
Примеры
С кислотами
Соль и вода.
Cu(OH)2↓ + H2SO4 →
Нерастворимые основания CuSO4 +2H2O
взаимодействуют только с
растворимыми кислотами
Разложение при высокой
температуре
Оксид металла и вода
2Fe(OH)3 → Fe2O3 + 3H2O
С кислотными оксидами
(реагируют щёлочи)
Соль
NaOH + CO2 → NaHCO3
С неметаллами (вступают
щёлочи)
Соль и водород
2NaOH + Si + H2O →
Na2SiO3 +H2↑
Обмена с солями
Гидроксид и соль
Ba(OH)2 + Na2SO4 →
2NaOH + BaSO4↓
Щелочей с некоторыми
металлами
Сложная соль и водород
2Al + 2NaOH + 6H2O →
2Na[Al(OH)4] + 3H2↑
12.
Спасибо за вниманиеучастие принемали:
Саратов Кирилл
Радионов Даниил
Шевченко Мирослав
Мирошнеченко Оля
Николаева Виолетта
Лукьянова Злата
Тушова Aннастасия
13.
Список используемой литературы:https://obrazovaka.ru/
https://ru.wikipedia.org/










 Химия
Химия








