Похожие презентации:
Некоторые d-элементы
1. Некоторые d-элементы
Лёвкин А.Н.Некоторые d-элементы
2.
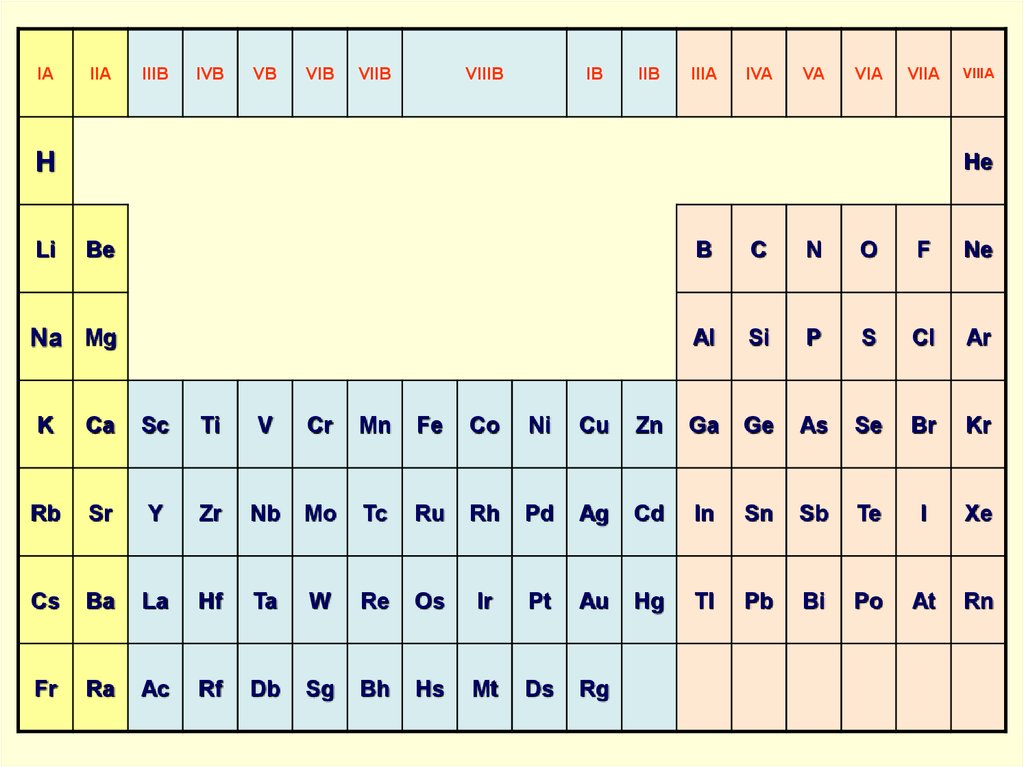
IAIIA
IIIB
IVB
VB
VIB
VIIB
VIIIB
IB
IIB
IIIA
IVA
VA
VIA
VIIA
H
Li
VIIIA
He
Be
B
C
N
O
F
Ne
Na Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
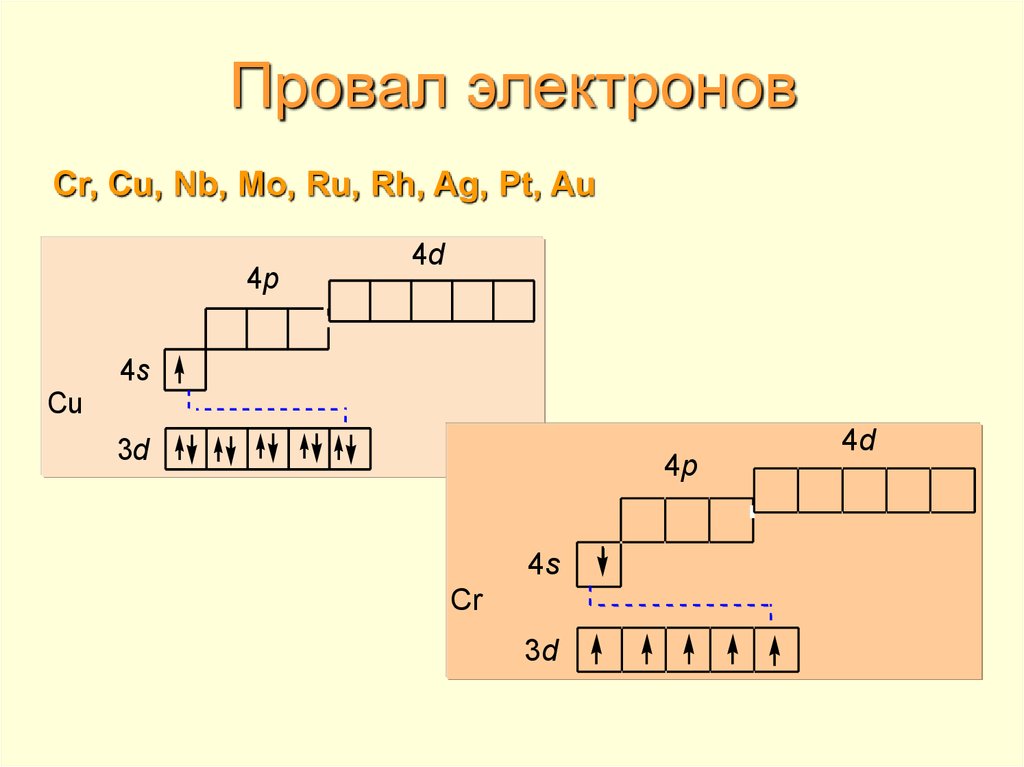
3. Провал электронов
Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au4p
4d
4s
Cu
3d
4p
4s
Cr
3d
4d
4. d-Элементы
ScTi
V
Cr
Mn Fe
Co
Ni
Cu
Zn
3d 1
3d 2
3d 3
3d 5
3d 5
3d 6
3d 7
3d 8
3d 10
3d 10
4s 2
4s 2
4s 2
4s 1
4s 2
4s 2
4s 2
4s 2
4s 1
4s 2
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
4d 1
4d 2
4d 4
4d 5
4d 5
4d 7
4d 8
4d 10
4d 10
4d 10
5s 2
5s 2
5s 1
5s 1
5s 2
5s 1
5s 1
5s 0
5s 1
5s 2
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
5d 1
5d 2
5d 3
5d 4
5d 5
5d 6
5d 7
5d 9
5d 10
5d 10
6s 2
6s 2
6s 2
6s 2
6s 2
6s 2
6s 2
6s 1
6s 1
6s 2
Ac
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
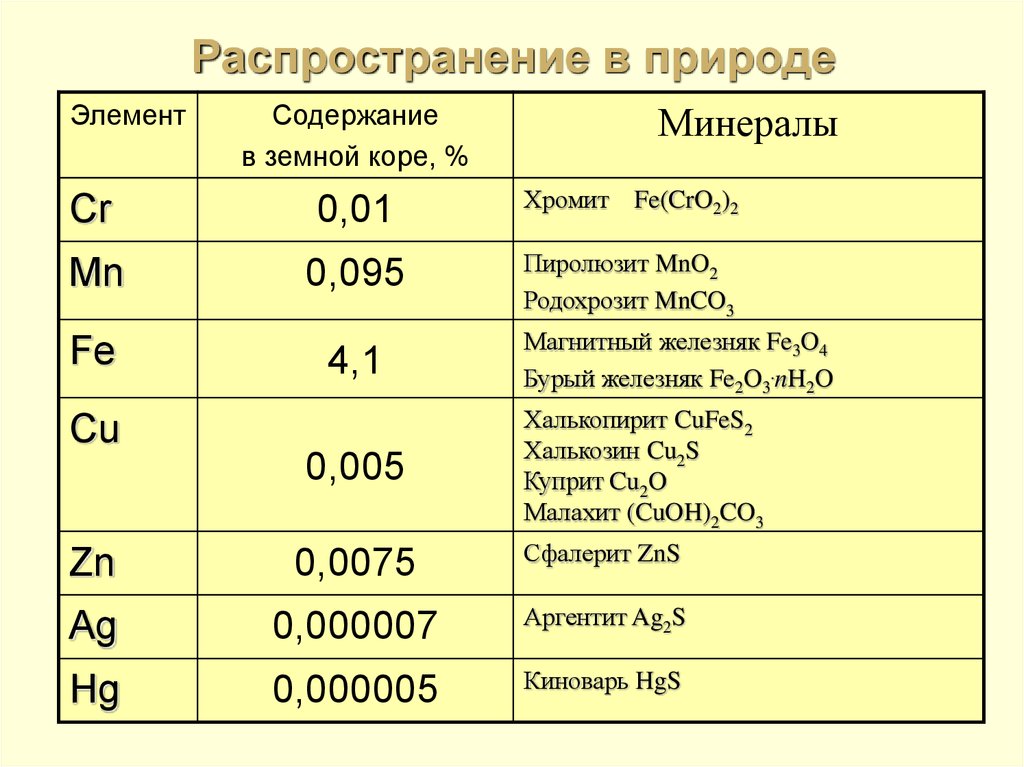
5. Распространение в природе
ЭлементСодержание
в земной коре, %
Cr
0,01
Mn
0,095
Fe
4,1
Cu
0,005
Минералы
Хромит
Fe(CrO2)2
Пиролюзит MnO2
Родохрозит MnCO3
Магнитный железняк Fe3O4
Бурый железняк Fe2O3.nH2O
Халькопирит CuFeS2
Халькозин Cu2S
Куприт Cu2O
Малахит (CuOH)2CO3
Zn
0,0075
Сфалерит ZnS
Ag
0,000007
Аргентит Ag2S
Hg
0,000005
Киноварь HgS
6. М и н е р а л ы
МинералыЛимонит
Fe2O3∙nH2O
Смитсонит
ZnCO3
Магнетит
Fe3O4
Сфалерит
ZnS
Гематит
Fe2O3
Пирит
FeS2
7. Минералы
Малахит(CuOH)2CO3
Хромит
(Fe,Cr2)O4
Крокоит
PbCrO4
8. Минералы
КиноварьHgS
Пиролюзит
MnO2
Серебро
Ag
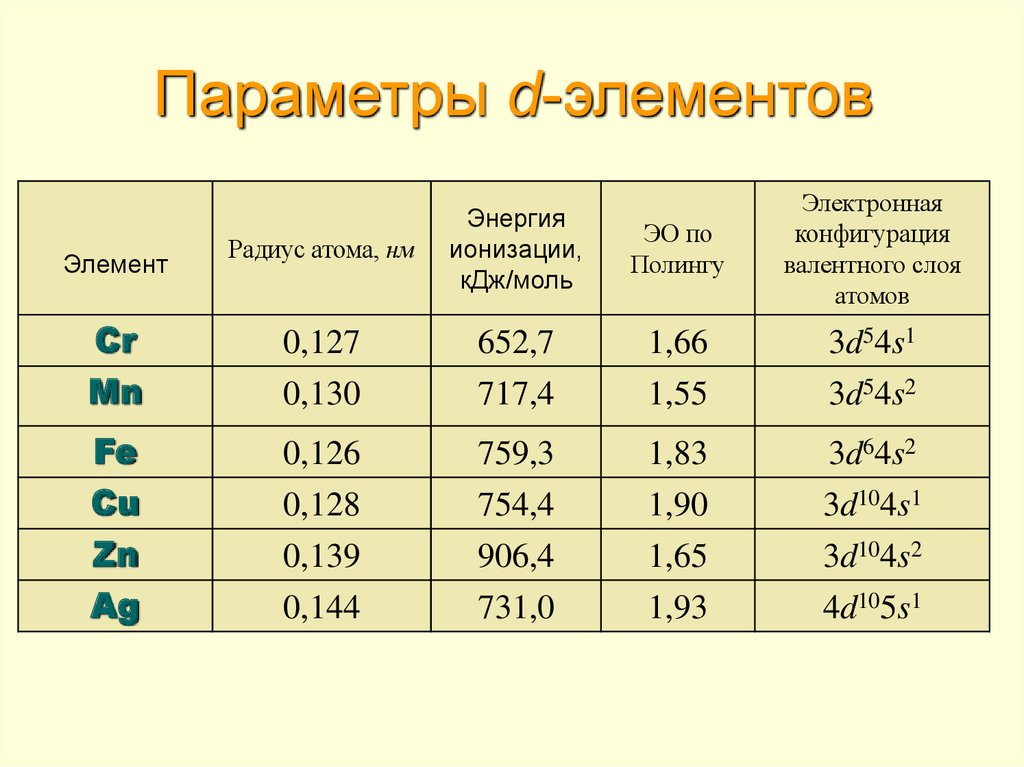
9. Параметры d-элементов
Радиус атома, нмЭнергия
ионизации,
кДж/моль
ЭО по
Полингу
Электронная
конфигурация
валентного слоя
атомов
Cr
Mn
0,127
0,130
652,7
717,4
1,66
1,55
3d54s1
3d54s2
Fe
Cu
Zn
0,126
0,128
0,139
759,3
754,4
906,4
1,83
1,90
1,65
3d64s2
3d104s1
3d104s2
Ag
0,144
731,0
1,93
4d105s1
Элемент
10. Радиусы атомов
0,170,164
0,16
0,15
0,146
0,139
0,14
0,134
0,13
0,13
0,125
0,127
0,126
0,12
0,128
0,124
0,11
0,1
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
11. Радиусы атомов, нм
0,1900,180
0,170
0,160
0,150
0,140
0,130
0,120
Sc Ti
V
Cr Mn Fe Co Ni Cu Zn
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Ta W Re Os
Ir
Лантаноидное f-сжатие
Pt Au Hg
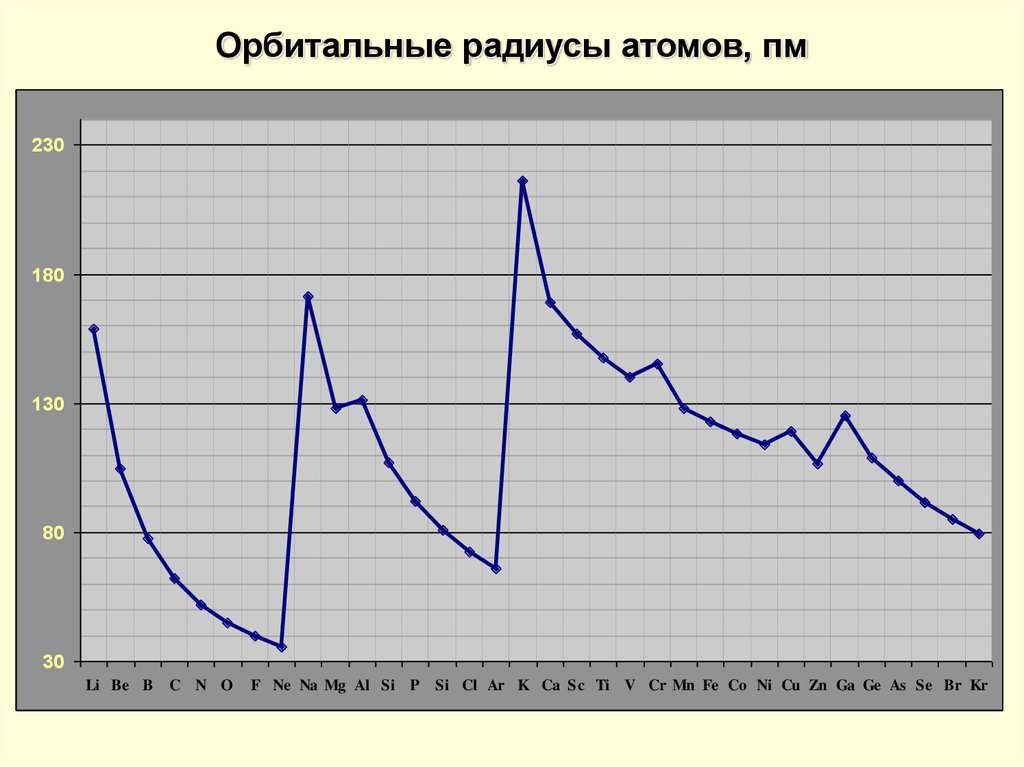
12. Орбитальные радиусы атомов, пм
230180
130
80
30
Li Be B
C N O
F Ne Na Mg Al Si P
Si Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
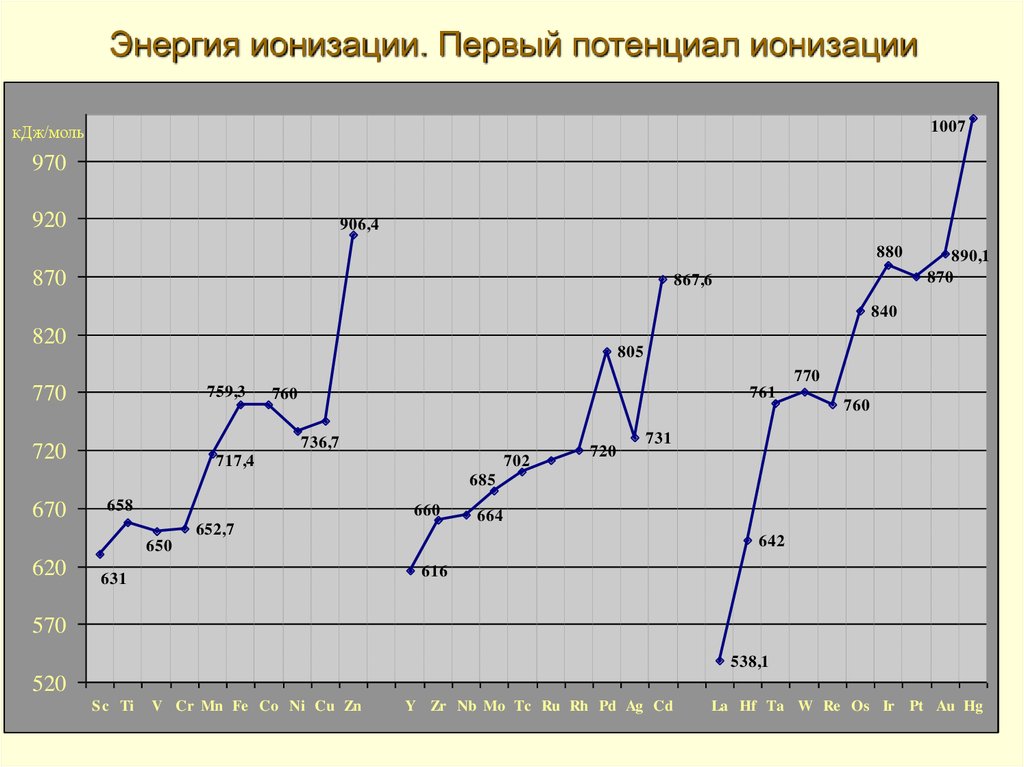
13. Энергия ионизации. Первый потенциал ионизации
1007кДж/моль
970
920
906,4
880
870
867,6
890,1
870
840
820
805
770
770
759,3
761
760
736,7
720
717,4
702
720
760
731
685
670
658
660
652,7
664
642
650
620
616
631
570
538,1
520
S c Ti
V Cr Mn Fe Co Ni Cu Zn
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Ta W Re Os Ir Pt Au Hg
14. Энергия ионизации. Второй потенциал ионизации
кДж/моль2000
1800
1600
1400
1200
1000
Sc Ti
V Cr Mn Fe Co Ni Cu Zn
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Ta W Re O s Ir
Pt Au Hg
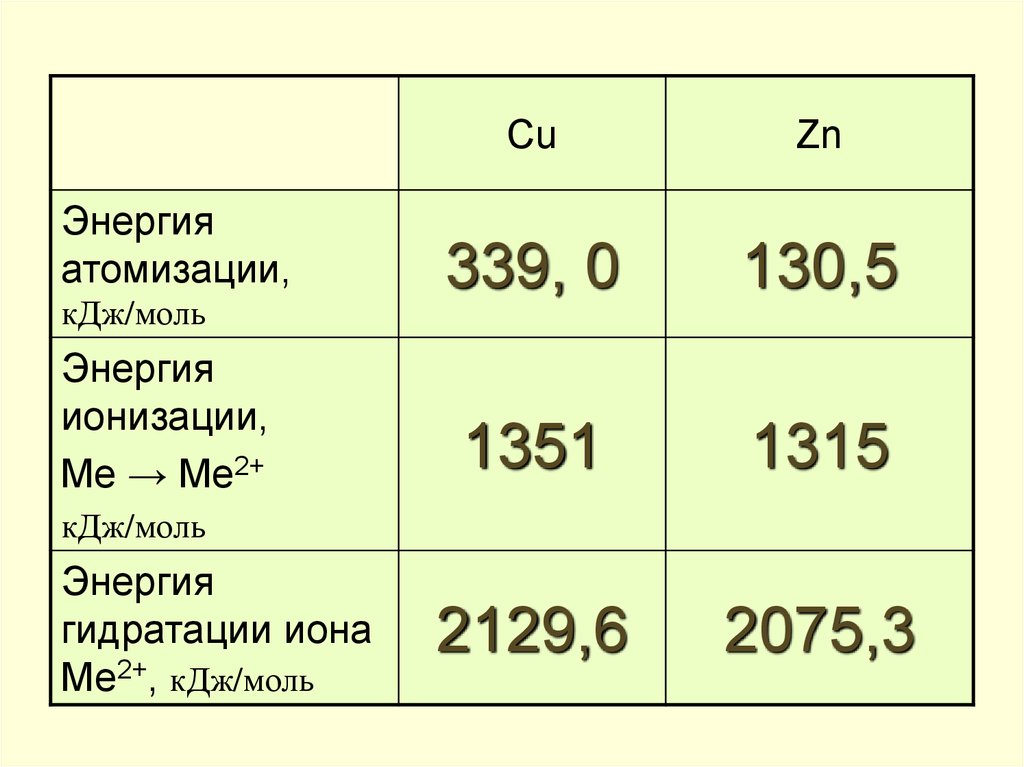
15.
Энергияатомизации,
кДж/моль
Энергия
ионизации,
Me → Me2+
Cu
Zn
339, 0
130,5
1351
1315
2129,6
2075,3
кДж/моль
Энергия
гидратации иона
Ме2+, кДж/моль
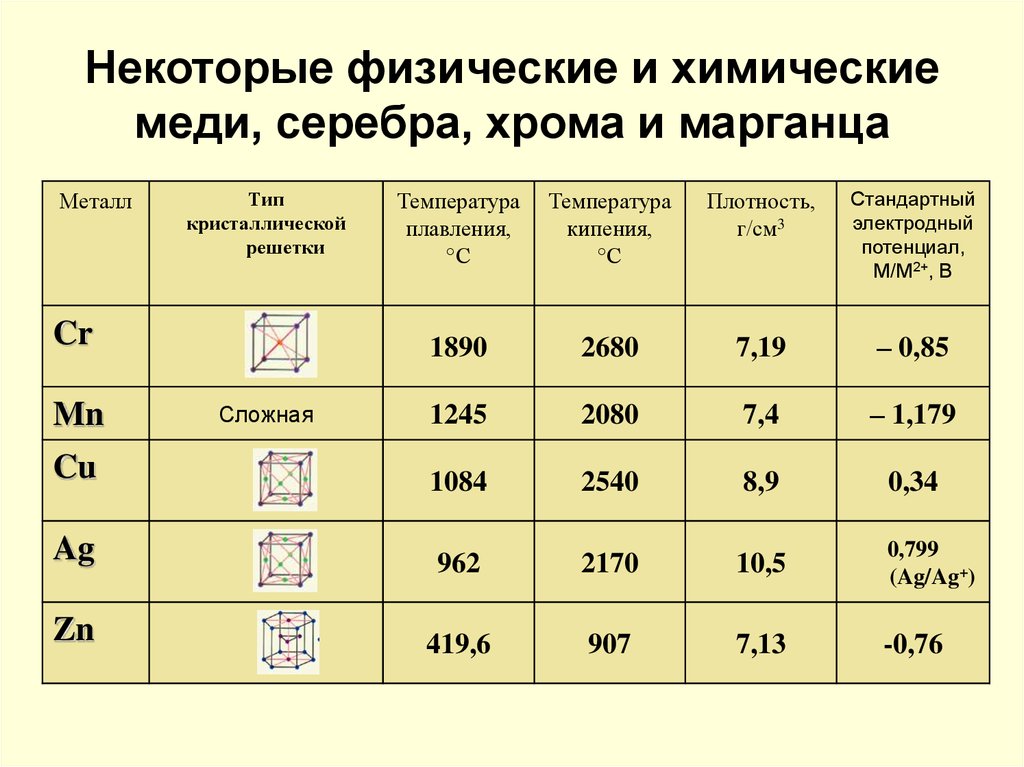
16. Некоторые физические и химические меди, серебра, хрома и марганца
Температураплавления,
°С
Температура
кипения,
°С
Плотность,
г/см3
Стандартный
электродный
потенциал,
М/М2+, В
1890
2680
7,19
– 0,85
1245
2080
7,4
– 1,179
Cu
1084
2540
8,9
0,34
Ag
962
2170
10,5
0,799
(Ag/Ag+)
Zn
419,6
907
7,13
-0,76
Металл
Тип
кристаллической
решетки
Cr
Mn
Сложная
17. Температуры плавления 3d
19601890
°С
1903
1668
1760
1539
1536
1560
1492
1455
1244
1360
1083
1160
960
760
560
420
360
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
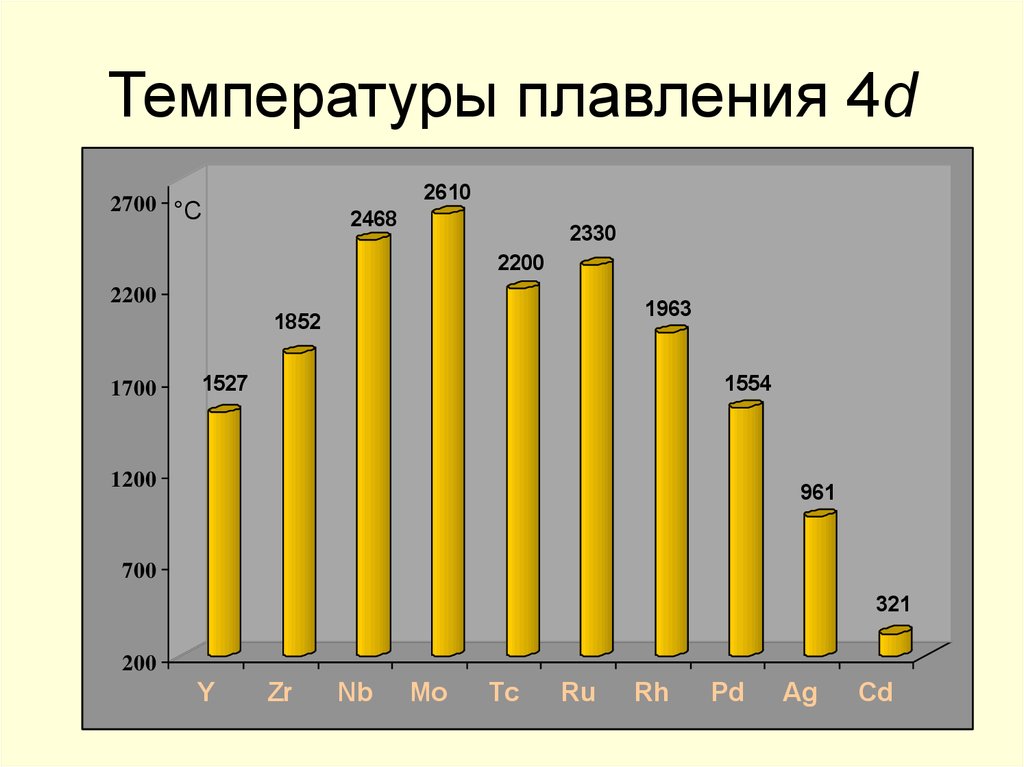
18. Температуры плавления 4d
26102700 °С
2468
2330
2200
2200
1963
1852
1700
1527
1554
1200
961
700
321
200
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
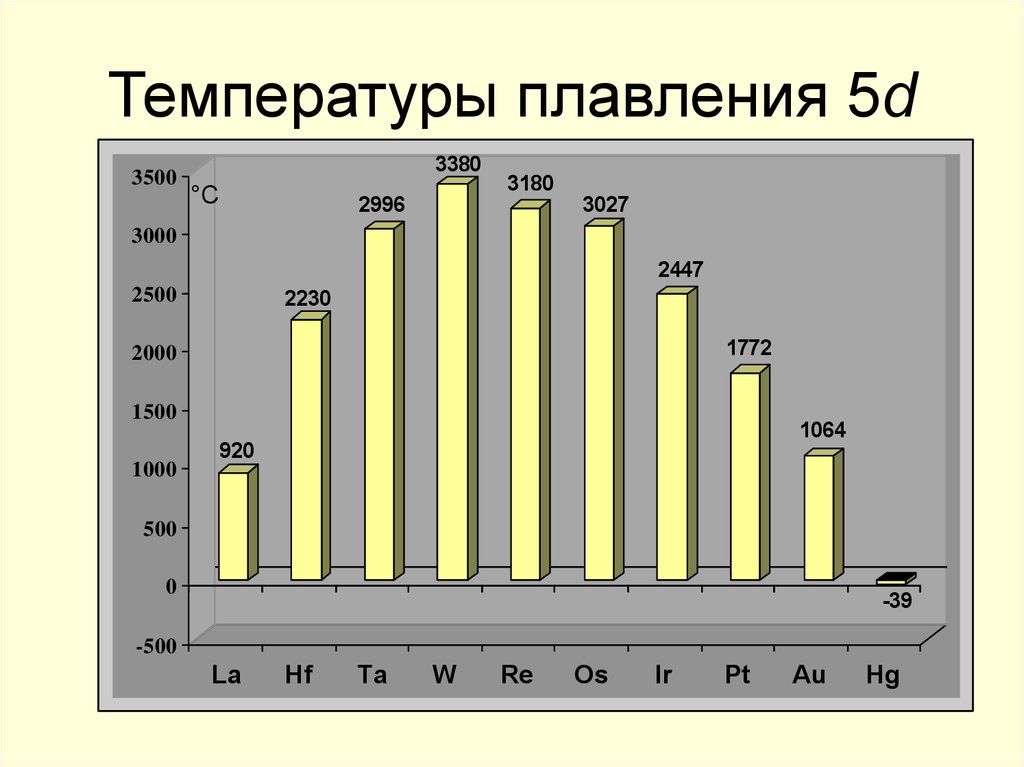
19. Температуры плавления 5d
35003380
°С
2996
3180
3027
3000
2447
2230
2500
1772
2000
1500
1000
1064
920
500
0
-39
-500
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
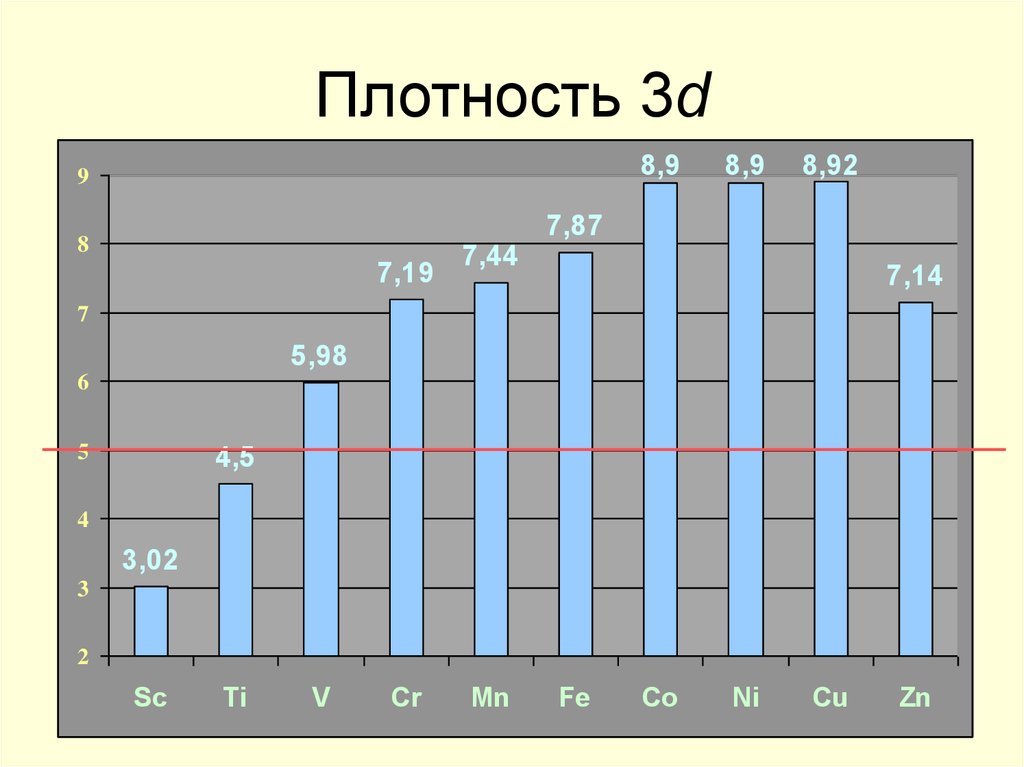
20. Плотность 3d
8,99
8
7,19
7,44
8,9
8,92
7,87
7,14
7
5,98
6
4,5
5
4
3,02
3
2
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
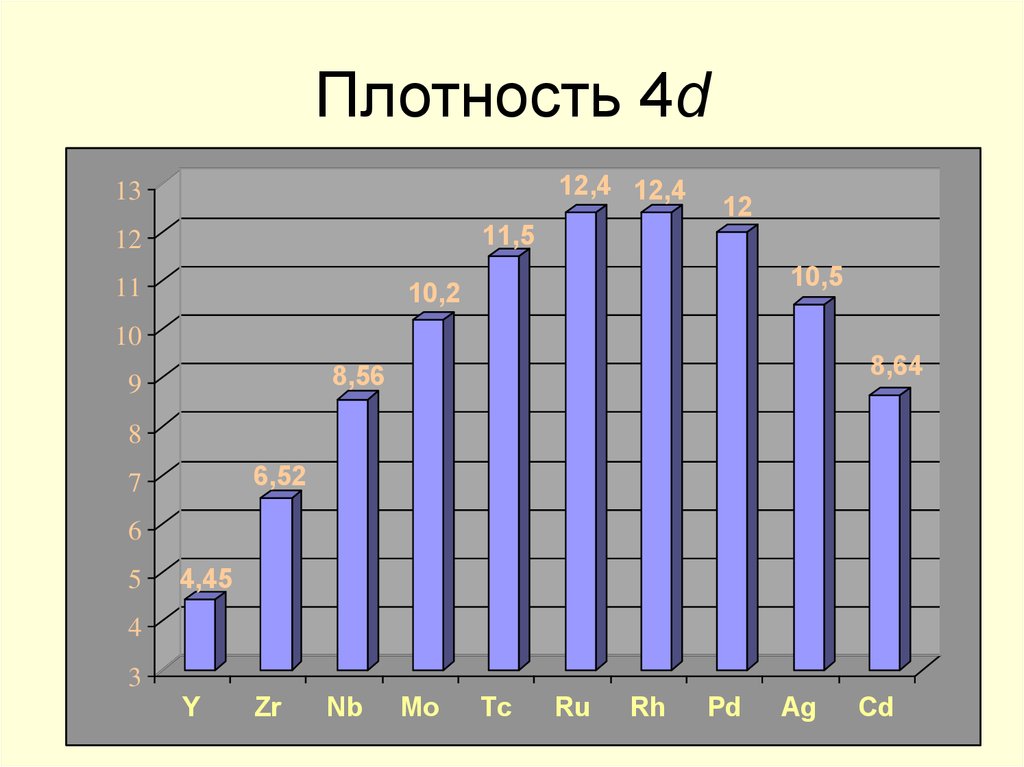
21. Плотность 4d
12,4 12,413
11,5
12
12
10,5
10,2
11
10
8,64
8,56
9
8
6,52
7
6
5
4,45
4
3
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
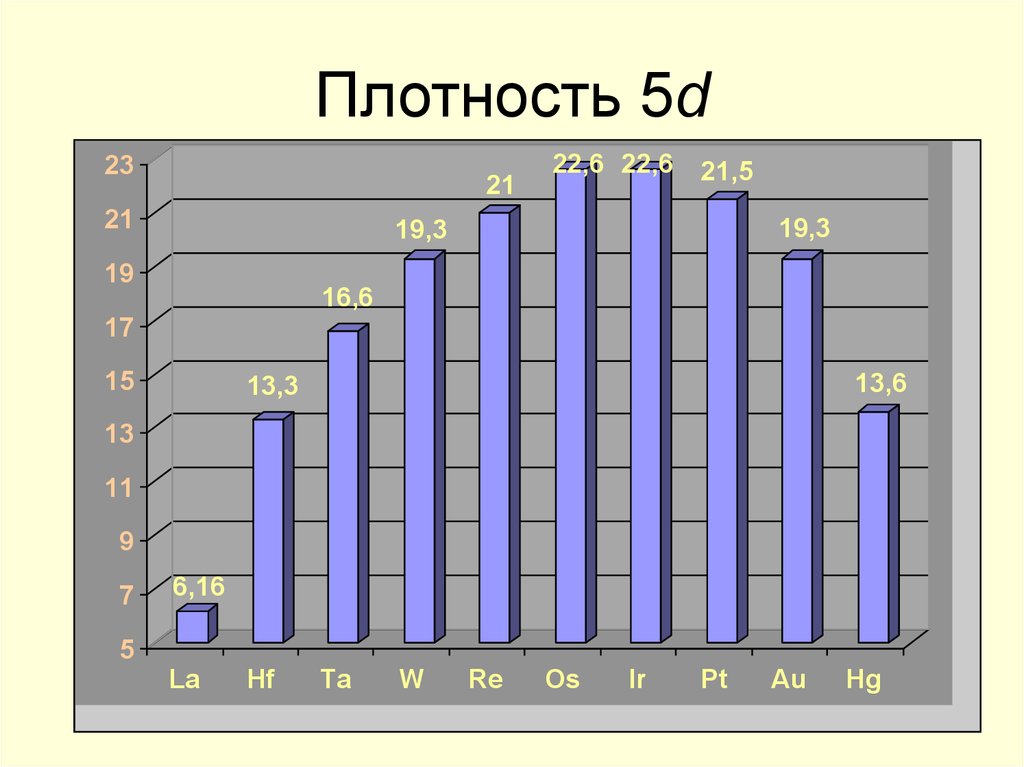
22. Плотность 5d
2321
21
22,6 22,6
21,5
19,3
19,3
19
16,6
17
15
13,6
13,3
13
11
9
7
5
6,16
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
23. Электрическое сопротивление
200180
160
140
120
100
80
60
40
20
0
Sc Ti
V Cr Mn Fe Co Ni Cu Zn
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Ta W Re Os Ir
Pt Au Hg
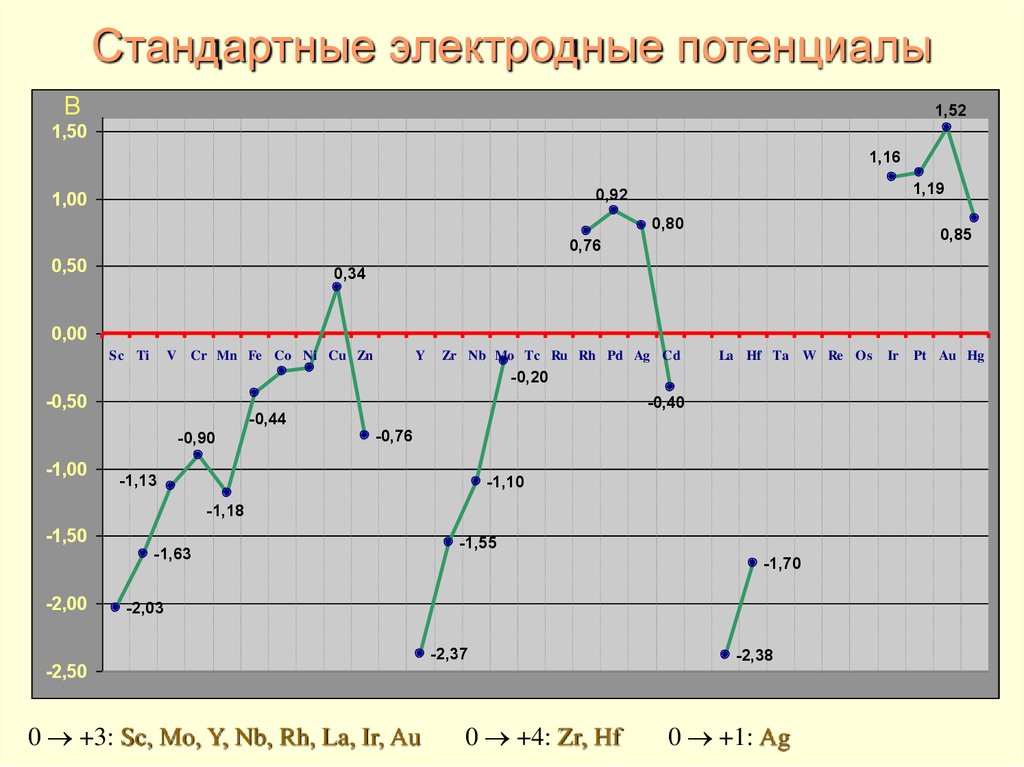
24. Стандартные электродные потенциалы
В1,52
1,50
1,16
1,19
0,92
1,00
0,80
0,85
0,76
0,50
0,34
0,00
S c Ti
V
Cr Mn Fe Co Ni Cu Zn
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Ta W Re Os
-0,20
-0,50
-0,44
-0,90
-1,00
-0,40
-0,76
-1,13
-1,10
-1,18
-1,50
-2,00
-1,63
-1,55
-1,70
-2,03
-2,50
0 +3: Sc, Mo, Y, Nb, Rh, La, Ir, Au
-2,37
0 +4: Zr, Hf
-2,38
0 +1: Ag
Ir
Pt Au Hg
25.
В1,5
1
0,5
0
-0,5
-1
-1,5
-2
-2,5
-3
-3,5
Li K Cs Ba Ca Na La Mg Be
U Al Mn Cr Zn Fe Cd Co Ni Sn Pb Cu Ag Hg Au
26. Горизонтальное сходство
FeCo
Ni
Радиус атома, пм
116,5
116
115
ЭИ, кДж/моль
759,3
760,0
736,7
- 0,44 (0 +2)
- 0,277 (0 +2)
- 0,257(0 +2)
Температура пл., °С
1535
1495
1453
Степени окисления
+2, +3, (+6)
+2, +3
+2
Ru
Rh
Pd
Радиус атома, пм
124
125
128
ЭИ, кДж/моль
711
720
805
-
0,76(0 +3)
0,915 (0 +2)
Температура пл., °С
2310
1966
1552
Степени окисления
+2, +3,+4,+6,+7,+8
+2,+3,+4,+6
+2,+4
Os
Ir
Pt
Радиус атома, пм
126
126
129
ЭИ, кДж/моль
840
880
870
-
1,156 (0 +3)
0,980
Температура пл., °С
3054
2410
1772
Степени окисления
+2,+4,+8
+3,+4
+2,+4,+6
E°, В
E°, В
E°, В
27. Устойчивость высшей степени окисления
+34Cr(порошок) + 3O2 = 2Cr2O3
+6
(медленно)
2Mo + 3O2 = 2MoO3
(600-700 °C)
2W + 3O2 = 2WO3
(выше 500 °С)
+2,+3
3Fe + 2O2 =
Fe3O4
+4
Ru + O2 = RuO2
+8
Os + 2O2 = OsO4
Чем обусловлена устойчивость
высшей степени окисления
У 4d- и 5d-элементов?
(150-600 °С, сгорание на воздухе)
(400 °С)
(400 °C, сгорание на воздухе)
MnO4- / MnO2
TcO4- / TcO2
ReO4- / ReO2
Экранирующее влияние электронов на f-подуровне!
1,69 В
0,74 В
0,51 В
28. Химические свойства меди
2Cu + O2 = 2CuOCu + Cl2 = CuCl2
2Cu + S = Cu2S
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4H2O
2Cu + O2 + CO2 + H2O = (CuOH)2CO3
Опыт: горение меди в хлоре
Опыт: взаимодействие меди с азотной кислотой
Опыт: взаимодействие меди с серной концентрированной кислотой
29. Химические свойства серебра
2Ag + Cl2 = 2AgCl2Ag + S = Ag2S
2Ag + 2H2SO4 (конц., гор.) = Ag2SO4 + SO2 + 2H2O
3Ag + 4HNO3 (разб.) = 3AgNO3 + NO + 2H2O
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Ag + F2 = AgF2
(>300 °C)
30. Химические свойства цинка
2Zn + O2 = 2ZnOZn + Cl2 = ZnCl2
Zn + S = ZnS
Zn + H2O (пар) = ZnO + H2
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S + 4H2O
4Zn + 10HNO3 (оч.разб., гор.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + H3PO4 (конц., гор.) = ZnHPO4 + H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Zn + 4 NH3.H2O = [Zn(NH3)4](OH)2 + H2 + 2H2O
31. Химические свойства ртути
2Hg + O2 = 2HgO250-350 °C
Hg + Cl2 = HgCl2
70-120 °C
Hg + HgCl2 = Hg2Cl2
250-300 °C
Hg + S = HgS
2Hg + 2H2SO4 = Hg2SO4 + SO2 + 2H2O
конц., гор.
Hg + 2H2SO4 = HgSO4 + SO2 + H2O
конц.
6Hg + 8HNO3 = 3Hg2(NO3)2 + 2NO + 4H2O
разб.,хол.
Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O
конц., гор.
Опыт: взаимодействие ртути с азотной кислотой
Hg + 4HI = H2[HgI4] + H2
конц.
32. Химические свойства хрома
Не реагирует с холодной водой, щелочами,гидратом аммиака, пассивируется в концентрированной
и разбавленной азотной кислоте, «царской водке».
4Cr (порошок) + 3O2 = 2Cr2O3.
Cr + 2F2 = CrF4
(350-500 °C)
2Cr + 3H2O (пар) = Cr2O3 + 3H2
Cr + H2SO4 (разб.) = CrSO4 + H2
Cr + 2HCl = CrCl2 + H2
33. Химические свойства марганца
Mn + Cl2 = MnCl2Mn + O2 = MnO2
Mn + S = MnS
Mn (порошок) + 2H2O (пар) = Mn(OH)2 + H2
Mn + 2HCl = MnCl2 + H2
Mn + H2SO4 = MnSO4 + H2
Mn + 2H2SO4 (конц.) = MnSO4 + SO2 + 2H2O
3Mn + 8HNO3 (конц.) = 3Mn(NO3)2 + 2NO + 4H2O
34.
IAIIA
IIIB
IVB
VB
VIB
VIIB
VIIIB
IB
IIB
IIIA
IVA
VA
VIA
VIIA
H
VIIIA
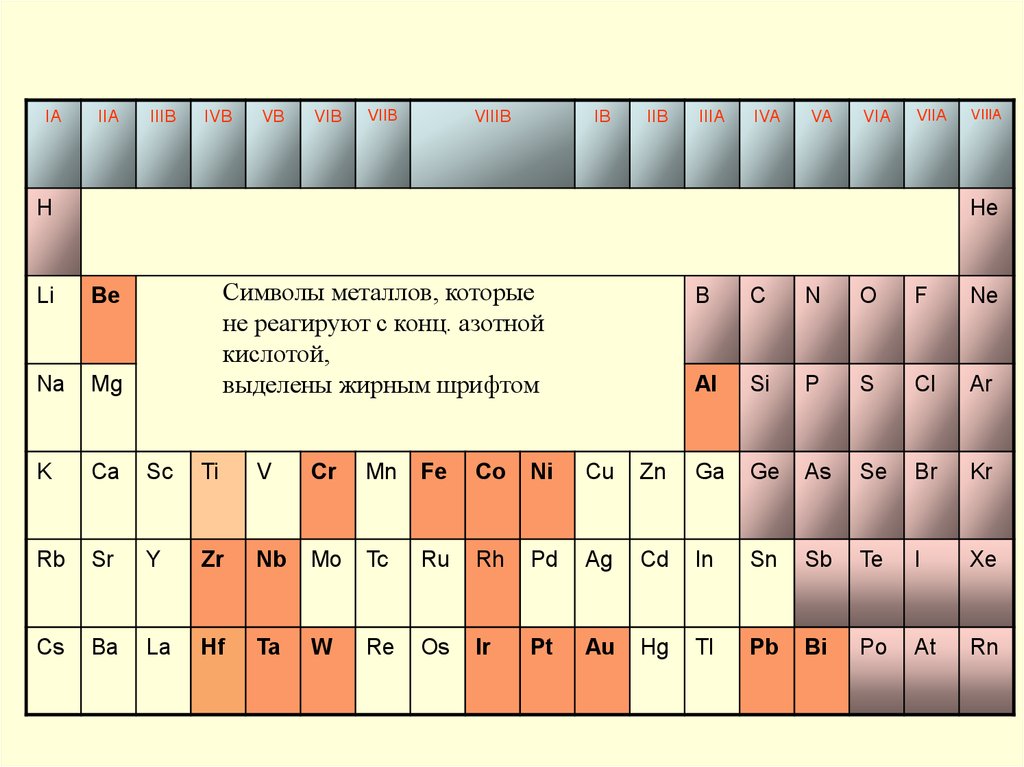
He
Символы металлов, которые
не реагируют с конц. азотной
кислотой,
выделены жирным шрифтом
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
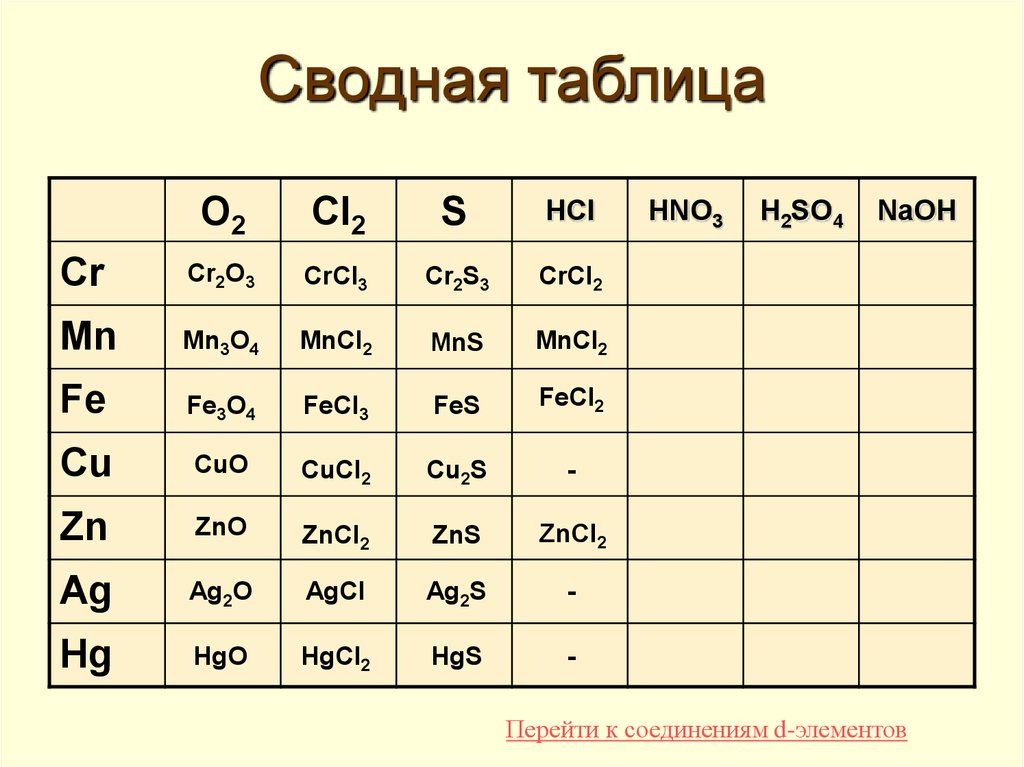
35. Сводная таблица
O2Cl2
S
HCl
Cr
Cr2O3
CrCl3
Cr2S3
CrCl2
Mn
Mn3O4
MnCl2
MnS
MnCl2
Fe
Fe3O4
FeCl3
FeS
FeCl2
Cu
CuO
CuCl2
Cu2S
-
Zn
ZnO
ZnCl2
ZnS
ZnCl2
Ag
Ag2O
AgCl
Ag2S
-
Hg
HgO
HgCl2
HgS
-
HNO3
H2SO4
NaOH
Перейти к соединениям d-элементов
36. Окраска высших оксидов d-элементов
Sc2O3 TiO2Y 2 O3
V2O5
CrO3 Mn2O7 Fe2O3 Co3O4 NiO
CuO
ZnO
ZrO2 Nb2O5 MoO3 Tc2O7 RuO4 Rh2O3 PdO
Ag2O
CdO
La2O3 HfO2 Ta2O5 WO3 Re2O7 OsO4 Ir2O3
PtO2 Au2O3 HgO
37. Соединения d-элементов
Кислотно-основный характер оксидов и гидроксидовКислотность в о з р а с т а е т
CrO
Cr2O3
CrO3
с повышением степени окисления
Cr(OH)2
Cr(OH)3
H2CrO4
с повышением степени окисления
HgO
CdO
ZnO
по подгруппе с убыванием Z
Zn
Cd
Hg
Sc2O3
TiO2
V2O5
CrO3
Mn2O7
по периоду с повышением степени окисления
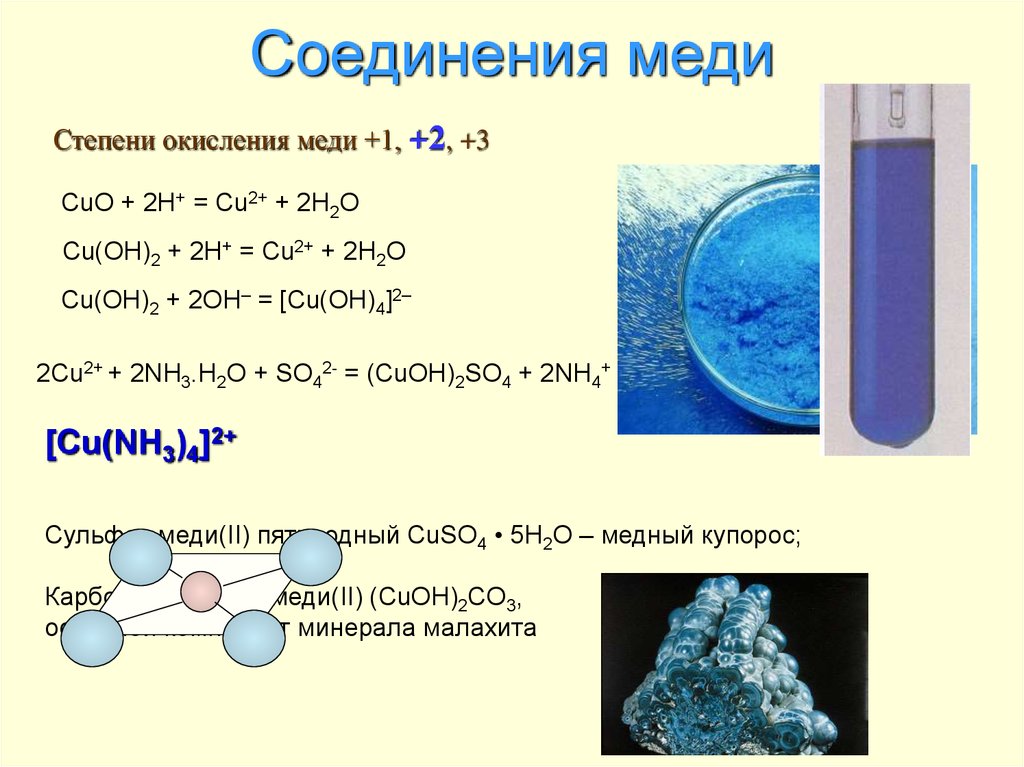
38. Соединения меди
Степени окисления меди +1, +2, +3CuO + 2H+ = Cu2+ + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Cu(OH)2 + 2OH– = [Cu(OH)4]2–
2Cu2+ + 2NH3.H2O + SO42- = (CuOH)2SO4 + 2NH4+
[Cu(NH3)4]2+
Сульфат меди(II) пятиводный CuSO4 • 5H2O – медный купорос;
Карбонат гидроксомеди(II) (CuOH)2CO3,
основной компонент минерала малахита
39. Полезная информация к практикуму
2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]↓Cu2+ + S2- = CuS↓
CuS + 2H+ -X
CuSO4 + H2S = CuS↓ + H2SO4
3CuSO4 + 2Al = Al2(SO4)3 + 3CuCl2
3CuCl2 + 2Al = 2AlCl3 + 3Cu
40. Соединения серебра
Степени окисления серебра +1, +2, +3Ag2O
ПР = 1,6·10-8
2AgNO3 + 2NaOH = Ag2O +2NaNO3 + H2O
AgNO3
Соль
Растворимость 225,5 г/100 г Н2О при 20 °С
ПР
AgCl
1,8·10-10
AgBr
6·10-13
AgI
1,1·10-16
Ag3PO4
1·10-20
Ag2CO3
8,2·10-12
Ag2S
6·10-50
Ag2SO4
2·10-5
Ag2CrO4
4·10-12
AgCl + 2NH3 = [Ag(NH3)2]Cl
К.ч. = 2
[Ag(NH3)2]OH реактив Толленса
AgI + Na2S2O3 = Na3[Ag(S2O3)2] + NaI
41. Соединения хрома
Хром был открыт в минерале крокоитеPbCrO4
Луи Вокленом в 1797 г.
42. Соединения хрома
Степени окисления хрома+2, +3, +4, +6
CrO
4CrCl2 + 4HCl + O2 = 4CrCl3 + 2H2O
Cr(OH)2
+3
Cr2O3 Cr(OH)3
+6
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
CrO(OH)
CrO3
H2CrO4
Кислотность
+2
Cr(OH)2 + 2H+ = Cr2+ + 2H2O
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
CrO3 + H2O = H2CrO4
2CrO42– + 2H+ Cr2O72– + H2O
K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
K2Cr2O7 + K2SO3 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + H2O
CrO2
ферромагнитен
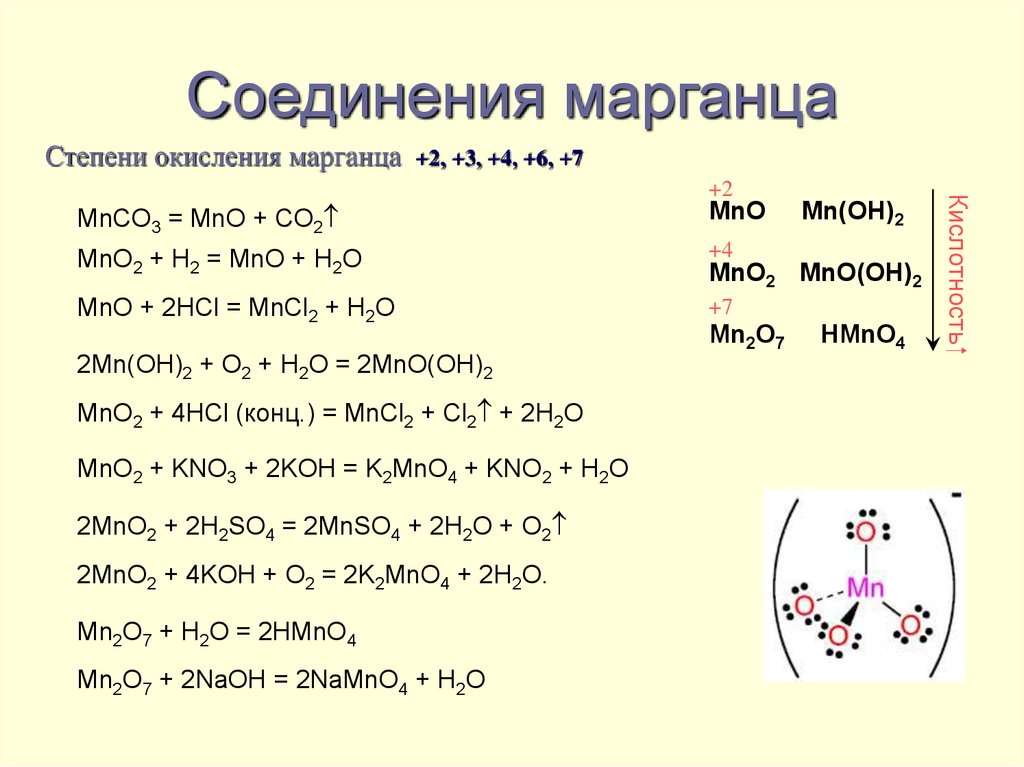
43. Соединения марганца
Степени окисления марганца+2, +3, +4, +6, +7
MnCO3 = MnO + CO2
MnO
MnO2 + H2 = MnO + H2O
+4
MnO + 2HCl = MnCl2 + H2O
+7
2Mn(OH)2 + O2 + H2O = 2MnO(OH)2
MnO2 + 4HCl (конц.) = MnCl2 + Cl2 + 2H2O
MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O
2MnO2 + 2H2SO4 = 2MnSO4 + 2H2O + O2
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O.
Mn2O7 + H2O = 2HMnO4
Mn2O7 + 2NaOH = 2NaMnO4 + H2O
Mn(OH)2
MnO2 MnO(OH)2
Mn2O7
HMnO4
Кислотность
+2
44. Окислительные свойства перманганата
+7+2
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
+7
+4
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH
+6
+7
2KMnO4 + K2SO3 + 2KOH = 2 K2MnO4 + K2SO4 + H2O
+6
+7
+4
2K2MnO4 + 2H2O 2KMnO4 + MnO2 + 4KOH
+4
+6
2KMnO4 = K2MnO4 + MnO2 + O2
+7
Опыт: восстановление перманганата в кислой среде
Опыт: восстановление перманганата в нейтральн. ср.
Опыт: восстановление перманганата в щелочной среде
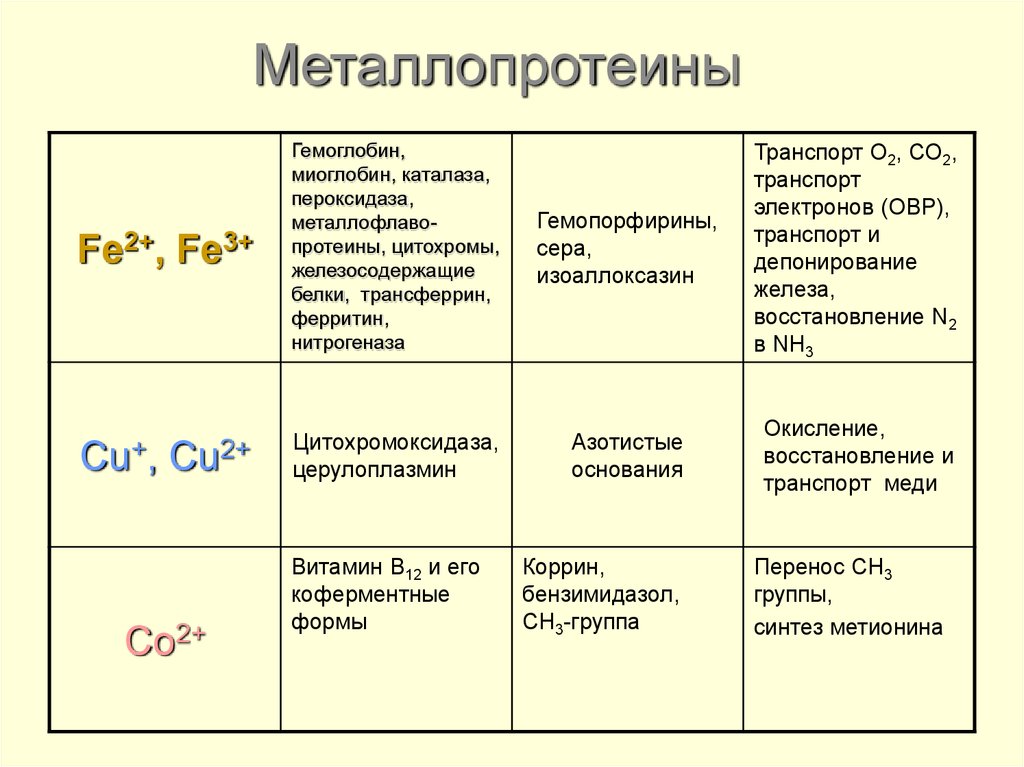
45. Металлопротеины
Fe2+, Fe3+Гемоглобин,
миоглобин, каталаза,
пероксидаза,
металлофлавопротеины, цитохромы,
железосодержащие
белки, трансферрин,
ферритин,
нитрогеназа
Гемопорфирины,
сера,
изоаллоксазин
Транспорт О2, СО2,
транспорт
электронов (ОВР),
транспорт и
депонирование
железа,
восстановление N2
в NH3
Cu+, Cu2+
Цитохромоксидаза,
церулоплазмин
Азотистые
основания
Окисление,
восстановление и
транспорт меди
Co2+
Витамин В12 и его
коферментные
формы
Коррин,
бензимидазол,
СН3-группа
Перенос СН3
группы,
синтез метионина
46. Металлопротеины
Mn2+Mo2+
Zn2+,
Mg2+,
Ca2+
Аргиназа,
декарбоксилазы
аминокислот,
фосфотрансферазы
Фосфат, имидазол
Декарбоксилирова
ние,
перенос
фосфатных групп
Нитрогеназа,
Нитрат-редуктаза,
ксантиноксидаза
Не
идентифицирован
Связывание и
активирование
N2 NH3,
окисление пуринов
Карбоангидраза,
пептидазы,
фосфатазы, НАДферменты
Имидазол, НАД
Связывание
субстратов, разрыв
пептидной связи
47. Применение
Металл
Области применения
Mn
Сплавы, легирующая добавка к стали.
Cu
Проводники электрического тока, сплавы
(латунь, бронза, мельхиор и др.),
теплообменники.
Ag
Электротехнические контакты, зеркальные
покрытия, ювелирные изделия, производство
фотографических материалов.
Cr
Сплавы, легирующая добавка к стали,
антикоррозийные и декоративные покрытия.
Zn
Гальванические элементы, антикоррозийные
покрытия, сплавы.





























 Химия
Химия








