Похожие презентации:
Тепловой эффект химических реакций
1. Тепловой эффект химических реакций
ТЕПЛОВОЙ ЭФФЕКТХИМИЧЕСКИХ
РЕАКЦИЙ
2. «Зимняя ночь» Б.Пастернак
«ЗИМНЯЯ НОЧЬ»Б.ПАСТЕРНАК
Мело, мело по всей земле
Во все пределы.
Свеча горела на столе,
Свеча горела.
3. Химический эксперимент
ХИМИЧЕСКИЙ ЭКСПЕРИМЕНТZn + 2HCl = ZnCl2 + H2↑ + Q
Признаками проводимой реакции будут
выделение газа и теплоты.
NH4NO3 + H2O ⇄ NH4OH + HNO3 – Q
Признаком проводимой реакции будет
поглощение теплоты.
4.
Количество теплоты, которое выделяется илипоглощается при химической реакции,
называют тепловым эффектом реакции.
Тепловой эффект обозначается Q и измеряется
в Дж или кДж.
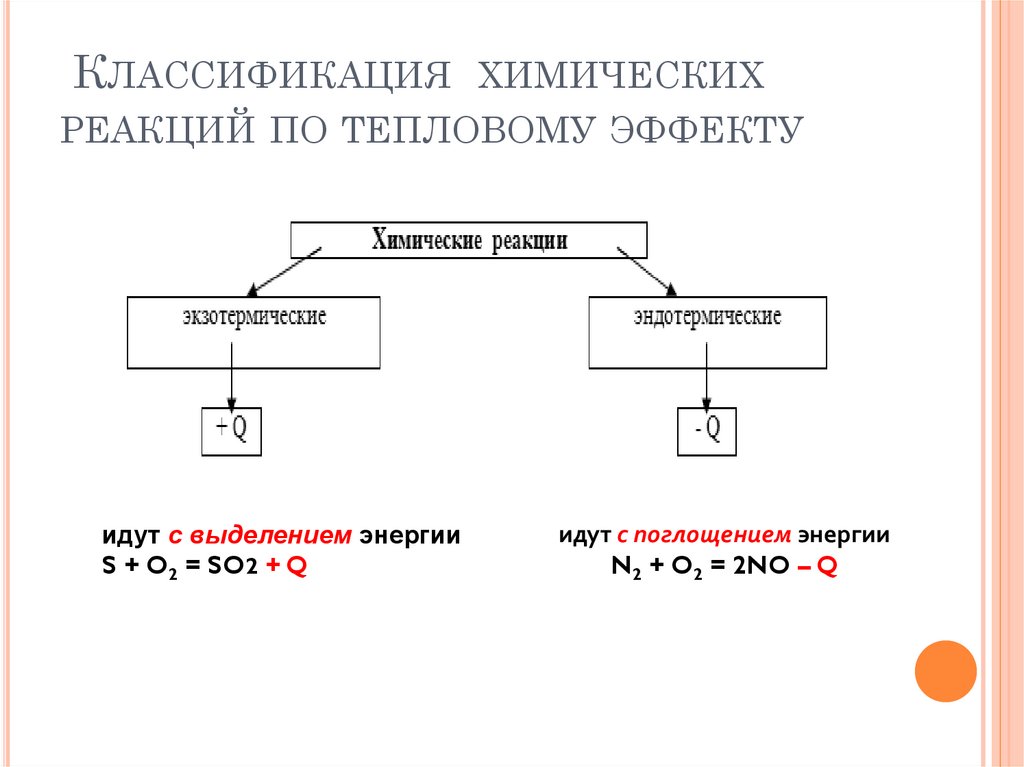
5. Классификация химических реакций по тепловому эффекту
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХРЕАКЦИЙ ПО ТЕПЛОВОМУ ЭФФЕКТУ
идут с выделением энергии
S + O2 = SO2 + Q
идут с поглощением энергии
N2 + O2 = 2NO – Q
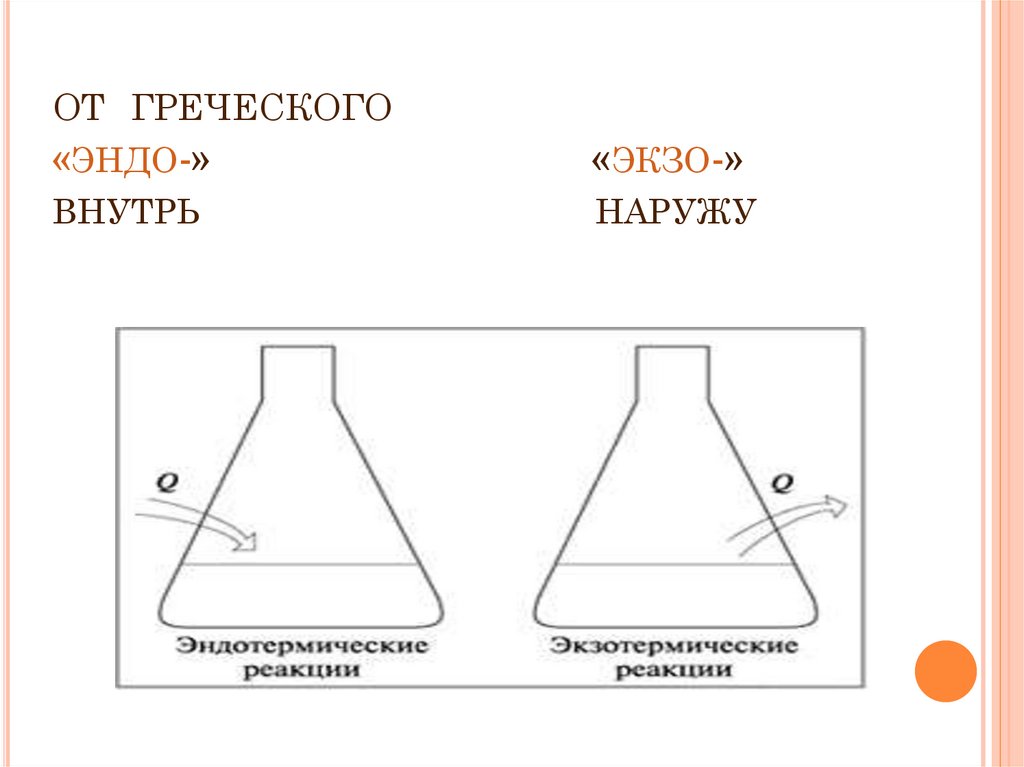
6. от греческого «эндо-» «экзо-» внутрь наружу
ОТ ГРЕЧЕСКОГО«ЭНДО-»
«ЭКЗО-»
ВНУТРЬ
НАРУЖУ
7.
Химические уравнения, в которых указываетсятепловой эффект, называют термохимическими.
Например:
2HgO —> 2Hg + O2 – 180 кДж,
С(тв) + O2(г) —> СO2(г) + 394 кДж
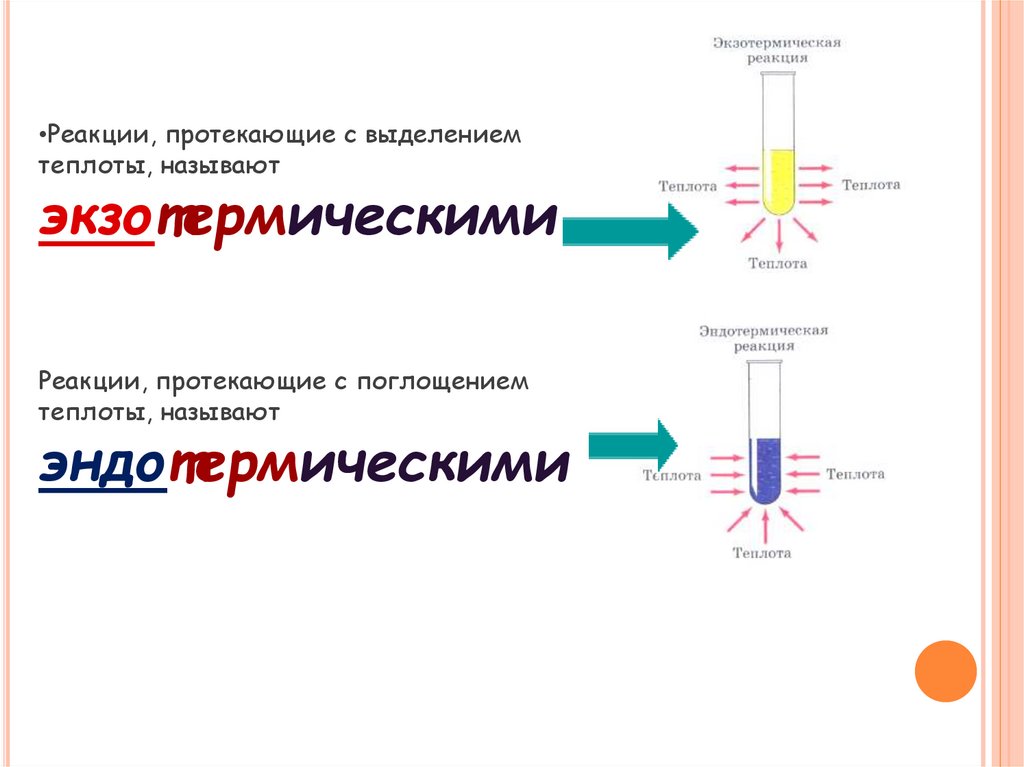
8.
•Реакции, протекающие с выделениемтеплоты, называют
экзотермическими
Реакции, протекающие с поглощением
теплоты, называют
эндотермическими
9. Герман Иванович Гесс
ГЕРМАН ИВАНОВИЧ ГЕСС-Российский академик
-Основоположник термохимии
Термохимия —
раздел химии, в
задачу которого входит определение и
изучение тепловых эффектов реакции
10. Алгоритм решения задач по термохимическому уравнению
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ ПОТЕРМОХИМИЧЕСКОМУ УРАВНЕНИЮ
Кратко записать условия задачи (“дано”).
Записать термохимическое уравнение реакции
(ТХУ), одной чертой в уравнении реакции
подчеркнуть то, что известно и то, что необходимо
определить.
Провести вспомогательные вычисления.
m=M*v
Составить пропорцию, используя вспомогательные
вычисления и условия задачи, и решить ее.
Записать ответ.
11.
12.
13.
14. Заполни пропуски
ЗАПОЛНИ ПРОПУСКИ1. Реакции, протекающие с выделением теплоты и
света называются реакциями …..
а) разложения;
б) эндотермические;
в) экзотермические
г)замещения
15.
2. Какие схемы можно назватьтермохимическими уравнениями реакций?
а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
б) 2 H2 + O2 = 2 H2О + 572 кДж
в) 2 H2(г) + O2(г) = 2 H2О(ж)
16.
3. Какая запись, соответствует эндотермическойреакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО – 310 кДж
г) Н2 + I2 = 2HI – 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
17.
4. Приведены уравнения реакций:1. С+О2 = СО2 + 402,24кДж
2. 2HgO = 2Hg + О2 -180кДж
Определите тип, к которому относятся данные
реакции.
А) обе реакции экзотермические
Б) обе реакции эндотермические
В) А – эндотермическая, а Б – экзотермическая
Г) А – экзотермическая, а Б – эндотермическая
18.
Решите задачу.Определите количество теплоты,
которое выделится при образовании
120 г MgO в результате реакции
горения магния, с помощью
термохимического уравнения:
2 Mg + O2 = 2MgO + 1204 кДж















 Химия
Химия








