Похожие презентации:
Тепловые эффекты химических реакций
1. Тепловые эффекты химических реакций
2.
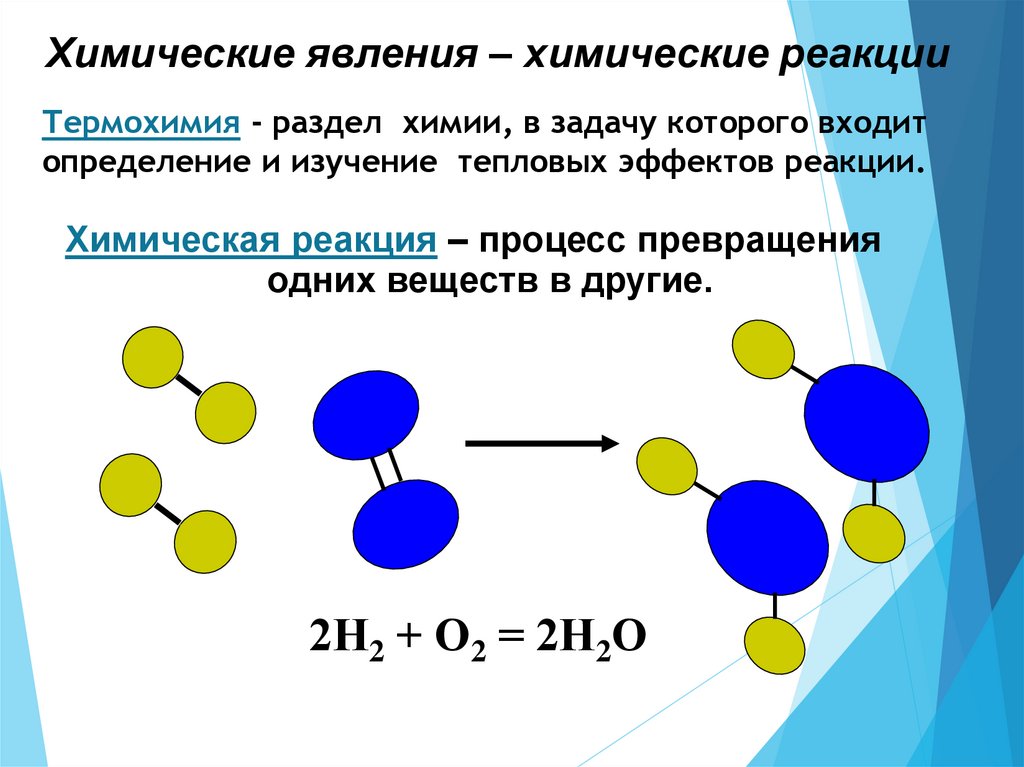
Химические явления – химические реакцииТермохимия - раздел химии, в задачу которого входит
определение и изучение тепловых эффектов реакции.
Химическая реакция – процесс превращения
одних веществ в другие.
2Н2 + О2 = 2Н2О
3.
Признаки химических реакцийИзменение цвета
Выделение газа
Образование или растворение осадка
Появление или исчезновение запаха
Выделение или поглощение тепла
4.
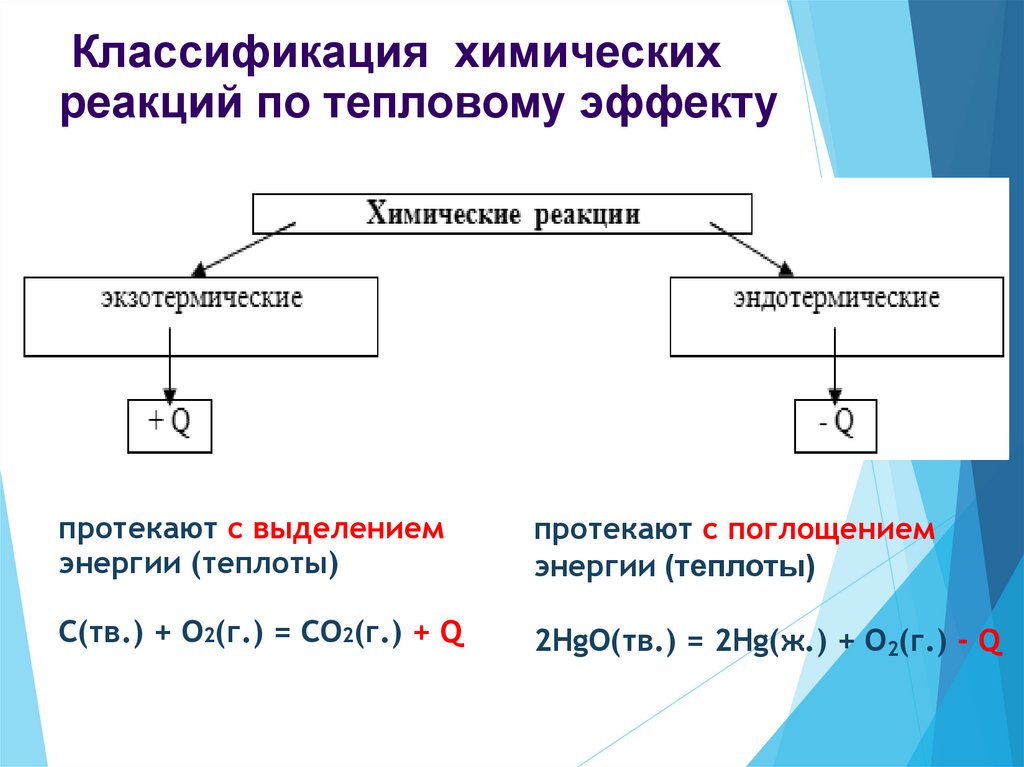
Классификация химическихреакций по тепловому эффекту
протекают с выделением
энергии (теплоты)
протекают с поглощением
энергии (теплоты)
C(тв.) + O2(г.) = CO2(г.) + Q
2HgO(тв.) = 2Hg(ж.) + O2(г.) - Q
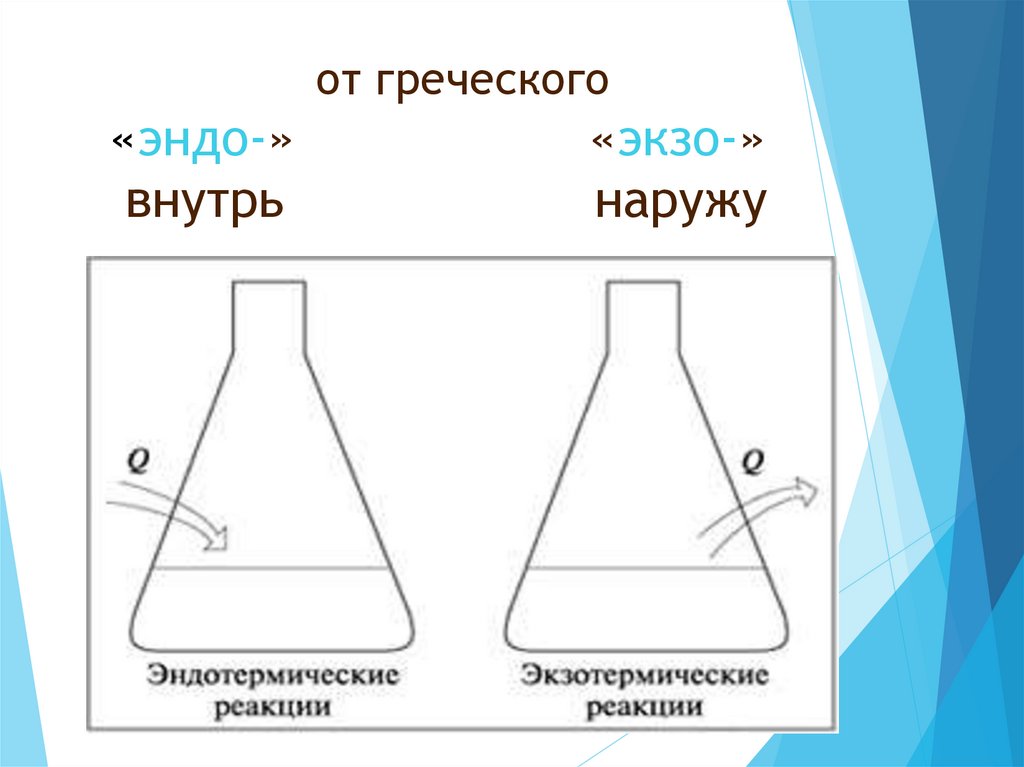
5. от греческого «эндо-» «экзо-» внутрь наружу
от греческого«эндо-»
внутрь
«экзо-»
наружу
6.
Количество теплоты, которое выделяется или поглощается прихимической реакции, называют тепловым эффектом реакции.
Тепловой эффект обозначается Q и измеряется в Дж или кДж.
Термохимическое уравнение - это уравнение химической реакции,
в котором указан тепловой эффект.
7.
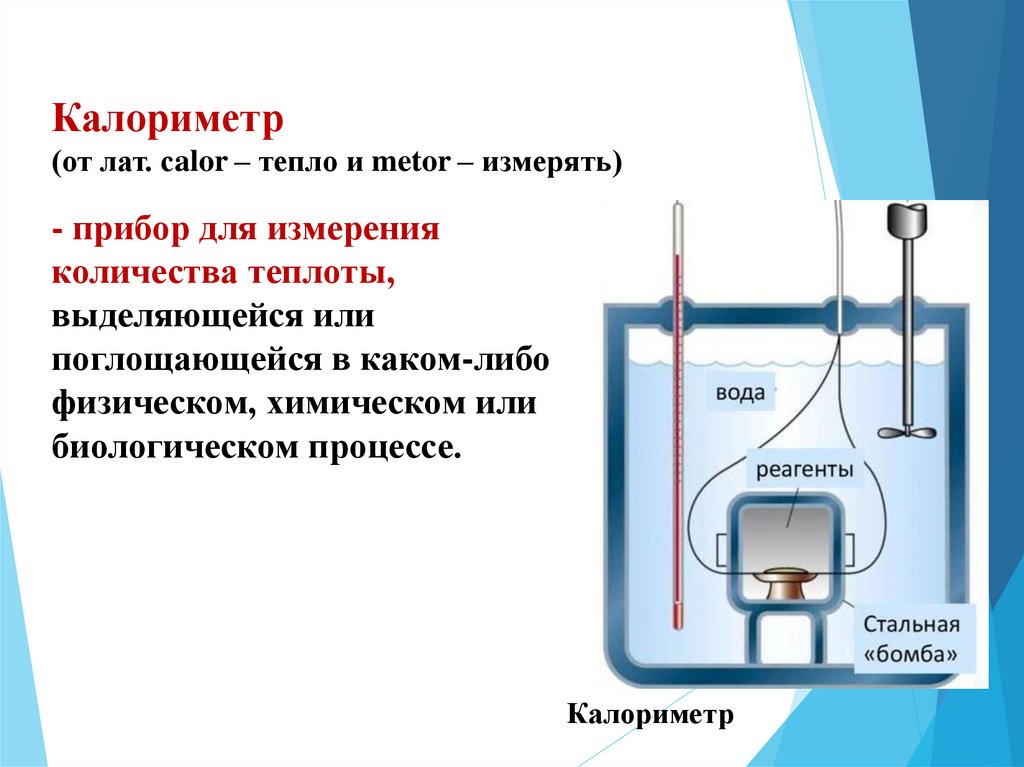
Калориметр(от лат. сalor – тепло и metor – измерять)
- прибор для измерения
количества теплоты,
выделяющейся или
поглощающейся в каком-либо
физическом, химическом или
биологическом процессе.
Калориметр
8.
Расчёты по термохимическим уравнениям (ТХУ)1. По термохимическому уравнению 2Cu + O2 = 2CuO + 310 кДж
вычислите количество теплоты, выделившейся в результате
окисления 4 моль меди.
2. По термохимическому уравнению С + O2 = CO2 + 412 кДж
вычислите количество теплоты, выделившейся в результате
окисления угля кислородом, объём которого равен 44,8 л при н.у.
3. При сжигании магния массой 3г выделяется 75,15кДж теплоты.
Составьте термохимическое уравнение реакции горения магния.
9.
В химической промышленноститепловые эффекты нужны для расчета
количества теплоты для нагревания
реакторов, в которых идут
эндотермические реакции.
В энергетике с помощью теплоты
сгорания топлива рассчитывают
выработку тепловой энергии.
§
Врачи-диетологи используют тепловые
эффекты окисления пищевых продуктов в
организме для составления правильных
рационов питания не только для больных,
но и для здоровых людей - спортсменов,
работников раз-личных профессий. По
традиции для расчетов здесь используют не
джоули, а другие энергетические единицы калории (1 кал = 4,1868 Дж).
10.
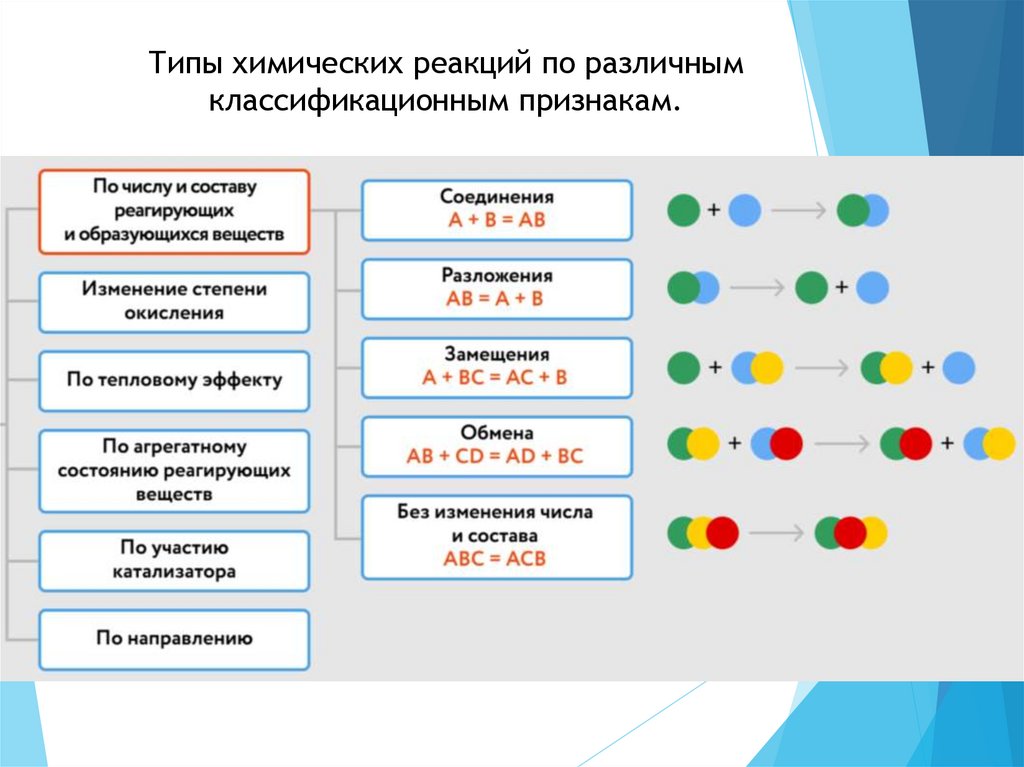
Типы химических реакций по различнымклассификационным признакам.





 Химия
Химия








