Похожие презентации:
Основные виды химической связи
1.
ОСНОВНЫЕ ВИДЫХИМИЧЕСКОЙ СВЯЗИ
ПОЛЯРНАЯ И НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
2.
Важно:При образовании химических соединений
атомы химических элементов стремятся
приобрести
устойчивую
конфигурацию
внешнего электронного слоя (из двух или
восьми
электронов),
как
в
атомах
благородных газов.
3.
Химическая связьИонная
Ковалентная
Металлическая
связь между ионами
связь между
атомами за счёт
образования общих
электронных пар
связь между атомами
элементов металлов
Химическая связь — это связь между атомами в
соединениях с помощью электронов, входящих в
состав атомов.
4.
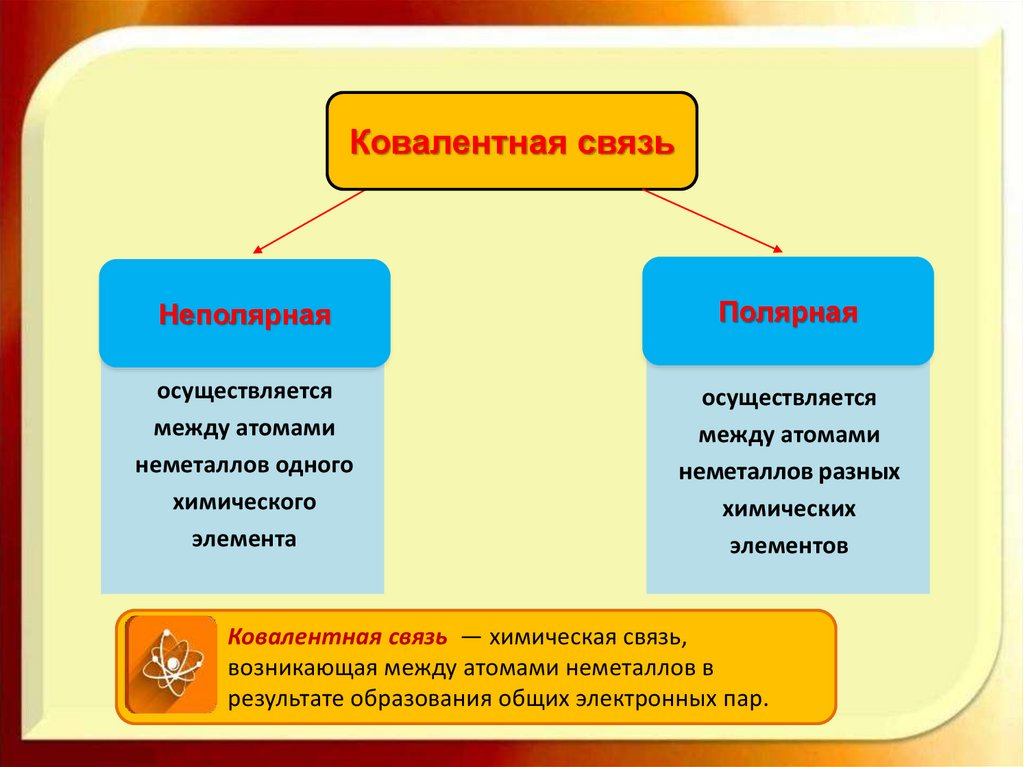
Ковалентная связьНеполярная
Полярная
осуществляется
между атомами
неметаллов одного
химического
элемента
осуществляется
между атомами
неметаллов разных
химических
элементов
Ковалентная связь — химическая связь,
возникающая между атомами неметаллов в
результате образования общих электронных пар.
5.
H1S1
+1
Рассмотрим образование
молекулы водорода – Н2
1
+
Ядро
Электрон
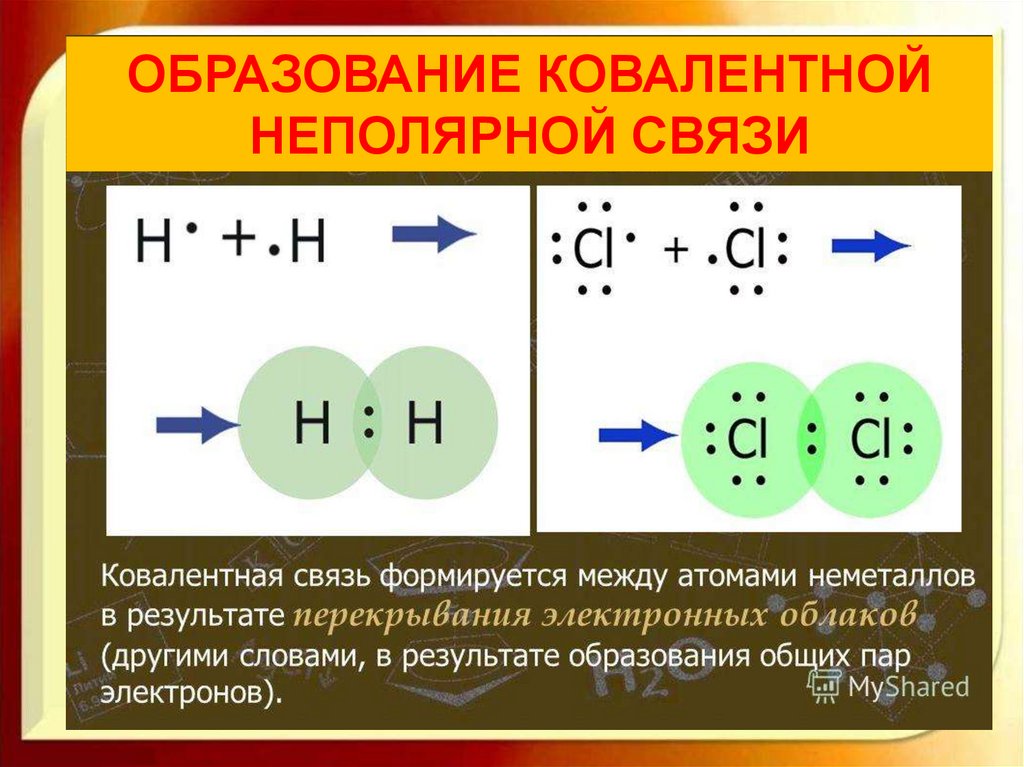
Ковалентная неполярная связь образуется между
одинаковыми атомами элементов-неметаллов
6.
ОБРАЗОВАНИЕ КОВАЛЕНТНОЙНЕПОЛЯРНОЙ СВЯЗИ
7.
8.
Ковалентнаясвязь
Одинарная
Двойная
в молекуле водорода H2
в молекуле кислорода O2
Тройная
в молекуле азота N2
Н∙ + ∙Н → Н : Н
O
Н-Н
Структурная формула
+
O
О=О
1S2
→
O O
Общая
электронная
пара
2S2 2p4
N
+
N
→
N N
N≡N
1S2 2S2 2p3
9.
Ковалентная полярная связьэто связь, которая образуется между атомами
разных элементов-неметаллов
Электроотрицательность — это
способность атомов химического
элемента смещать к себе общие
электронные пары, участвующие в
образовании химической
связи.
-
10.
Ряд электроотрицательности (ЭО)H →P → Si → C → S → I →Br → Cl → N →O →F
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УВЕЛИЧИВАЕТСЯ
С увеличением электроотрицательности (ЭО) увеличивается
способность атома смещать общую электронную пару ближе к
своему ядру.
11.
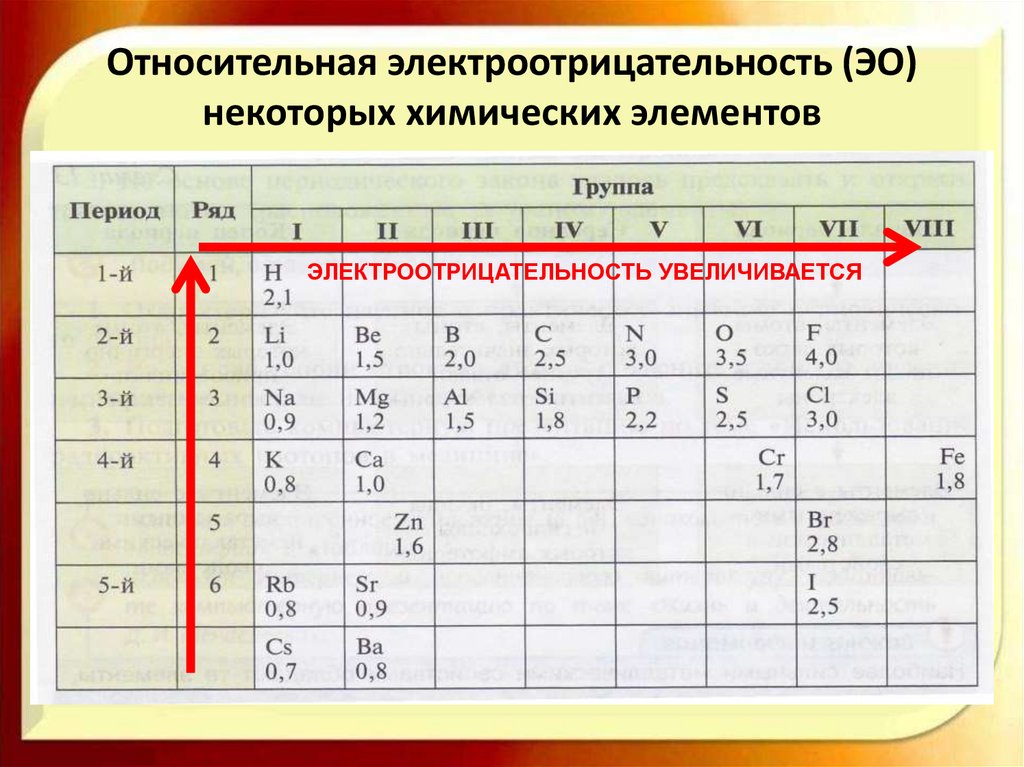
Относительная электроотрицательность (ЭО)некоторых химических элементов
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УВЕЛИЧИВАЕТСЯ
12.
Молекула фтороводородаH
Н F
F
1S2 2S2 2p5
1S1
Неспаренный электрон
Неспаренный электрон
H
F
13.
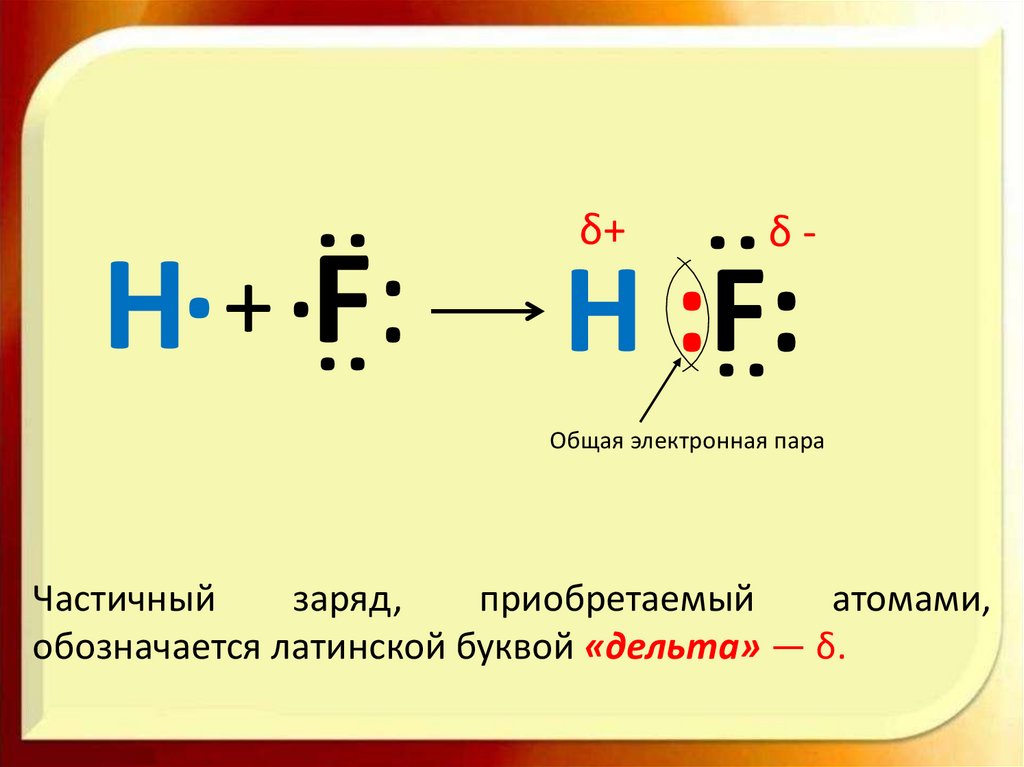
:δ-
H :F:
:
:
:
.
.
H + F:
δ+
Общая электронная пара
Частичный
заряд,
приобретаемый
атомами,
обозначается латинской буквой «дельта» — δ.
14.
15.
ПРОВЕРЬ СЕБЯИз ряда соединений:
F2, NH3, H2O, Br2, NaCl, CO2, Cu
выпишите формулы веществ с
1. Ковалентной неполярной связью
2. Ковалентной полярной связью











 Химия
Химия








