Похожие презентации:
Химическая связь
1.
—+
+
Электроны
—
+
—
Химическая связь — это связь между
атомами, осуществляемая в молекулах и
кристаллах вещества с помощью энергии
электронов, входящих в состав атомов.
2.
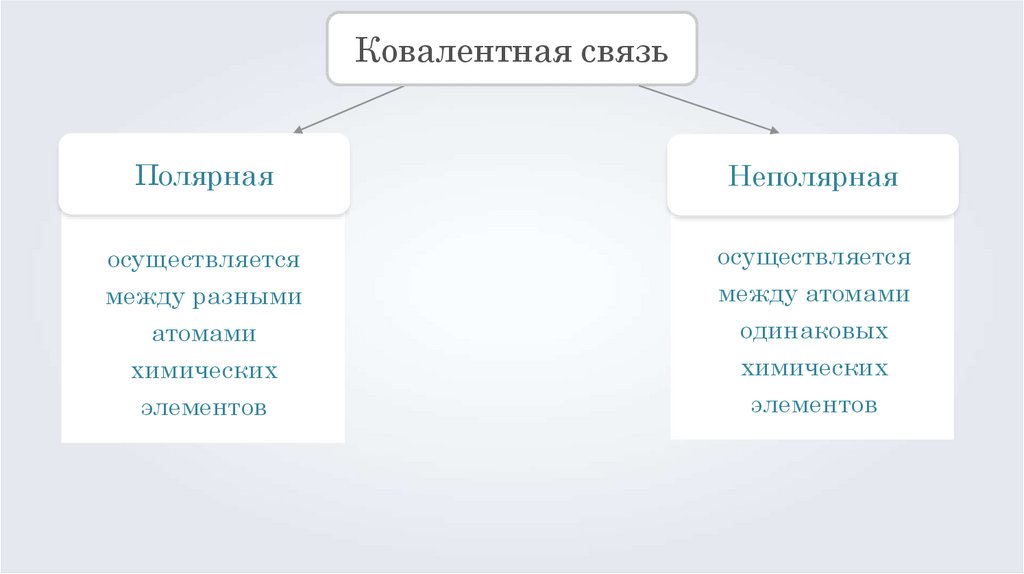
Химическая связьИонная
Ковалентная
Металлическая
связь между
ионами
связь между
атомами за счёт
общих
электронных пар
связь между
атомами
элементов
металлов
3.
Ковалентная связь — химическая связь,возникающая в результате образования
общих электронных пар.
4.
Ковалентная связьПолярная
Неполярная
осуществляется
между разными
атомами
химических
элементов
осуществляется
между атомами
одинаковых
химических
элементов
5.
Молекула водородаКовалентная неполярная связь образуется между
одинаковыми атомами элементов-неметаллов,
6.
НFфтороводород
Полярная ковалентная связь может образовываться
только между атомами разных элементов-неметаллов.
7.
Молекула фторводорода1
H
1S1
9
F
Неспаренный электрон
1S2 / 2S2 2p5
Неспаренный электрон
H
F
8.
H+
F
→ H
F
Общая электронная пара
9.
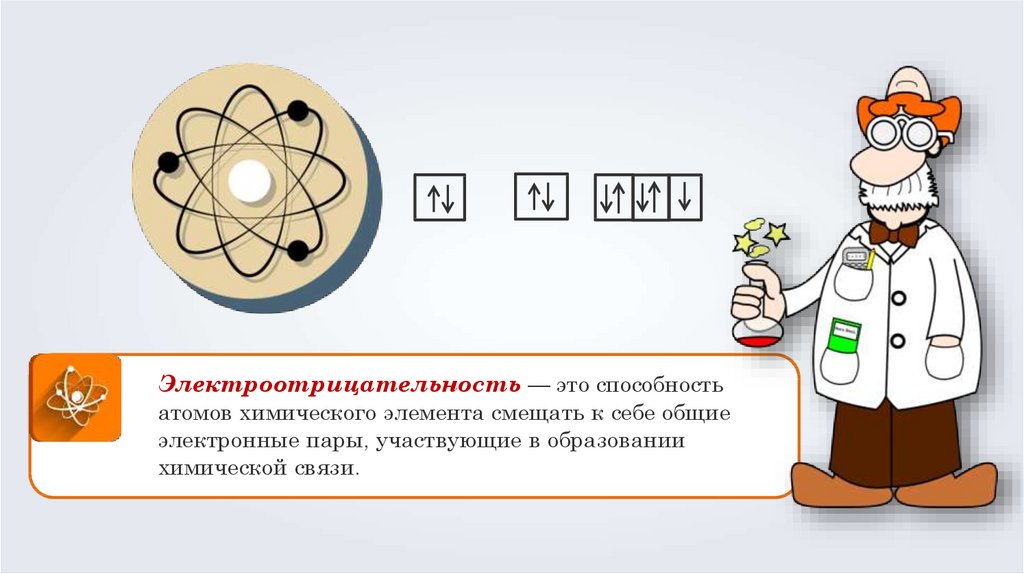
Электроотрицательность — это способностьатомов химического элемента смещать к себе общие
электронные пары, участвующие в образовании
химической связи.
10.
Ряд химических элементов, расположенных в соответствии суменьшением их электроотрицательности
F→ O→ N → CI → Br → I → S → C → Si →P → H
С уменьшением электроотрицательности уменьшаются и
способность атома смещать общую электронную пару ближе к
своему ядру.
11.
H+
F
→ H
F
Общая электронная пара
F→ O→ N → CI → Br → I → S → C → Si →P → H
12.
H+
F
+
→ H
F
-
Смещённая электронная пара
Частичный заряд, приобретаемый атомами,
обозначается латинской буквой «дельта» — δ.
13.
Смещение электроотрицательности вмолекулах воды Н2О и оксида азота NO
δ+
Н2О
2H + O
→
H
δ+
H
δ+
NO
δ-
N →O
δ-
O
14.
Алгоритм образования ковалентной полярнойна примере оксида серы SO2
O
1. Запись электронных формул
кислорода и серы.
S
(кислород)
+1
+16
2 6
Внешний энергетический уровень
O8
(сера)
1S2 / 2S2 2p4
2 86
S16
Внешний энергетический уровень
1S2 / 2S2 2p6
/ 3S2
3p4
15.
Алгоритм образования ковалентной полярнойна примере оксида серы SO2
2. Изображение расположения внешних электронов у
знаков химических элементов кислорода и серы.
O
S
16.
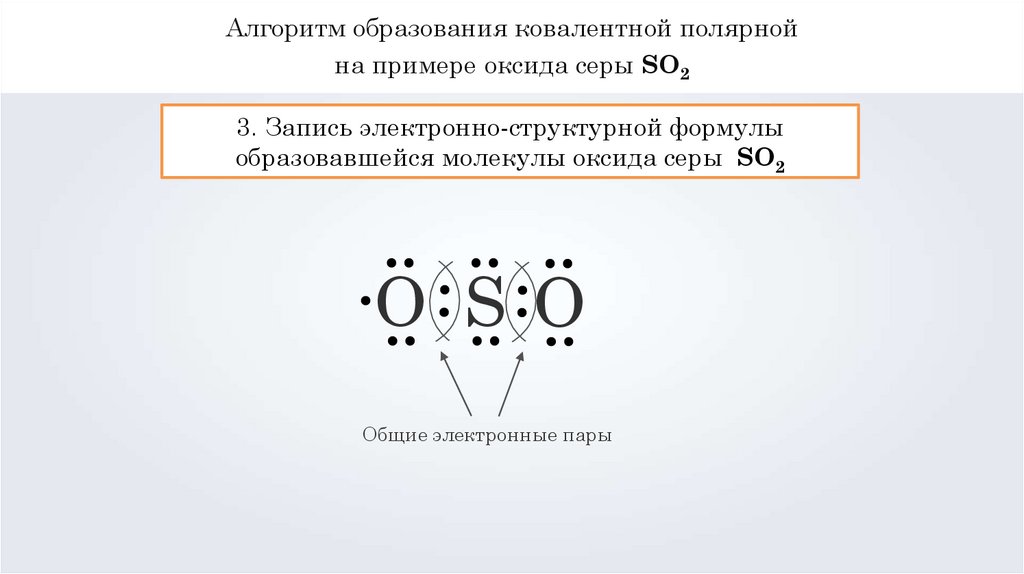
Алгоритм образования ковалентной полярнойна примере оксида серы SO2
3. Запись электронно-структурной формулы
образовавшейся молекулы оксида серы SO2
O SO
Общие электронные пары
17.
Алгоритм образования ковалентной полярнойна примере оксида серы SO2
3. Определение по рассмотренному нами ранее химическому
ряду электроотрицательности кислорода и серы
F→ O→ N → CI → Br → I → S → C → Si →P → H
δ+
O→S
δ-
→
δ-
O
18.
O SOВалентность — это число ковалентных связей,
которыми атом одного химического элемента связан
с атомами этого же или других элементов.
19.
Запись валентностиАммиак
NH3
NIIIHI
Вода
H2O
HIOII
Оксид фосфора P2O5
PVOII
Валентность
20.
Оксид серы SVIOIIS2O6
Сульфид железа FIISII
Оксид свинца PlVIOII
SO3
F2S2
Pl2O4
FS
PlO2
F2S2
Если валентность обоих элементов кратна какому-нибудь
числу, то индексы записываются, уменьшенными на это
число.
21.
AlIII
Al2O3
Оксид алюминия
S
II
S
IV S VI
SO2
Оксид серы
22.
? IIIV
SO2
II
×
2=4
4:1=4
По формуле также можно определить
валентность одного элемента, если валентность
другого известна.
23.
δ-N→O
N
O
Одна ковалентная связь
δ+
δ-
O→N
O
δ-
→
δ+
N
O
O
Две ковалентные связи
Валентность, равная общему числу ковалентных связей,
может быть различной у одного и того же элемента.




















 Химия
Химия








