Похожие презентации:
Диссоциация кислот, щелочей и солей
1.
Упражнение стр. 145Сильные
электролиты
Н2SO4 MgSO4
CaCl2
NaOH K3PO4
Cлабые
Слабые
электролиты
электролиты=
неэлектролиты
Неэлектролиты
CH3COOH
H2SiO3
Mg(OH)2 H2O
2.
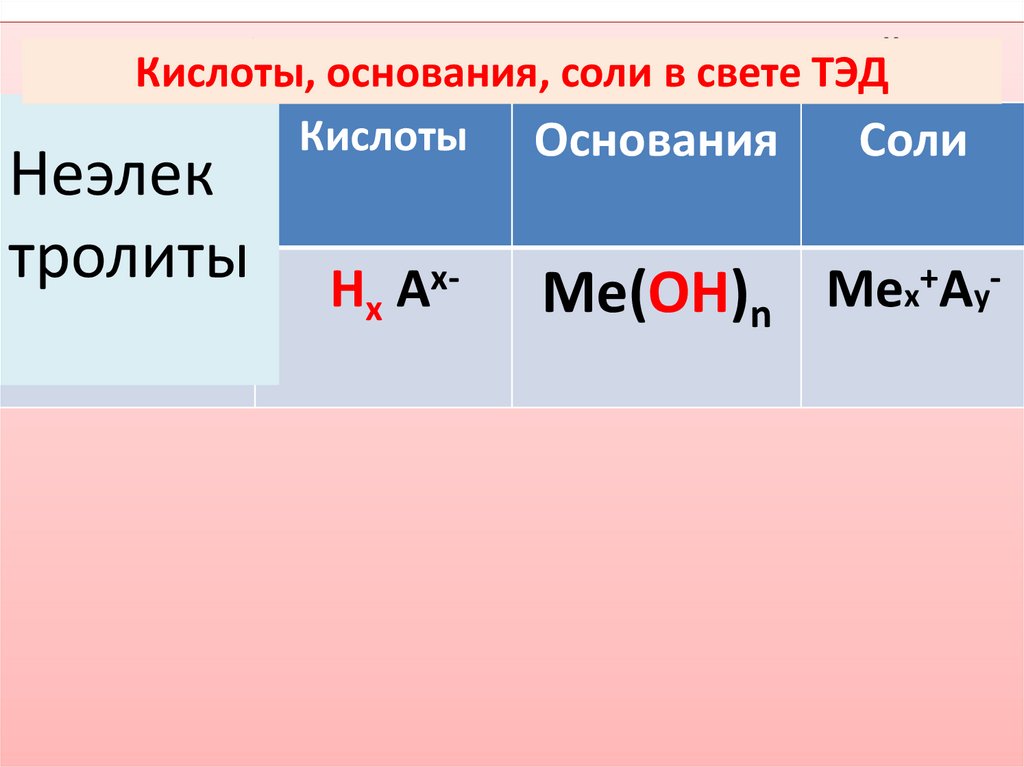
Классификация неорганических соединенийКислоты, основания, соли в свете ТЭД
Кислоты Основания
Оксиды
Соли
Неэлек
тролиты
-2
ЭхОу
Нх Ах-
Ме(ОН)n
Мех+Ау-
3.
1 Диссоциация кислотр
НBr = Н+ + Br–
р
Н2SO4 = 2Н+ + SO42–
н
Н2СO3 #
н
Н2S #
Кислоты – это электролиты, состоящие из
катионов водорода (Н+) и анионов кислотного
остатка.
Общее для всех кислот - катионы водорода
Стр.147
4.
1 Диссоциация основанийн
р
Al(OH)3 #
LiOH = Li+ + OH–
н
р
Ca(OH)2= Ca2+ + 2OH– Cu(OH)2 #
Основания – это электролиты (10), состоящие из
катионов металлов и гидроксид- ионов (ОН–).
Общее для всех оснований(щелочей!) гидроксид- ионы
Стр.148
5.
1 Диссоциация солейн
р
NaNO3 = Na+ + NO3– Li3PO4 #
н
р
CaCO3 #
K2SO4 = 2K+ + SO42–
Cоли – это электролиты, состоящие из катионов
металлов и анионов кислотных остатков.
Общих ионов у солей нет
Стр.150
6.
Домашнее задание:§ 40, упр 1 (сильные электролиты и
неэлектролиты)
§ 41 упр 1 (средние соли , кислые – по
желанию)
7.
КHSO4К
Н
Диссоциация кислых солей
О
О
О
S
О
КHSO4 =К+ + HSO4
8.
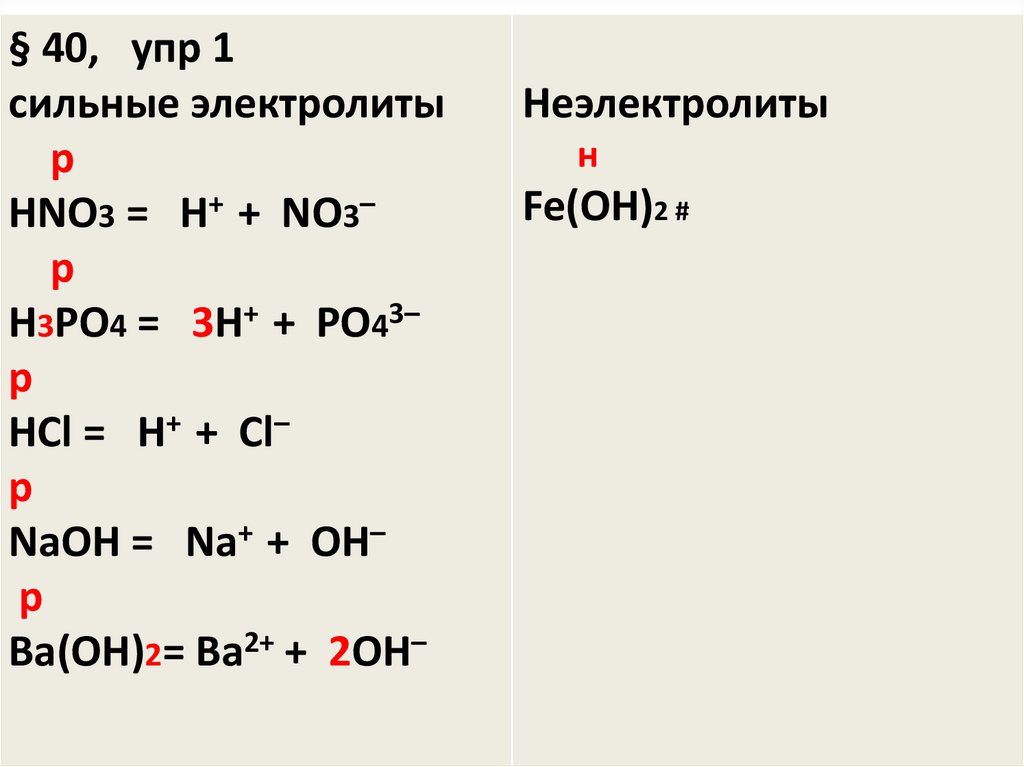
§ 40, упр 1сильные электролиты
р
НNO3 = Н+ + NO3–
р
Н3PO4 = 3Н+ + PO43–
р
НCl = Н+ + Cl–
р
NaOH = Na+ + OH–
р
Ba(OH)2= Ba2+ + 2OH–
Неэлектролиты
н
Fe(OH)2 #
9.
§ 41, упр 1Средние соли
Кислые соли
р
AlCl3 = Al3+ + 3Cl–
KHS
р
NaHSO4
K3PO4 = 3K+ + PO43–
р
Fe2(SO4)3= 2Fe3+ + 3SO42–
10.
Ответы к «Теории электролитической диссоциации»1
г
2
б
3
в
4
в
5
а
6
7
8
9
10
в
г
б
г
в
11
12
13
14
15
в
б
г
г
г
16
17
18
19
20
в
б
г
в
в
21 в








 Химия
Химия








