Похожие презентации:
Уравнение диссоциации
1.
Электролиты(по способности распадаться на ионы)
Сильные
( 1)
Слабые ( 0)
1. Все соли (р)—и.с.
2. Все щелочи (10)- и.с.
3. Сильные кислоты
Выучить!
2 Слабое основание NH4OH
3. Слабые кислоты
Выучить!
HCl HBr HI HNO3
H2SO4
HF HNO2
H2S H2SO3 H2CO3 H2SiO3
H3PO4
Все органические
CH3COOH- уксусная
2.
Составить уравнение диссоциации электролитов.Алгоритм:
1. По табл. растворимости проверить, будет ли вещество
электролитом( если р- распадается на ионы,
если н – не распадается).
2. В левой части записать формулу электролита,
в правой – те ионы, на какие он распадается в растворе
( из каких состоит)
3. Ионы- заряженные частицы, укажите их заряд!
(см. таблицу!)
4. Уравняйте число частиц слева и справа,
проверьте сумму зарядов (она должна быть = 0)
Вариант 1
Вариант 2
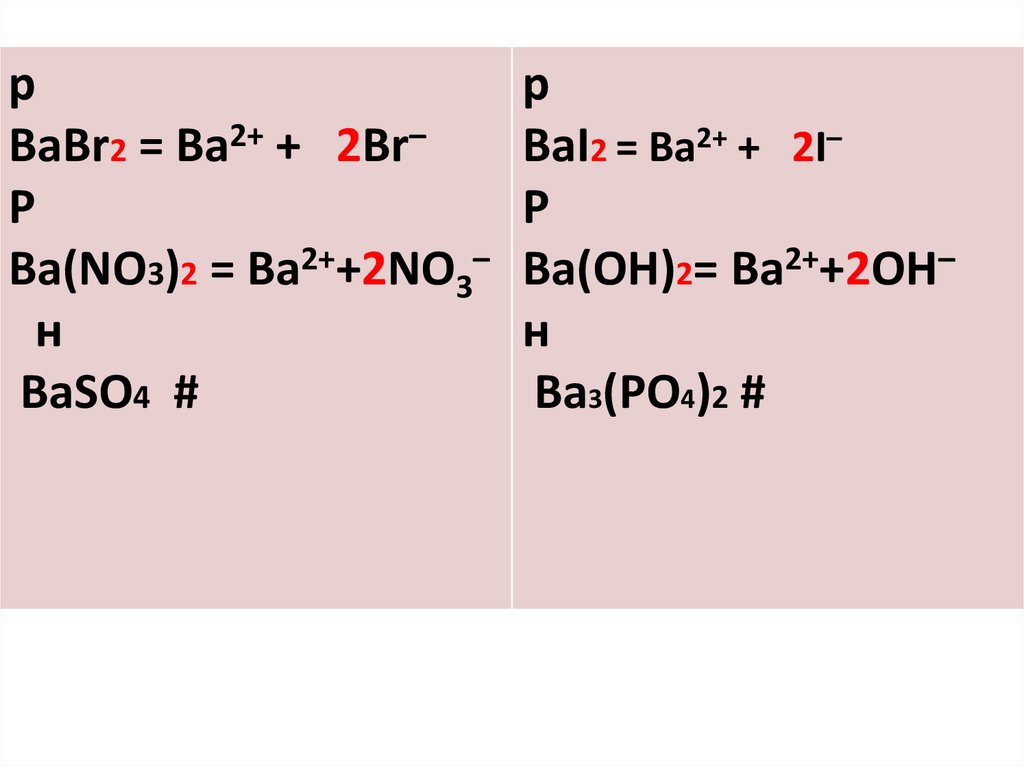
ВаBr2 Ba(NO3)2 BaSO4
ВаI2 Ba(OH)2 Ba3(PO4)2
3.
рВаBr2 = Ba2+ + 2Br–
Р
Ba(NO3)2 = Ba2++2NO3–
н
BaSO4 #
р
ВаI2 = Ba2+ + 2I–
Р
Ba(OH)2= Ba2++2OH–
н
Ba3(PO4)2 #
4.
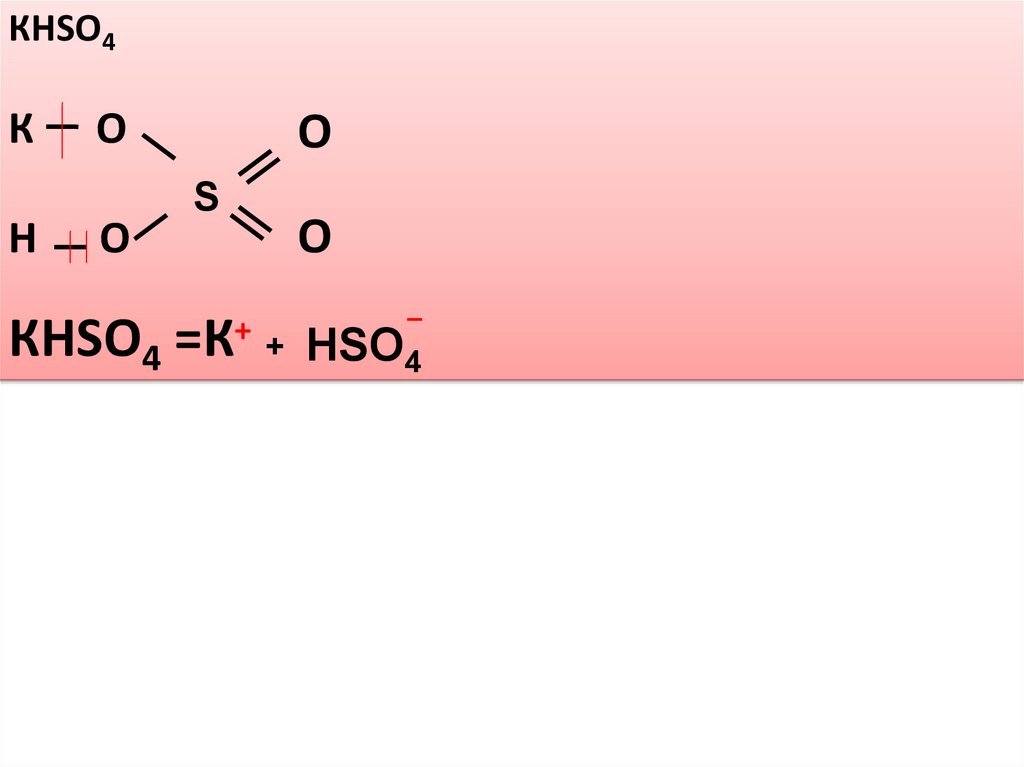
КHSO4К
Н
О
О
О
S
О
КHSO4 =К+ + HSO4
_
5.
6.
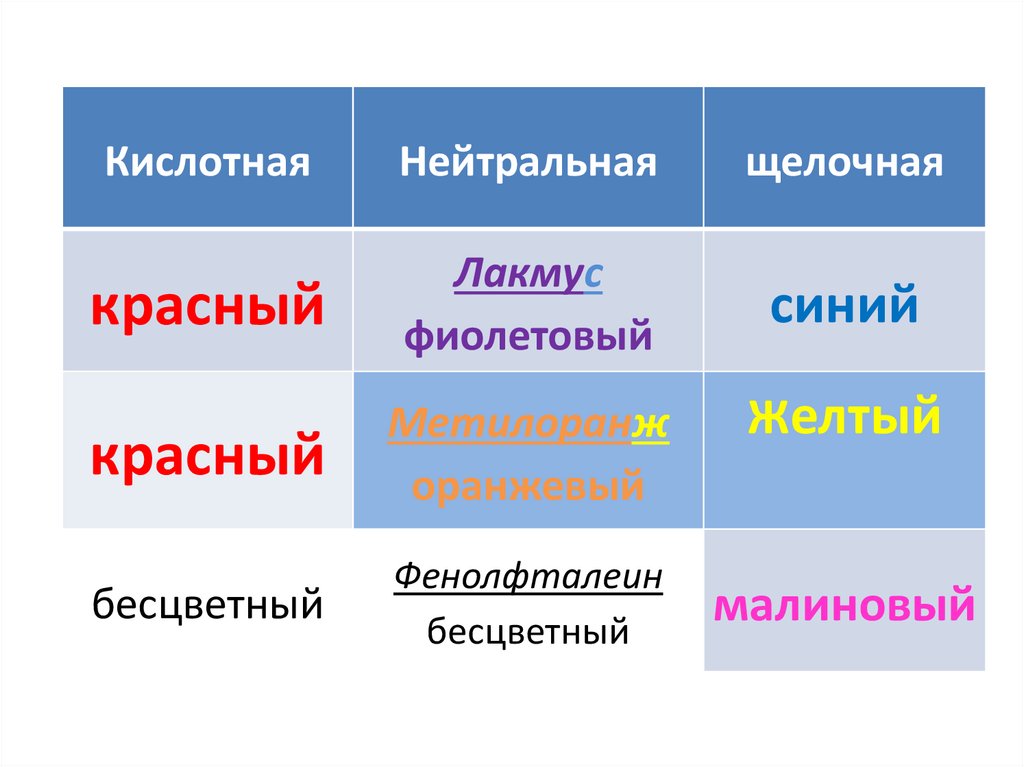
КислотнаяНейтральная
щелочная
красный
Лакмус
фиолетовый
синий
красный
Метилоранж
оранжевый
бесцветный
Фенолфталеин
бесцветный
Желтый
малиновый
7.
Ответы к «Теории …»1- г
2–б 3- в
4 -в
5–а
6-в
7- г
8- б
9- г
11- в
12- б
13 – г
14 – г
15 – г
16- в
17-б
18- г
19 – в
20 – в
21 – в
10 – в



 Химия
Химия








