Похожие презентации:
Электролитическая диссоциация
1. Электролитическая диссоциация
2. Электролитическая диссоциация
• это процесс распада электролита наионы в растворе или расплаве.
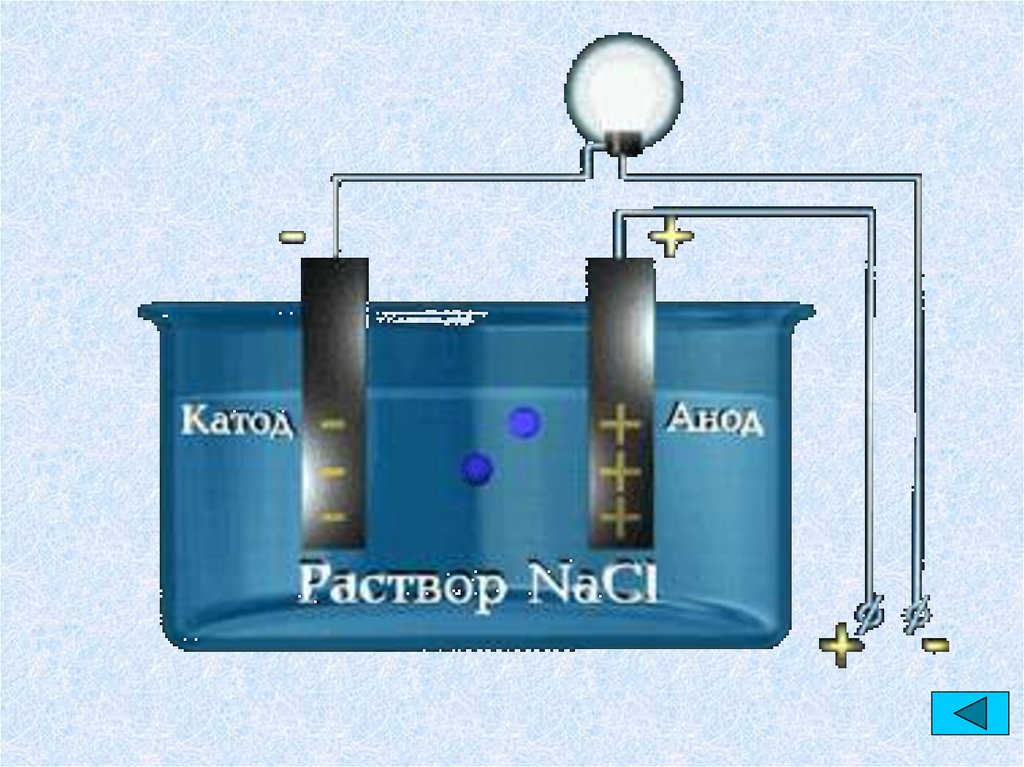
3. ОПЫТЫ МАЙКЛА ФАРАДЕЯ
Разложение веществпод действием
электрического тока
Ввел понятия:
• Электролиз;
• Электрод;
• Катод;
• Анод;
• Ион.
4. НЕЭЛЕКТРОЛИТЫ – вещества водные растворы или расплавы которых не проводят электрический ток (под действием растворителя
вещество переходит враствор в виде молекул, т.е. сохраняет
молекулярную структуру),
примеры:
простые вещества, органические
вещества
5. ЭЛЕКТРОЛИТЫ – вещества водные растворы или расплавы которых проводят электрический ток (следовательно, в растворах электролитов
имеются заряженные частицы,участвующие в переносе электрического
заряда от одного электрода к другому),
примеры:
соли, кислоты, основания
Электролитами могут быть
только вещества с ионной
или ковалентной полярной
связью
6. ЭЛЕКТРОЛИТЫ
• Под действием электрического токаположительно заряженные ионы
движутся к отрицательному полюсу –
катоду (катионы), отрицательно
заряженные ионы к положительному
полюсу - аноду (анионы).
7.
8. ХИМИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ Д.И. МЕНДЕЛЕЕВА
Химическое взаимодействиемежду растворяемым веществом
и растворителем.
Каждая молекула окружена
молекулами воды (гидратной
оболочкой)
Образующиеся соединения гидраты
9. ФИЗИЧЕСКАЯ ТЕОРИЯ СВАНТЕ АРРЕНИУСА
Шведский физико-химик –1887 год
Электролиты
распадаются на
ионы в момент
растворения их в
воде
СаCl2 = Ca2+ + 2ClHNO3 = H+ + NO3-
10. 1 моль HCl «разбросать» на ионы потребуется 1377 кДж энергии 1 моль NaCl подобная операция требует 750 кДж энергии
11. ФИЗИКО – ХИМИЧЕСКАЯ ТЕОРИЯ И.А. КАБЛУКОВА и В.А. КИСТЯКОВСКОГО
1. Ориентация молекул воды вокруг ионовили молекул растворяемого вещества.
2. Гидратация молекул воды с ионами или
молекулами (химическое взаимодействие).
3. Ионизация молекул с ковалентной
полярной связью, то есть превращение в
соединения с ионной связью.
4. Диссоциация молекул или кристаллов на
гидратированные ионы.
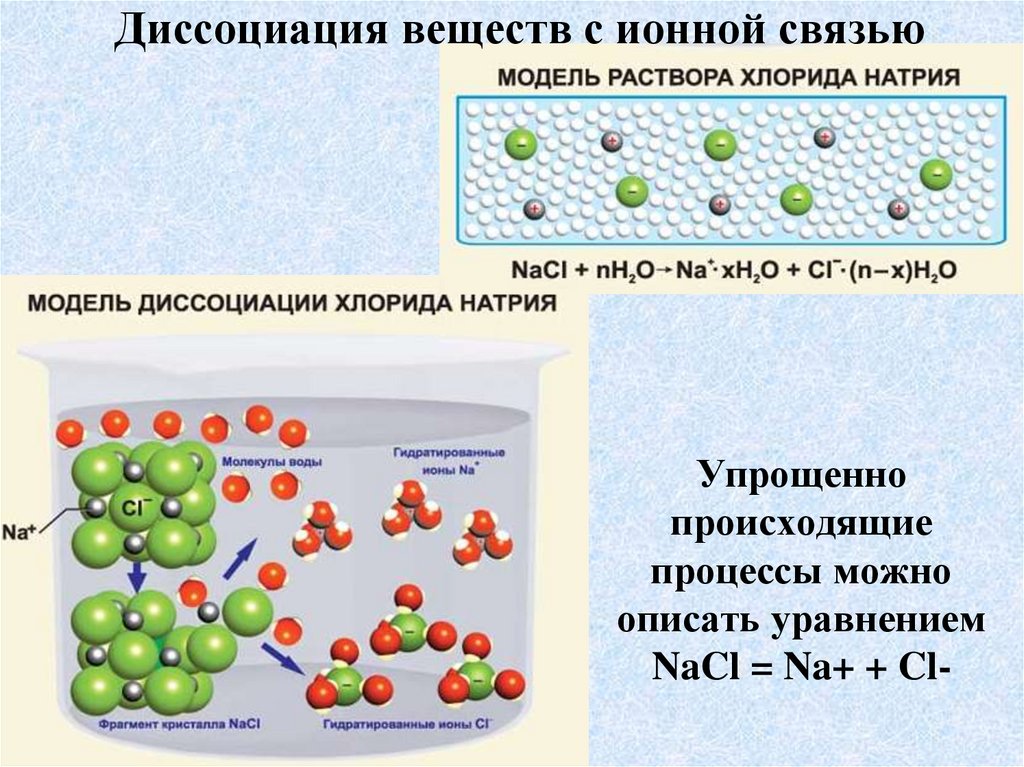
12. Упрощенно происходящие процессы можно описать уравнением NaCl = Na+ + Cl-
Диссоциация веществ с ионной связьюУпрощенно
происходящие
процессы можно
описать уравнением
NaCl = Na+ + Cl-
13. Диссоциация ионных соединений
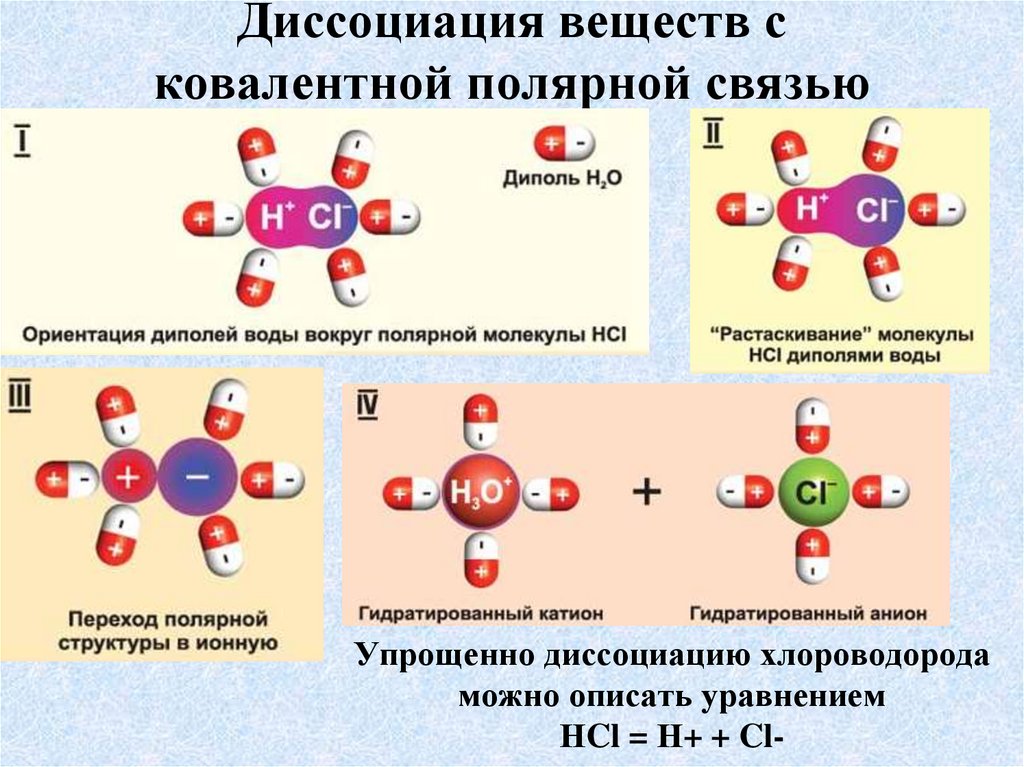
14. Диссоциация веществ с ковалентной полярной связью
Упрощенно диссоциацию хлороводородаможно описать уравнением
НCl = Н+ + Cl-
15. Диссоциация соединений с ковалентной полярной связью
16. Напишите уравнения электролитической диссоциации следующих веществ: гидроксида натрия, серной кислоты, нитрата калия, хлорида
магния,сульфата алюминия.
17. В растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот
обратный процесс называютассоциацией.
18. Классификация ионов
1. По заряду:-) Катионы (+):
Na+; H+; NH4+; PH4+; H3O+
-) Анионы (-):
Сl¯; ОН¯; SO42-; PO432. По сложности
-) Простые:
Na+; H+; Сl¯
-) Сложные:
NH4+; ОН¯; SO423. По гидратированности
-) Гидратированные:
Cu2+ · 4H2O (синие)
-) Негидратированные: Сu2+ (бесцветные)
19. Ионы
20. Степень электролитической диссоциации
Отношение числа молекул электролитараспавшегося на ионы, к общему числу
растворенных молекул
Число молекул , распавшихся на ионы
Общее число растворённых молекул
n
100%
N
21. ЭЛЕКТРОЛИТЫ:
СИЛЬНЫЕα > 30%
Растворимые соли (например, NaCl);
неорганические кислоты (HNO3,
HClO4, H2SO4, HCl, НBr, HI);
щелочи (NaOH, Ba(OH)2 и т.д.)
СРЕДНИЕ
α от 3 до 30%
HF; H3PO4; H2SO3
СЛАБЫЕ
α < 3%
Органические кислоты (например,
CH3COOH); многие неорганические
кислоты (H2CO3, HNO2, Н2S, HCN,
H3BO3, HClO, HClO2), гидрат
аммиака NH3*H2O (слабое основание
NH4OН), вода
22.
НеэлектролитСН3ОН
сильный
электролит
слабый
электролит
23. ЭЛЕКТРОЛИТЫ
24. Сильные электролиты диссоциируют необратимо, например: HNO3 = H+ + NO3- Слабые электролиты диссоциируют обратимо, например:
Сильные электролиты диссоциируютнеобратимо, например:
HNO3 = H+ + NO3Слабые электролиты диссоциируют
обратимо, например:
HNO2 ↔ H+ + NO2-
25. КОНСТАНТА ДИССОЦИАЦИИ
Кд характеризует способность слабогоэлектролита диссоциировать на ионы
[CH 3COO ] [ H ]
KД
2 10 5
[CH 3COOH ]
26. СТУПЕНЧАТАЯ ДИССОЦИАЦИЯ H3PO4
I ступень:H3PO4 → Н+ + H2PO4–
II ступень:
H2PO4–
Н+ + HPO42–
III ступень:
HPO42 –
Н+ + PO43–
27. Напишите уравнения ступенчатой диссоциации следующих веществ: а) H2SO4, б) Al(OH)3
I ступень:II ступень:
III ступень:
28. Степень электролитической диссоциации зависит от ряда факторов.
1. Природа электролита.2. Природа растворителя.
3. Температура.
4. Концентрация электролита в растворе.
29. ДИССОЦИАЦИЯ ВОДЫ
2H2O H3O+ + OH¯упрощённо:
H2O H+ + OH¯
30. ТИП СРЕДЫ
[H+] = [OH¯] – нейтральная среда[H+] > [OH¯] – кислая среда
[H+] < [OH¯] – щелочная среда
31. pH – водородный показатель
ОТРИЦАТЕЛЬНЫЙ ДЕСЯТИЧНЫЙЛОГАРИФМ КОНЦЕНТРАЦИИ
ИОНОВ ВОДОРОДА
32. рОН – гидроксильный показатель
ОТРИЦАТЕЛЬНЫЙ ДЕСЯТИЧНЫЙЛОГАРИФМ КОНЦЕНТРАЦИИ
ГИДРОКСИД ИОНОВ
33. pH + pOH = 14
34. Среда водных растворов
35.
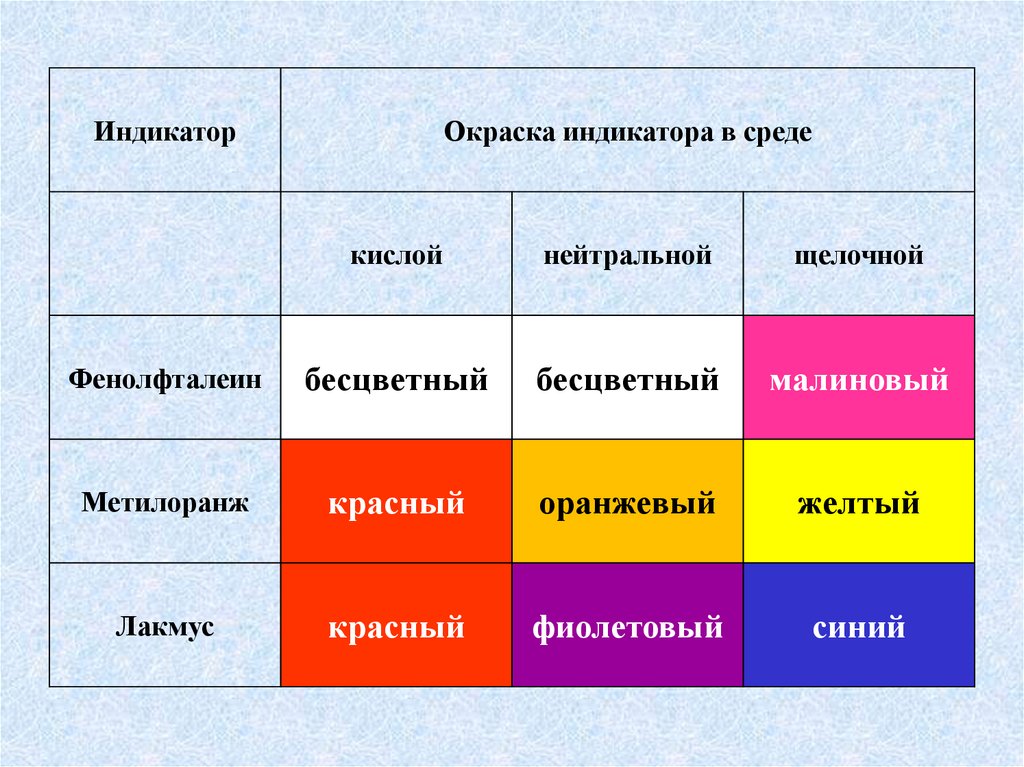
ИндикаторОкраска индикатора в среде
кислой
нейтральной
щелочной
Фенолфталеин
бесцветный
бесцветный
малиновый
Метилоранж
красный
оранжевый
желтый
Лакмус
красный
фиолетовый
синий
36.
37.
38. Ионные уравнения реакций
Если в растворе присутствует несколькоэлектролитов, то между ними могут
протекать реакции. Эти реакции идут
до конца, только если в результате
общее число ионов в растворе
уменьшается.
Связывание
ионов
происходит в трех случаях: а)
образование осадка, б) выделение газа,
в) образование слабого электролита.
39. Примеры
а) Образование осадкаBaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Полное ионное уравнение получается из
молекулярного путем разложения всех сильных
электролитов на ионы:
Ba+2 + 2Cl- + 2Na+ + SO4-2 = BaSO4↓ +
2Na+ + 2ClСокращенное ионное уравнение получается из
полного путем удаления одинаковых ионов из
левой и правой частей уравнения:
Ba+2 + SO4-2 = BaSO4↓
Сокращенное ионное уравнение показывает,
между какими реальными частицами в растворе
протекает ионная реакция.
40. Примеры
б) Выделение газа:K2CO3 + 2HCl = 2KCl + CO2 + H2O
Полное ионное уравнение получается из
молекулярного путем разложения всех сильных
электролитов на ионы:
Сокращенное ионное уравнение получается из
полного путем удаления одинаковых ионов из
левой и правой частей уравнения:
Сокращенное ионное уравнение показывает,
между какими реальными частицами в растворе
протекает ионная реакция.
41. Примеры
в) Образование слабых электролитов – воды илислабых кислот:
HCl + NaOH = NaCl + H2O
Полное ионное уравнение получается из
молекулярного путем разложения всех сильных
электролитов на ионы:
Сокращенное ионное уравнение получается из
полного путем удаления одинаковых ионов из
левой и правой частей уравнения:
Сокращенное ионное уравнение показывает,
между какими реальными частицами в растворе
протекает ионная реакция.
42. Примеры
в) Образование слабых электролитов – воды илислабых кислот (продолжение):
2KF + H2SO4 = K2SO4 + 2HF
Полное ионное уравнение получается из
молекулярного путем разложения всех сильных
электролитов на ионы:
Сокращенное ионное уравнение получается из
полного путем удаления одинаковых ионов из
левой и правой частей уравнения:
Сокращенное ионное уравнение показывает,
между какими реальными частицами в растворе
протекает ионная реакция.
43. Примеры
Аналогичная реакция в водном растворе междуKCl и H2SO4 не идет, так как HCl сильная кислота.
Для реакции
2K+ + 2Cl- + 2H+ + SO4-2 = 2K+ + SO4-2 +
2H + 2Clсокращенное ионное уравнение имеет вид: 0=0.
Это означает, что реакция не идет, поскольку
ионы друг с другом не связываются.
44. Напишите полные ионные и сокращенные ионные уравнения следующих реакций:
2NaOH + H2SO4 = Na2SO4 + 2H2OBa(NO3)2 + FeSO4 = BaSO4↓ + Fe(NO3)2








































 Химия
Химия








