Похожие презентации:
Состав и важнейшие характеристики атома
1.
Состав и важнейшиехарактеристики
атома.
2.
• Уильям Крукс –английский физик и
химик. В 1879 году
открыл катодные лучи,
представляющие собой
поток мельчайших
быстролетящих
отрицательно заряженных
частиц.
• Джорж Стони ирландский физик и
математик. В 1891 году
предложил назвать
открытые Круксом
частицы электронами.
3.
• В 1896 году французскийученый Анри Беккерель
открыл явление естественной
радиоактивности.
Радиоактивность – свойство атомов
некоторых элементов самопроизвольно
излучать невидимые глазом частицы.
Явление обусловлено распадом атомных
ядер и превращением их в другие
элементы.
4.
• Эрнест Резерфорд –британский физик.
В 1911 г проводил
опыты с α-излучением.
На основе своего
исследования он
предложил планетарную
модель атома, согласно
которой атом состоит из
положительно
заряженного ядра и
отрицательно
заряженных электронов,
движущихся вокруг него.
5.
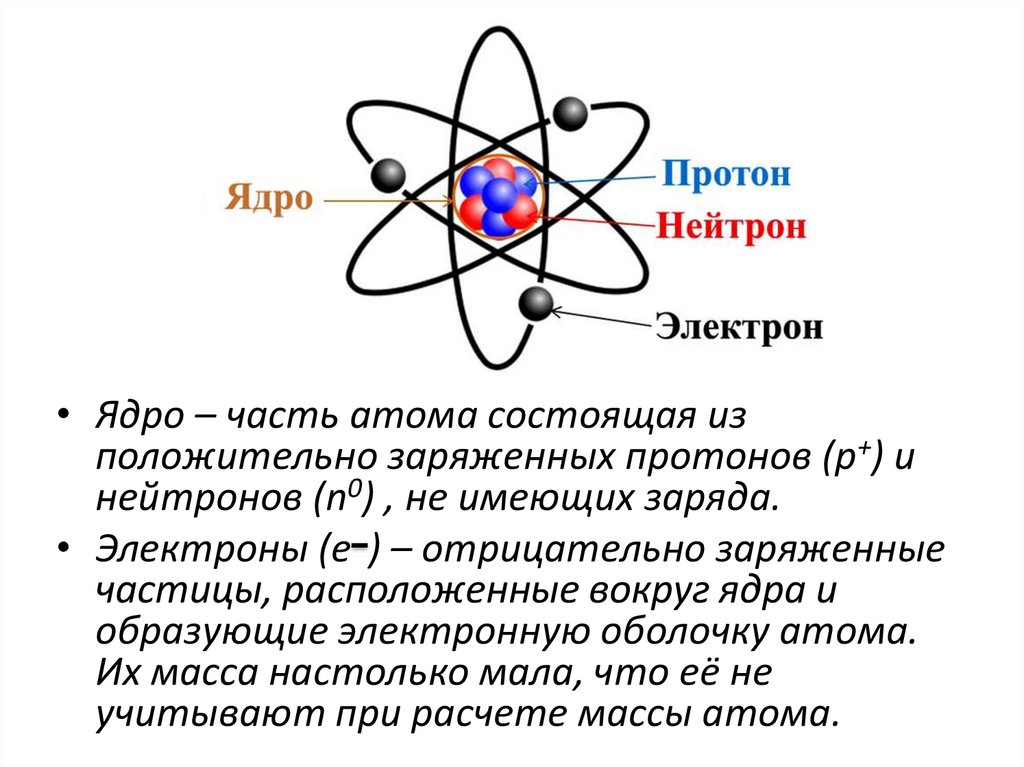
• Ядро – часть атома состоящая изположительно заряженных протонов (р+) и
нейтронов (n0) , не имеющих заряда.
• Электроны (е ) – отрицательно заряженные
частицы, расположенные вокруг ядра и
образующие электронную оболочку атома.
Их масса настолько мала, что её не
учитывают при расчете массы атома.
6.
Заряд ядра – определяется числомпротонов. Обозначается Z и численно
равен номеру химического элемента.
A
Z
Э
А – Масса атома
Z – Заряд ядра
7.
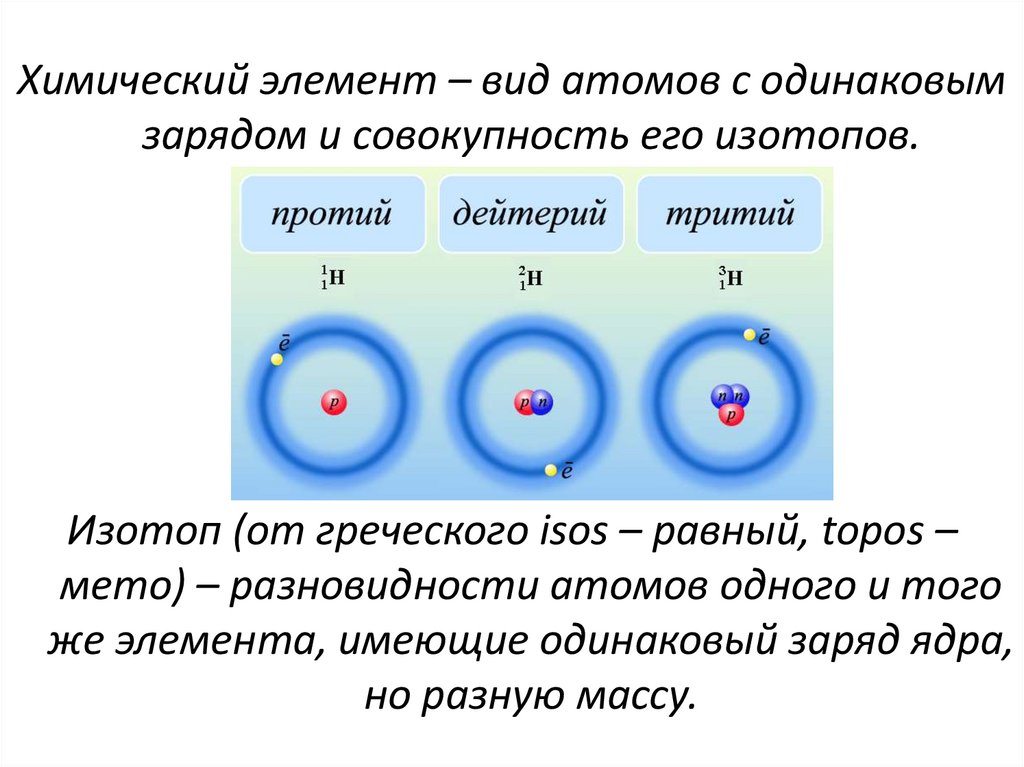
Химический элемент – вид атомов с одинаковымзарядом и совокупность его изотопов.
Изотоп (от греческого isos – равный, topos –
мето) – разновидности атомов одного и того
же элемента, имеющие одинаковый заряд ядра,
но разную массу.
8.
Задание• Определите число протонов, электронов и
нейтронов для атомов фтора, алюминия,
кислорода и селена.
9.
Задание• Определите число протонов, электронов и
нейтронов для 12C и 13C.
10.
Строение электронныхоболочек атомов
11.
Об электроне1. Электрон обладает свойствами как частицы (масса,
размер и т.д.), так и волны (траектория движения,
положение в пространстве)
2. Каждый электрон имеет свой запас энергии
3. Электроны расположены на различном расстоянии
от ядра:
• Чем ближе электрон к ядру, тем он прочнее с ним
связан
• Чем дальше электрон от ядра, тем слабее его связь с
ядром
12.
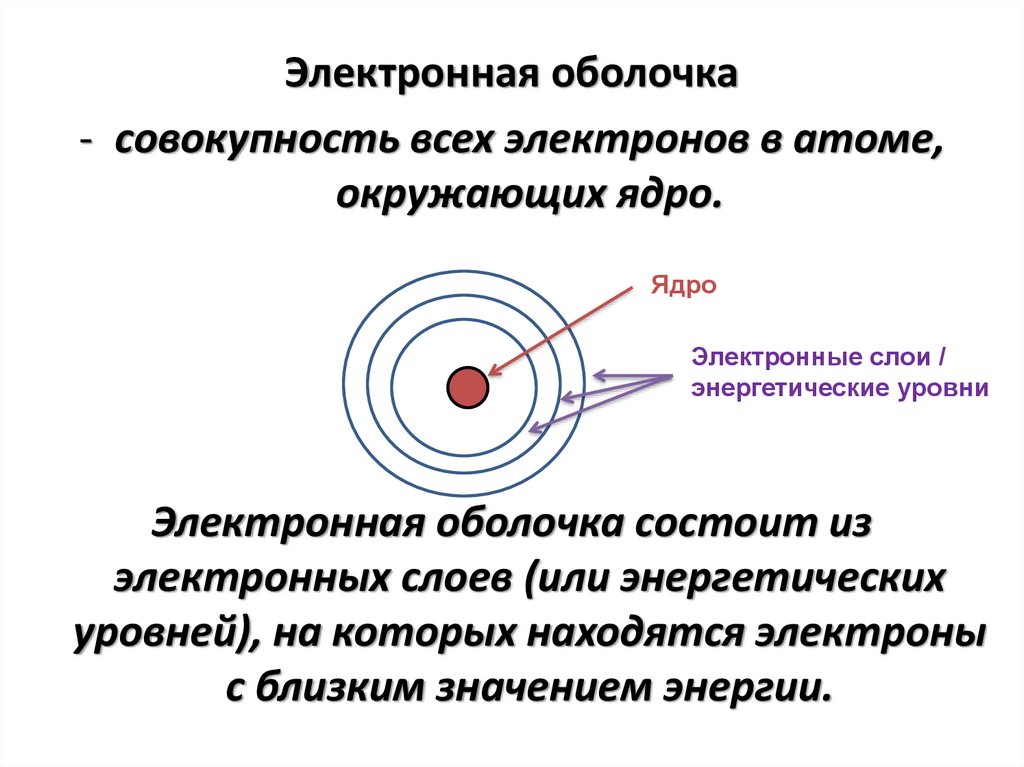
Электронная оболочка- совокупность всех электронов в атоме,
окружающих ядро.
Ядро
Электронные слои /
энергетические уровни
Электронная оболочка состоит из
электронных слоев (или энергетических
уровней), на которых находятся электроны
с близким значением энергии.
13.
Число энергетических уровней равно номерупериода, в котором находится элемент.
Заполняемость энергетических уровней:
1й уровень – максимум 2 е2й уровень – максимум 8 е3й уровень – максимум 18 е4й уровень – максимум 32 е-
14.
Энергетические уровни бывают• Завершенными - содержат максимальное
число электронов. (Устойчивы и
стабильны)
• Незавершенными - содержат меньшее
число электронов, чем может быть на этом
уровне.
15.
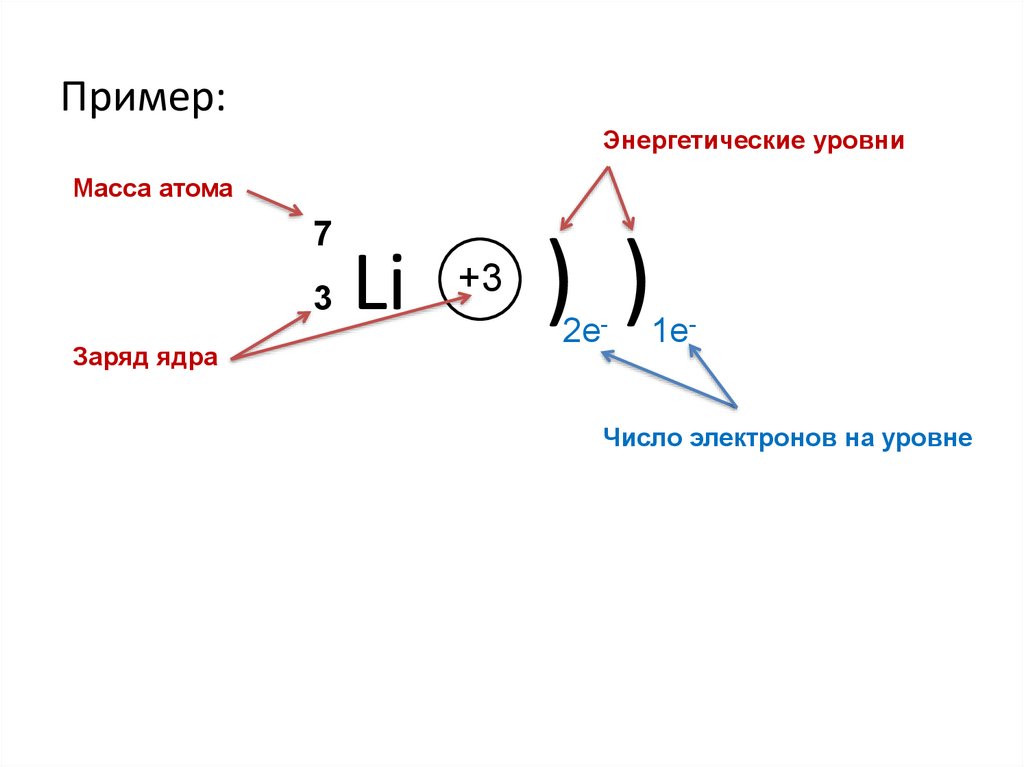
Пример:Энергетические уровни
Масса атома
7
3
Заряд ядра
Li
+3
) )
2е-
1е-
Число электронов на уровне
16.
• Внешние (или валентные) электроны– электроны, расположенные на
последнем электронном слое. Их
число равно номеру группы, в которой
находится элемент.












 Химия
Химия








