Похожие презентации:
Строение атома. Периодичность свойств элементов и их соединений
1. ОБЩАЯ ХИМИЯ
2.
ВасильеваТатьяна Михайловна
д.т.н.
профессор департамента химии МФТИ
tmvasilieva@gmail.com
Лекции: среда 900 БХим
2
Лабораторные занятия: см. расписание
3. План лекционных занятий
СТРОЕНИЕ ВЕЩЕСТВАСПЕЦИАЛЬНЫЕ
РАЗДЕЛЫ:
Химия в современной
океанологии;
Химические проблемы
переработки
углеводородного сырья;
Химические проблемы
современных
аэрокосмических
технологий;
ФИЗИЧЕСКАЯ ХИМИЯ
3
Объясняет химические явления и
устанавливает их закономерности
на основе общих принципов
физики
Химические основы
создания новых
функциональных
материалов;
Химия экстремальных
состояний вещества
4. Литература
1) Н.С. Ахметов Общая и неорганическая химия. М.:Высш. шк., 2009
2) Практический курс общей химии. М.: МФТИ, 2011
3) В.В. Вольхин Общая химия. Основной курс.
СПб.: Издательство «Лань», 2008
4) Н.Л. Глинка Задачи и упражнения по общей
химии. М.: КНОРУС, 2011
5) R. Chang Physical Chemistry for the Biosciences.
University Science Books, 2005
4
5. Строение атома Периодичность свойств элементов и их соединений
Лекция 16.
- До каких пор можно делить порцию вещества?6
- Вещество можно делить лишь до тех пор, пока
не будут получены его наименьшие частицы. Так утверждал греческий философ Демокрит за
400 лет до н.э. Он назвал эти частицы атомами
(неделимый).
7. Косвенные свидетельства сложности строения атомов
Фотоэффект ( А.Г. Столетов, 1889 г.)Открытие рентгеновского излучения (В.К. Рентген, 1895 г.)
Открытие электрона (Дж. Дж. Томсон, 1897 г.)
Естественная радиоактивность (А. Беккерель, 1896 г.) –
урановая смоляная руда: засвечивание фотопленки,
ионизация газов, свечение флуоресцирующих веществ
Радиоактивность (М. Кюри, 1896-1898 гг.) – Po и Ra в
составе урановых руд
Эксперименты Э. Резерфорда по рассеиванию α-частиц
(1911 г.)
Вывод: α-частицы
сталкиваются с другими
положительно
заряженными частицами
большой массы (атомное
ядро)
7
8.
Уравнение Шредингера (1925 г.)h2 2 2 2
2
2 2 U E
2
8 m x
y
z
2 2
или
U E
2m
1. Электрон в атоме можно рассматривать как частицу, которая при движении
проявляет волновые свойства. Т.е. нельзя описать движение электрона в атоме
определенной траекторией (орбитой).
2. Электрон в атоме может находиться в любой точке пространства вокруг ядра,
однако вероятность его пребывания в разных местах атомного пространства
различна.
8
Атомная орбиталь (АО) – граничная поверхность, внутри которой
вероятность нахождения электрона составляет не менее 90 - 95%.
9.
Следствия теории квантовой механикиВажным следствием теории квантовой механики
является то, что вся совокупность сложных
движений электрона в атоме описывается
четырьмя квантовыми числами
9
Характеристика энергии электрона и
пространственное распределение
вероятности нахождения его в атоме
системой квантовых чисел
10. Квантовые числа: резюме
СКвантовые числа: резюме
Номер периода
См. слайд 11
См. слайд 11
10
11. Формы электронных облаков s-, p- и d-орбиталей
Формы электронных облаков s-, pу s-подуровня – однаи d-орбиталей
АО
у р-подуровня – три АО
у d-подуровня – пять
АО
у f-подуровня – семь
АО
осевые
11
биссектрисные
12.
Закономерности формированияэлектронных структур
(см. также слайд 13)
−
−
12
Принцип наименьшей энергии: электрон
размещается на АО c min энергией
Принцип Паули: в атоме не может быть двух
электронов с одинаковым набором 4-х
кв.чисел
Правило Гунда: на одном подуровне сумма
спинов электронов максимальна
Правило Клечковского:
С ростом атомного номера элемента электронов
размещаются последовательно на орбиталях,
характеризуемых возрастанием суммы главного и
орбитального квантовых чисел - (n+l)
При одинаковых значениях этой суммы раньше
заполняется орбиталь с меньшим значением n
13. Закономерности формирования электронных структур (продолжение)
Наиболее устойчивые электронныеконфигурации
13
14.
1415.
Древние химики зналитолько один элемент грязь
15
Более 100
элементов
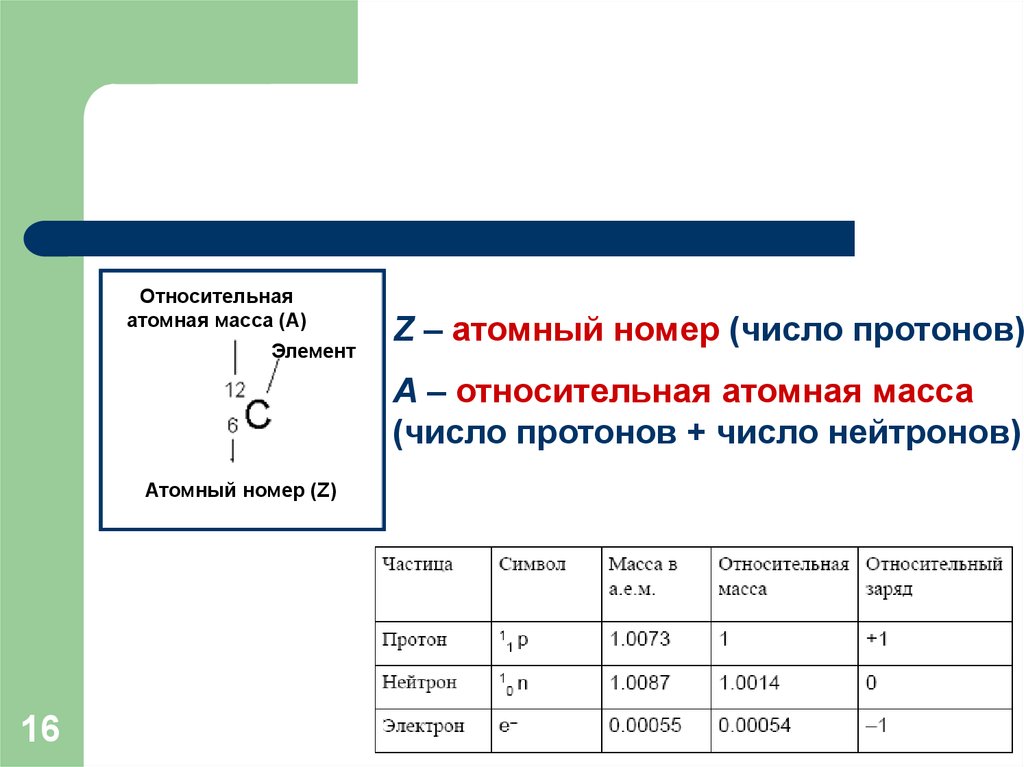
16.
Относительнаяатомная масса (А)
Элемент
Z – атомный номер (число протонов)
A – относительная атомная масса
(число протонов + число нейтронов)
Атомный номер (Z)
16
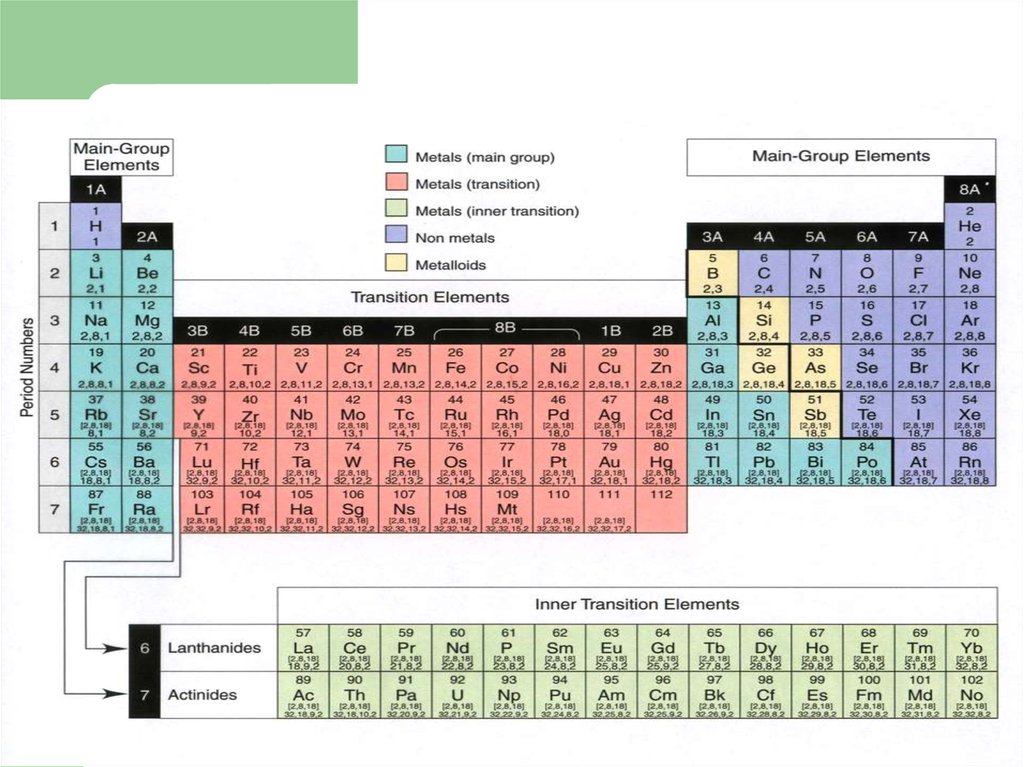
17. Периоды и группы
1718. Периодичность физических свойств элементов
3-ий периодCl2
P
Na
Ar
Mg
VA Группа
N2
18
P
As
Sb
Усиление металлических свойств
Bi
19. Периодический закон
Свойства химических элементов, атакже формы и свойства их
соединений находятся в
периодической зависимости от
величины заряда атомных ядер (Z) в
результате периодического повторения
электронных конфигураций внешнего
энергетического уровня
19
20. Периодически меняющиеся свойства атомов
20атомные и ионные радиусы
энергия ионизации
сродство к электрону
электроотрицательность
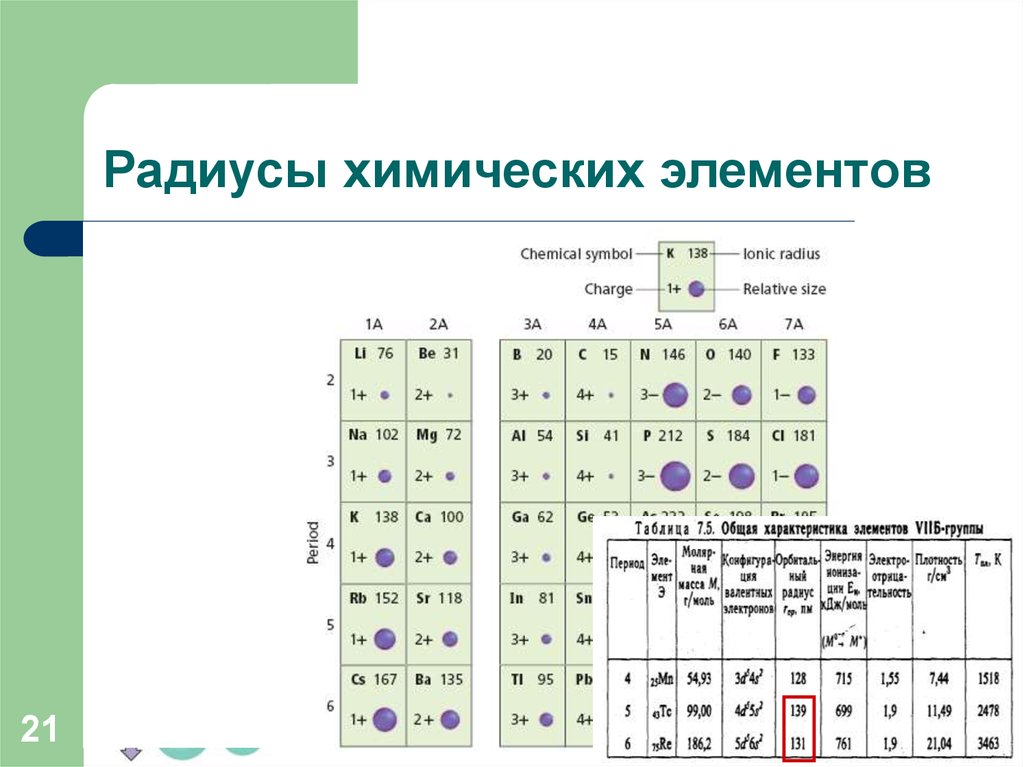
21. Радиусы химических элементов
Радиус атома (иона) – это расстояние от ядра домаксимума электронной плотности наиболее
удаленной орбитали этого атома (иона)
при этом в группах А
увеличение радиуса
происходит в большей
степени, чем в группах В
21
22. Энергия ионизации
Энергия ионизации – это энергия, необходимаядля отрыва электрона от атома и превращение
атома в положительно заряженный ион
Э – е = Э+, Еион [кДж/моль]
Восстановительные
свойства
22
уменьшение
Ионизационный потенциал – это разность потенциалов, при
которой происходит ионизация
увеличение
немонотонно
23. Изменение энергии ионизации в периодах и группах
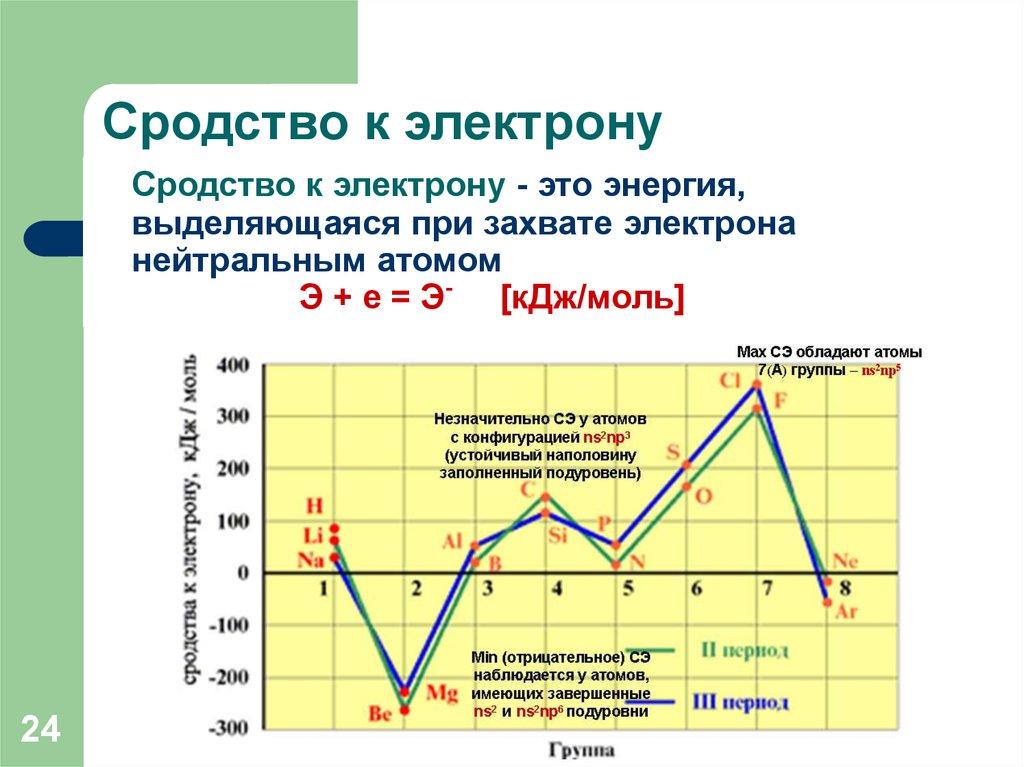
2324. Сродство к электрону
Сродство к электрону - это энергия,выделяющаяся при захвате электрона
нейтральным атомом
Э + е = Э- [кДж/моль]
24
25. Электроотрицательность
Электроотрицательность - свойство атома притягиватьэлектроны от других атомов, с которыми он образует
химическую связь в соединениях
ЭО по Маликкену:
χ Li = ½ (500+60) = 280 кДж/моль
χ F = ½ (1700+310) = 1005 кДж/моль
ОЭО по Полингу:
25
По Полингу χ Li условно принята за 1, тогда χ F = 1005 /280 = 3,6.
Т.о. получается безразмерная величина - относительная
электроотрицательность (ОЭО)
26. Изменение ОЭО в периодах и группах
Уменьшение ОЭОУвеличение ОЭО
26
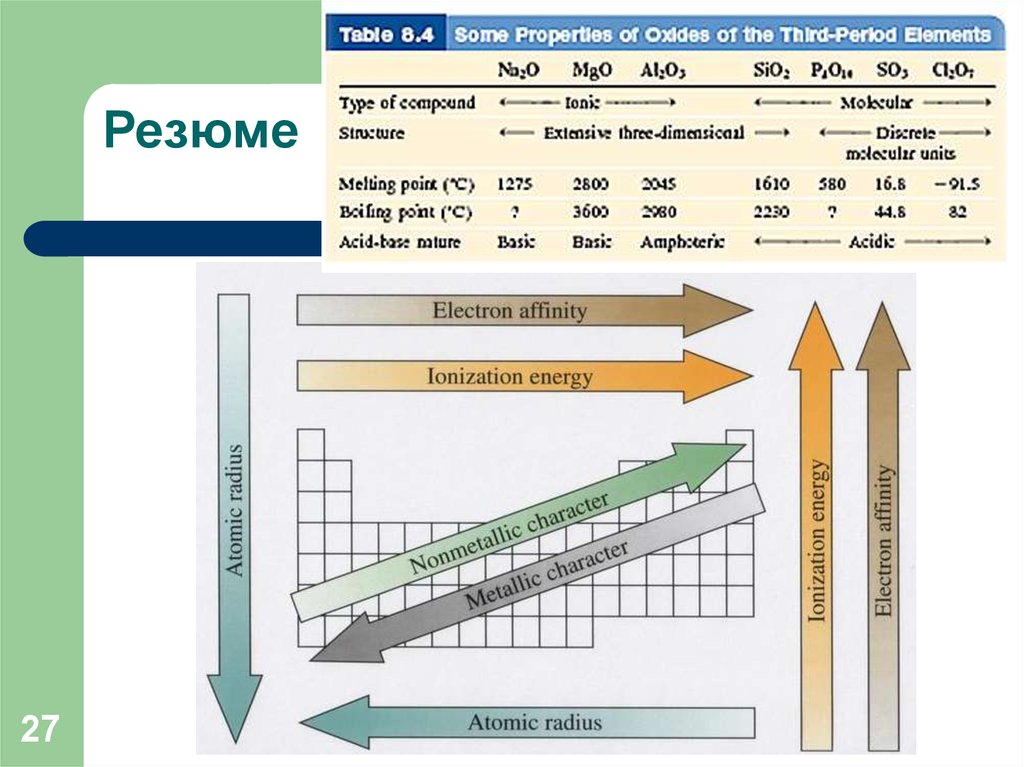
27. Резюме
2728. Степень окисления
Степень окисления – это условный заряд атома всоединении, вычисленный из предположения, что
соединение состоит только из ионов
Степени окисления могут быть:
28
-
отрицательными (атомы принимают электроны от других
атомов)
-
положительными (атомы отдают свои электроны другим
атомам)
-
иметь нулевое значение (степень окисления атома, входящего
состав простого вещества)
29.
Степени окисленияэлементов
Наиболее характерные степени окисления
выделены красным
29























 Химия
Химия








