Похожие презентации:
Ионные (электрофильные, нуклеофильные), радикальные реакции
1.
Федеральное государственное бюджетное образовательное учреждениевысшего образования
Кемеровский государственный медицинский университет
Министерства здравоохранения Российской Федерации
Кафедра фармацевтической и общей химии
Ионные (электрофильные,
нуклеофильные),
радикальные реакции
2.
ПЛАН ЛЕКЦИИ:1. Классификация реакций по механизму
разрыва связей. Химическое строение.
2. Электронные эффекты заместителей.
3. Пространственные (стерические)
эффекты.
2
3.
1. Классификация реакций по механизмуразрыва связей. Химическое строение
3
4.
В зависимости от способа разрываковалентной связи в реагирующей
молекуле органические реакции
подразделяются на радикальные и
ионные реакции.
4
5.
Способы разрыва ковалентной связи:Гомолитический:
Гетероциклический:
5
6.
При разрыве ковалентных связей образуютсяионы и свободные радикалы, которые не
являются конечными продуктами реакции.
Эти неустойчивые промежуточные частицы,
которые образуются на отдельных стадиях
реакции и сразу же вступают в дальнейшие
превращения называются интермедиатами.
6
7.
Радикальные реакции – реакции, вкоторых происходит гомолитический
разрыв связей и образуются свободнорадикальные промежуточные частицы.
7
8.
Реакция радикального замещения:Общая схема реакции:
CH4 + Cl2 → CH3Cl + HCl.
Стадии процесса:
Cl2 → 2Cl• (на свету)
Cl• + H-CH3 → HCl + •CH3
•CH3 + Cl2 → CH3Cl + Cl• и так далее.
SR
8
9.
Связи (например, С-С, С-Н, Cl-Cl, О-Ои т.п.) склонны к гомолитическому
разрыву.
9
10.
Гомолитическая диссоциация:R-R' → R• + R'
10
11.
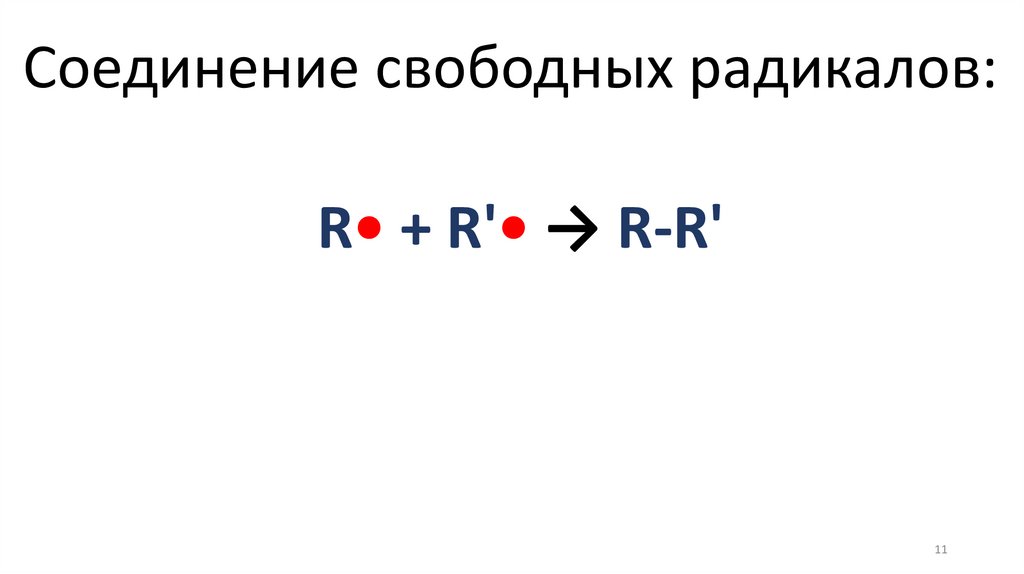
Соединение свободных радикалов:R• + R'• → R-R'
11
12.
Диспропорционированиерадикалов:
12
13.
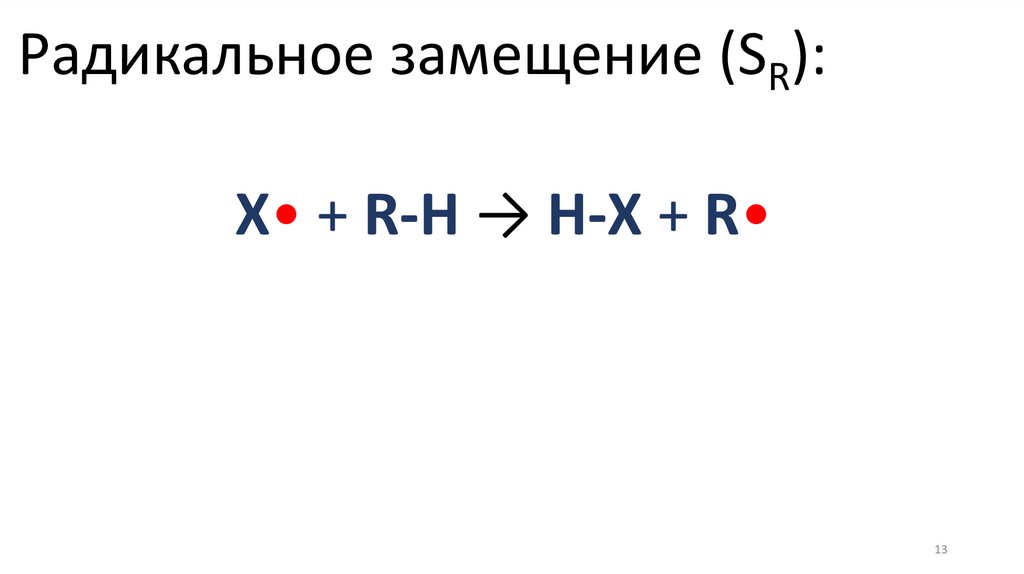
Радикальное замещение (SR):X• + R-H → H-X + R
13
14.
Радикальное присоединение(AdR):
14
15.
Условия протекания радикальных реакций:– повышение температуры (часто реакцию
проводят в газовой фазе);
– действие света или радиоактивного
излучения;
– присутствие соединений – источника
свободных радикалов (инициаторов)
(например, пероксидов ROOR);
– неполярные растворители.
15
16.
Ионные реакции – реакции, в которыхпроисходит гетеролитический разрыв
связей и образуются промежуточные
частицы ионного типа.
Для соединений с полярными связями (С-О,
C-N, C-Cl) и связями с высокой
поляризуемостью (С=С, С=С-С=С, С=О, С=N и
т.п.).
16
17.
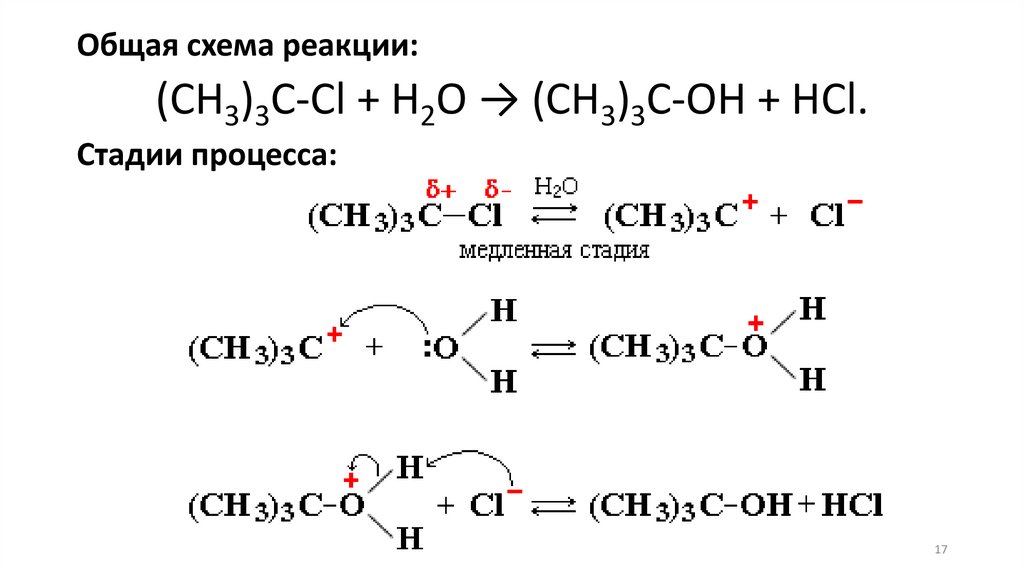
Общая схема реакции:(CH3)3C-Cl + H2O → (CH3)3C-OH + HCl.
Стадии процесса:
17
18.
Условия ионных реакций:– невысокая температура;
– полярные растворители, способные к
сольватации образующихся ионов.
Действие света или радиоактивного
излучения не влияет на скорость ионных
реакций.
18
19.
Электрофильной называется реакция, в которой молекулаорганического вещества подвергается действию
электрофильного реагента.
Электрофильные («любящие электроны») реагенты или
электрофилы – это частицы (катионы или молекулы),
имеющие свободную орбиталь на внешнем электронном
уровне.
Примеры электрофильных частиц: Н+, СН3+ и другие
карбокатионы, NO2+, ZnCl2, AlCl3.
19
20.
Атом алюминия в молекуле AlCl3 содержитна внешнем электронном уровне 6 ē, т.е.
имеет незавершенную электронную
конфигурацию. Он способен принять 2 ē на
вакантную орбиталь, проявив при этом
свойства электрофила. Аналогично
построены FeCl3, ZnCl2, BF3 и т.п.
соединения. Электрофильные свойства
этих веществ определяют их
каталитическую активность.
20
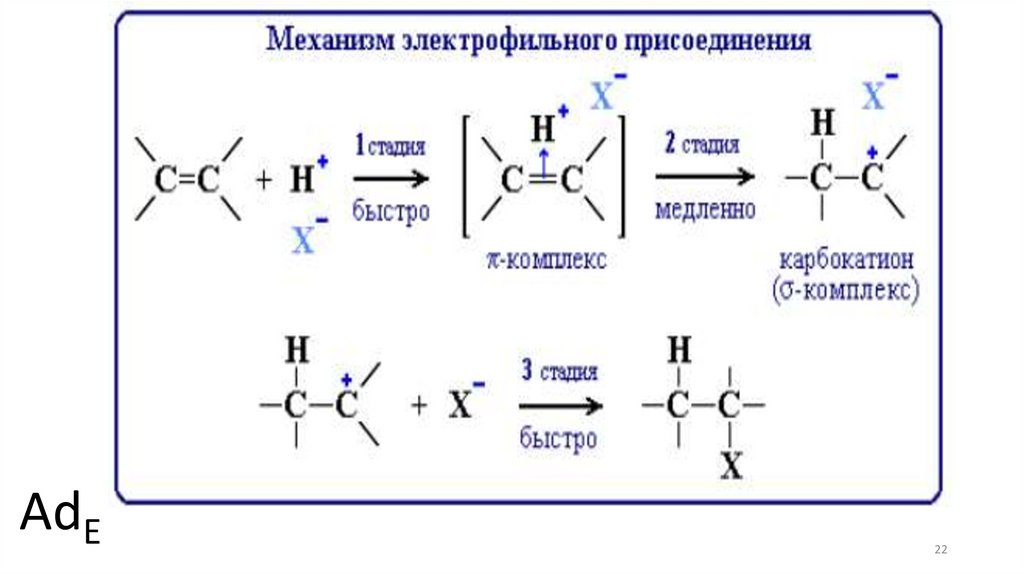
21.
Электрофильное присоединение:CH2=CH2 + HCl → CH3CH2Cl
+
(электрофил – Н в составе HCl)
Стадии:
1. CH2=CH2 + Hδ+ – Clδ– → [(CH2CH2)H]+ + Cl–
(быстро)
2. [(CH2CH2)H]+ → CH3CH2+ (медленно)
3. CH3CH2+ + Cl– → CH3CH2Cl (быстро)
21
22.
AdE22
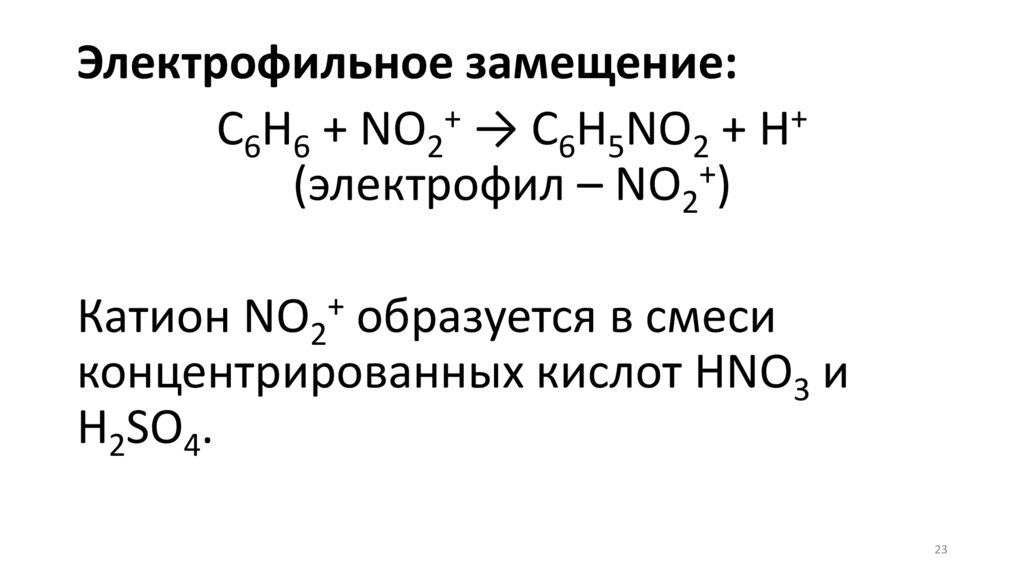
23.
Электрофильное замещение:+
+
C6H6 + NO2 → C6H5NO2 + H
+
(электрофил – NO2 )
+
Катион NO2 образуется в смеси
концентрированных кислот HNO3 и
H2SO4.
23
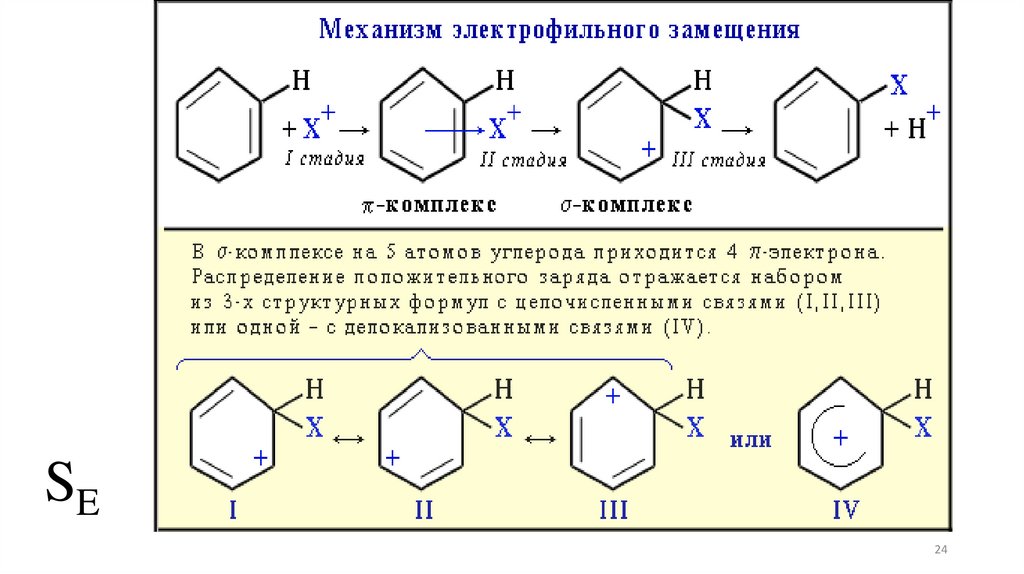
24.
SE24
25.
Нуклеофильная реакция – реакция, в которой молекулаорганического вещества подвергается действию
нуклеофильного реагента.
Нуклеофильные («любящие ядро») реагенты, или
нуклеофилы – это частицы (анионы или молекулы),
имеющие неподеленную пару электронов на внешнем
электронном уровне.
Примеры нуклеофильных частиц: OH–, Cl–, Br–, CN–, H2O,
CH3OH, NH3.
25
26.
Электронное строение некоторых нуклеофильныхреагентов
26
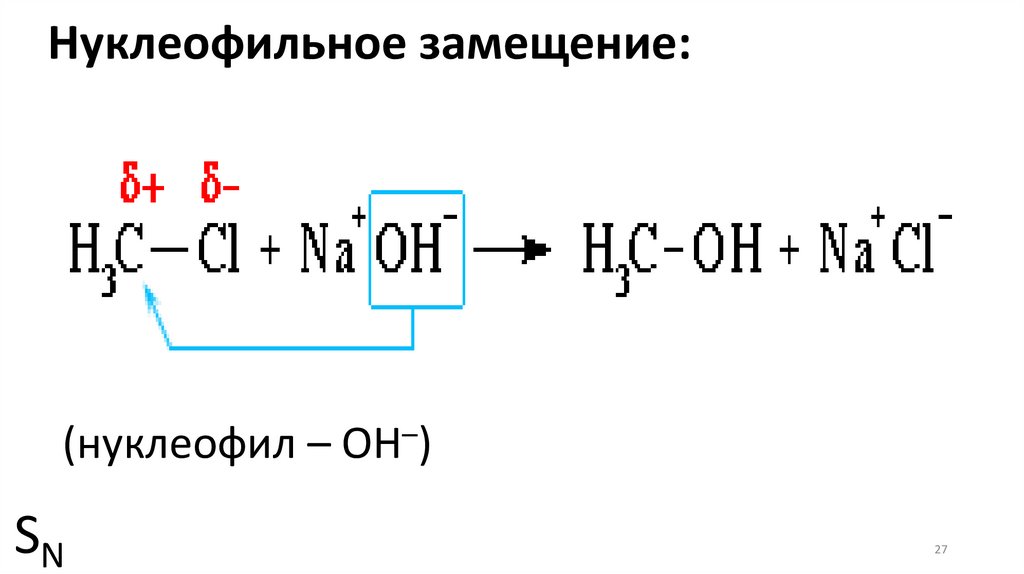
27.
Нуклеофильное замещение:(нуклеофил – ОН–)
SN
27
28.
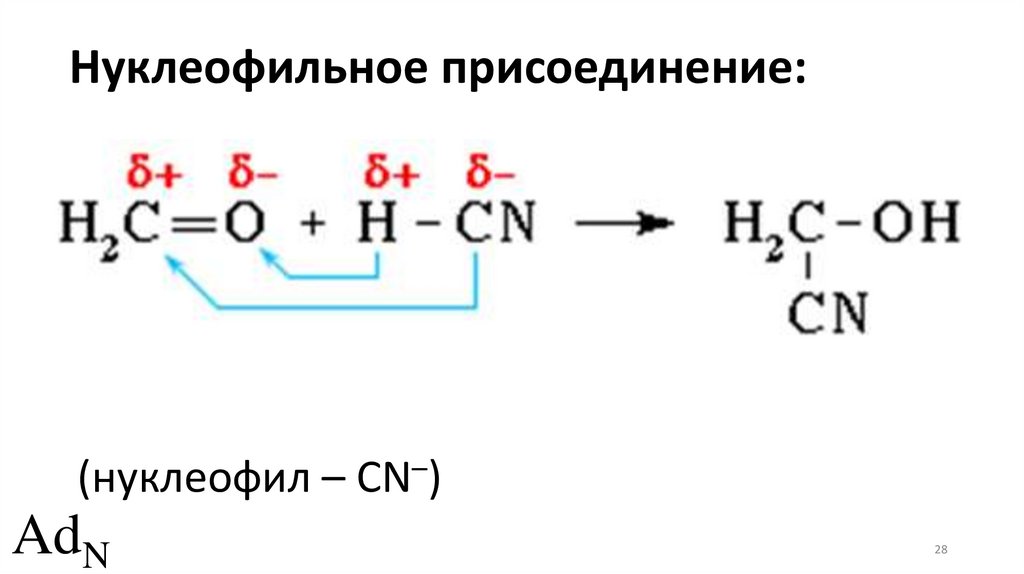
Нуклеофильное присоединение:(нуклеофил – CN–)
AdN
28
29.
2. Электронные эффектызаместителей
Электронные эффекты –
смещение электронной плотности
в молекуле, ионе или радикале
под влиянием заместителей.
29
30.
Заместителем считается любойатом (кроме водорода) или
группа атомов, которые
непосредственно не участвуют
в реакции, но оказывают
влияние на реагирующую часть
молекулы.
30
31.
Электродонорные заместители – атомы или атомныегруппировки, повышающие электронную плотность на
остальной части молекулы. Заместители этого типа
увеличивают отрицательный заряд на остатке молекулы,
снижают энергию промежуточных катионов за счет
делокализации положительного заряда и увеличивают
скорость реакции, если на самой медленной
(лимитирующей) стадии, образуется катион. Напротив,
они уменьшают скорость реакции, если на
лимитирующей стадии образуется анион.
31
32.
Электроноакцепторные заместители – атомы илигруппы атомов, понижающие электронную плотность на
связанном с ним углеводородном фрагменте. Такие
заместители увеличивают положительный заряд на
остальной части молекулы, стабилизируют
промежуточные анионы и увеличивают скорость
реакции, если на лимитирующей стадии образуется
анион.
32
33.
Виды влияния заместителей: индуктивный(I) и мезомерный (М) эффекты.
В зависимости от того, в какую сторону
смещаются электроны – от заместителя
или к заместителю – различают,
соответственно, положительные (+I, +M) и
отрицательные (–I, –M) эффекты.
33
34.
ИНДУКТИВНЫЙ ЭФФЕКТ (I-эффект)34
35.
Индуктивный эффект – смещениеэлектронной плотности по цепи
σ-связей, которое обусловлено
различиями в
электроотрицательностях атомов.
35
36.
Индуктивный эффект называютотрицательным (–I), если заместитель
уменьшает электронную плотность на
атоме углерода, с которым связан этот
заместитель. При этом заместитель
–
приобретает отрицательный заряд (δ ), а
атом углерода – частичный
положительный заряд (δ+).
36
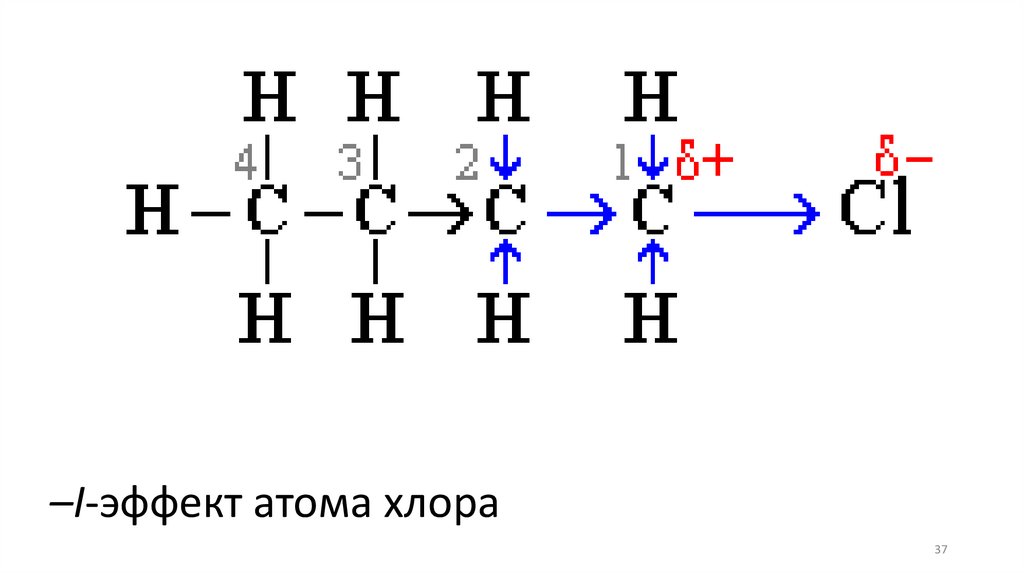
37.
–I-эффект атома хлора37
38.
Индуктивный эффект называетсяположительным (+I), если
заместитель увеличивает электронную
плотность на атоме углерода,
индуцируя на нем частичный
–
отрицательный заряд δ , сам при этом
+
приобретая заряд δ .
38
39.
–I-эффект проявляют заместители, которыесодержат более электроотрицательные атомы, чем
атом углерода:
–F, –Cl, –Br, –OH, –NH2, – NO2, >C=O, –COOH и др.
+I-эффект проявляют заместители, содержащие
атомы с низкой электроотрицательностью:
–Mg–, –Li; алифатические углеводородные
радикалы (–CH3, –C2H5) и т.п.
39
40.
Мезомерный эффект – смещениеэлектронной плотности по цепи
делокализованных (сопряженных)
π-связей.
40
41.
+М-эффектом обладают заместители,повышающие электронную плотность в
сопряженной системе. К ним относятся группы,
которые содержат атомы с неподеленной парой
электронов, способные к передаче этой пары
электронов в общую систему сопряжения.
+М-эффект характерен для групп: –OH, –OR, –NH2,
–NHR и т.п.
41
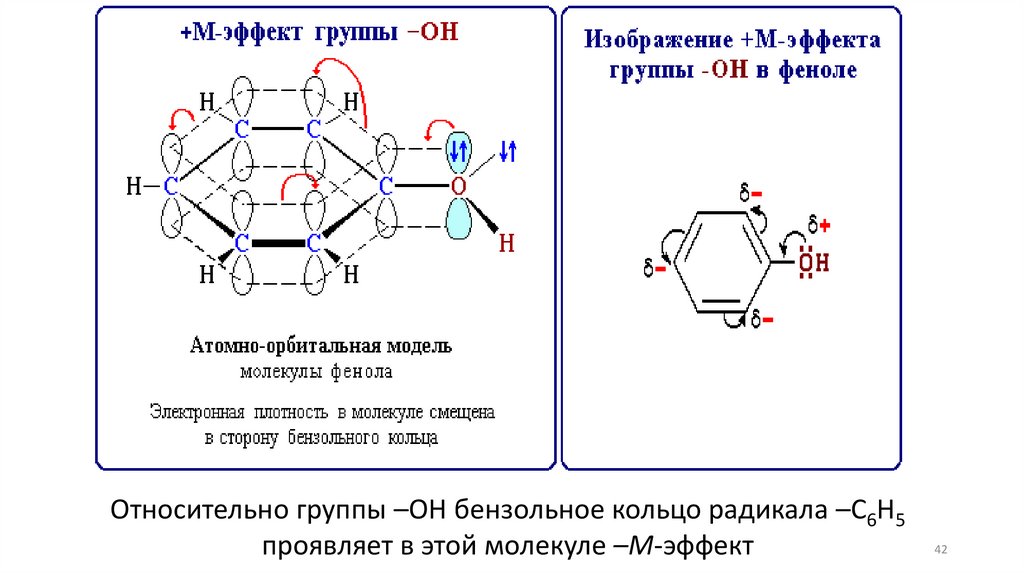
42.
Относительно группы –ОН бензольное кольцо радикала –С6Н5проявляет в этой молекуле –М-эффект
42
43.
–М-эффект проявляют заместители,содержащие электроотрицательные атомы и
понижающие электронную плотность в
сопряженной системе.
Такими свойствами обладают группы: >С=О,
–СООН, –СООR, –С≡N, –NO2, –SO3H и др.
Пример: –М-эффект группы >С=О в
бензальдегиде С6Н5СН=О.
43
44.
4445.
Электронные эффекты некоторых заместителейЗаместитель
Алкильные группы
–O–
–NH2, –NHR, –NR2
–OH, –OR
–NH3+, –NR3+
–F, –Cl, –Br, –I
>C=O
–COOH, –COOR
–NO2
–C≡N
–SO3H
Электронные эффекты
Характер совместного
действия
индуктивный мезомерный
+I
+M
+I
+M
Электродонорный
–I
+M
–I
+M
–I
–
–I
+M
–I
–M
–I
–M
Электроноакцепторный
–I
–M
–I
–M
–I
–M
45
46.
3. Пространственные (стерические) эффектыРеакционная способность соединений зависит не
только от электронных эффектов заместителей,
но и от их пространственного строения –
размеров и относительного положения в
молекуле. Такое влияние, называемое
пространственным или стерическим
эффектом, как правило, тем больше, чем ближе
расположен объемный заместитель к
реакционному центру молекулы.
46
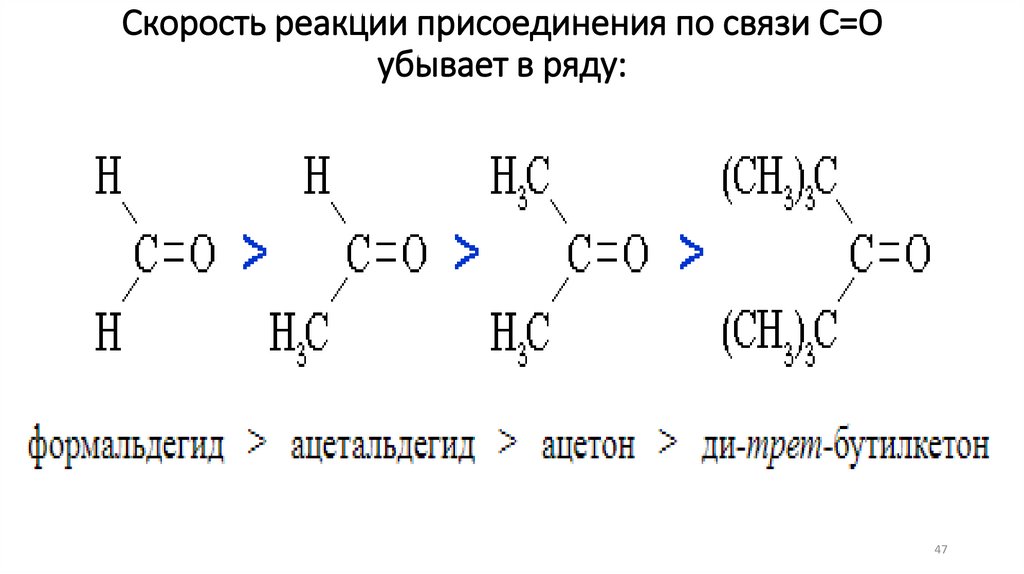
47.
Скорость реакции присоединения по связи С=Оубывает в ряду:
47
48.
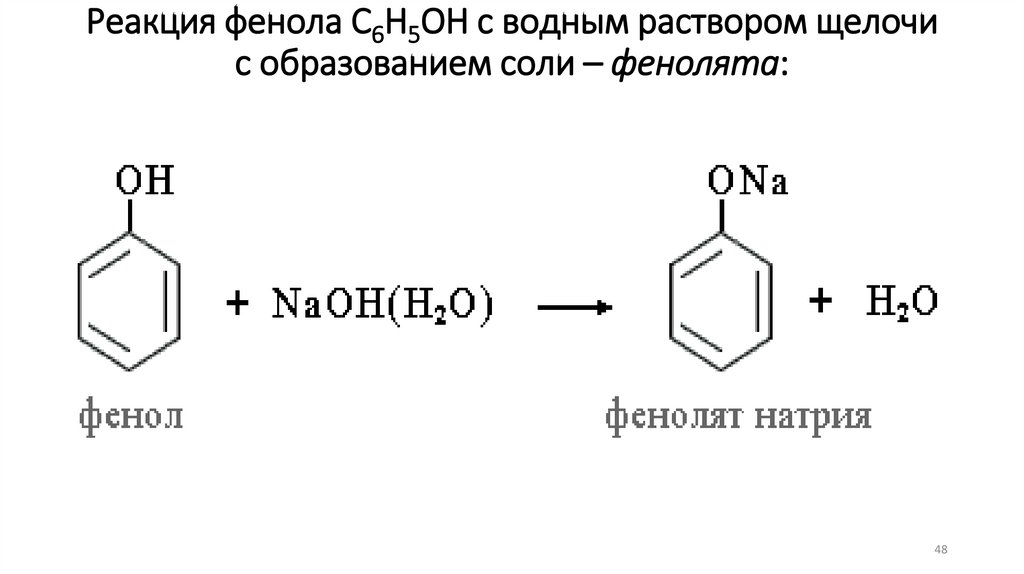
Реакция фенола С6Н5ОН с водным раствором щелочис образованием соли – фенолята:
48
49.
Фенолы с объемными заместителями, экранирующимигруппу ОН, в эту реакцию не вступают:
49
50.
Способность вещества вступать в ту или инуюреакцию и реагировать с большей или меньшей
скоростью называется его реакционной
способностью.
Реакционная способность органических
соединений зависит от химического,
электронного и пространственного строения
молекул и определяется рядом факторов.
50
51.
Факторы, определяющие реакционную способностьорганических соединений, можно разделить на две
основные группы:
– распределение электронной плотности в молекуле и
ее пространственное строение до вступления в
реакцию (статический фактор);
– относительная устойчивость образующихся в
процессе реакции промежуточных частиц
(интермедиатов) – ионов и радикалов (динамический
фактор).
51
52.
Домашнее задание:Кислотные и основные свойства органических соединений.
Биологически важные реакции гомофункциональных и
полифункциональных соединений.
Многоатомные спирты. Хелатные комплексы.
Сложные эфиры многоатомных спиртов с неорганическими кислотами
(нитроглицерин, фосфаты глицерина).
Двухосновные карбоновые кислоты: щавелевая, малоновая, янтарная,
глутаровая, фумаровая.
52
53.
БЛАГОДАРЮ ЗА ВНИМАНИЕ!53











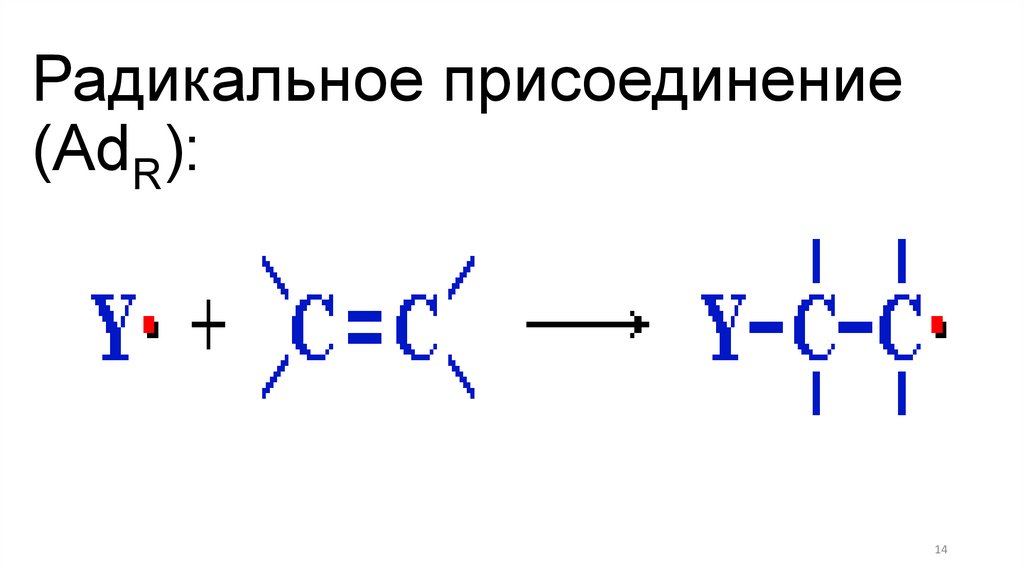





























 Химия
Химия








