Похожие презентации:
Реакционная способность углеводородов. Реакции SR, АЕ , SЕ
1.
Лекция: Реакционная способностьуглеводородов.
Реакции SR, АЕ , SЕ
Биоорганическая химия
для специальности 31.05.01 Лечебное дело
ИФОИТМ
Доцент Янькова В.И.
2.
Основные вопросы лекции:• 1. Предмет изучения биоорганической химии
• 2. Классификация органических реакций.
• 2. Реакции SR алканов, циклоалканов. Механизм,
биологическая роль в метаболических процессах.
• 3. Реакция АЕ алкенов, алкадиенов. Механизм, значение.
• 4. Реакции SЕ аренов, гетероциклов. Механизм,
биологическая роль .
3.
Биоорганическая химия изучает строение исвойства веществ, участвующих в процессах
жизнедеятельности, в непосредственной
связи с познанием их биологической
функции.
4.
Субстрат – вещество, в котором происходит разрывстарых и образование новых связей с участием атома
углерода.
Реагент – вещество, под действием которого происходят
изменения в субстрате.
СН3Br + NaOH
Субстрат
Реагент
СН3OH + NaBr
продукты реакции
Механизм реакции – детальное описание процесса в
результате которого исходные вещества (субстрат и
реагент) превращаются в продукты реакции.
5.
По направлению и конечному результату:Реакции присоединения – А;
Реакции замещения – S;
Реакции отщепления – Е (элиминирования);
Реакции перегруппировки
Реакции окисления и восстановления
6.
По характеру изменения связей в субстратах иреагентах:
•реакции радикальные (гомолитический тип
разрыва связей)
Х : У Х. + У.
(образуются радикалы (R.): Х. и У. )
•реакции ионные (гетеролитический тип
разрыва связей)
E : N E + + :N–
(образуются электрофилы E + и нуклеофилы :N– )
7.
Ионные реакции в зависимости от природыреагента:
• электрофильные
• нуклеофильные
8.
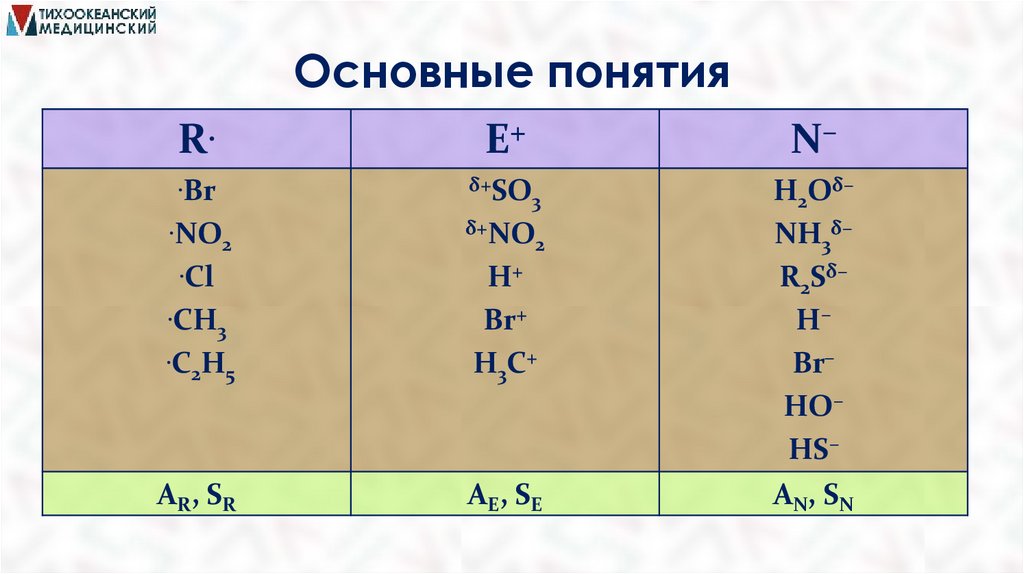
Основные понятияРАДИКАЛЫ(R.) – свободные
атомы
или частицы с
.
.
.
неспаренным электроном ( CH3, Cl , Br ).
ЭЛЕКТРОФИЛЫ (E) – частицы или фрагменты
молекул, содержащие свободную орбиталь и имеющие
недостаток электронной плотности (H+, Br +, Cl + ) .
НУКЛЕОФИЛЫ (N ) – частицы или фрагменты
молекул, содержащие подвижную -электронную
пару на
внешнем электронном уровне (Br , Cl , OH , :NH3, Н2О:).
.
9.
Основные понятияR.
Е+
N–
.Вr
δ+SO
3
δ+NO
2
Н+
H2Oδ–
NH3δ–
R2Sδ–
Н–
Вr–
НО–
НS–
AN, SN
.NO
2
.Cl
.СН
.С Н
2 5
Вr+
Н3С+
АR, SR
AE, SE
3
10.
11.
Реакции радикального замещения (SR) – …… реакции замещения, в которых атаку
осуществляют свободные радикалы —
частицы, содержащие один или несколько
неспаренных электронов.
Стадии процесса:
• инициирование цепи;
• развитие цепи;
• обрыв цепи.
12.
Пример SR реакции1)Инициирование реакции
h
Cl
Cl . + . Cl
Cl
2) Развитие цепи
CH3
CH2
CH3
Cl
HCl
CH3
Cl
HCl
CH
CH3
Cl2
Cl
Cl CH
CH3
CH3
...
CH3
Cl CCl
CCl3
CH3
Cl Cl C
Cl
HCl
HCl
CH3
...
CH3
Cl CCl
CCl3
13.
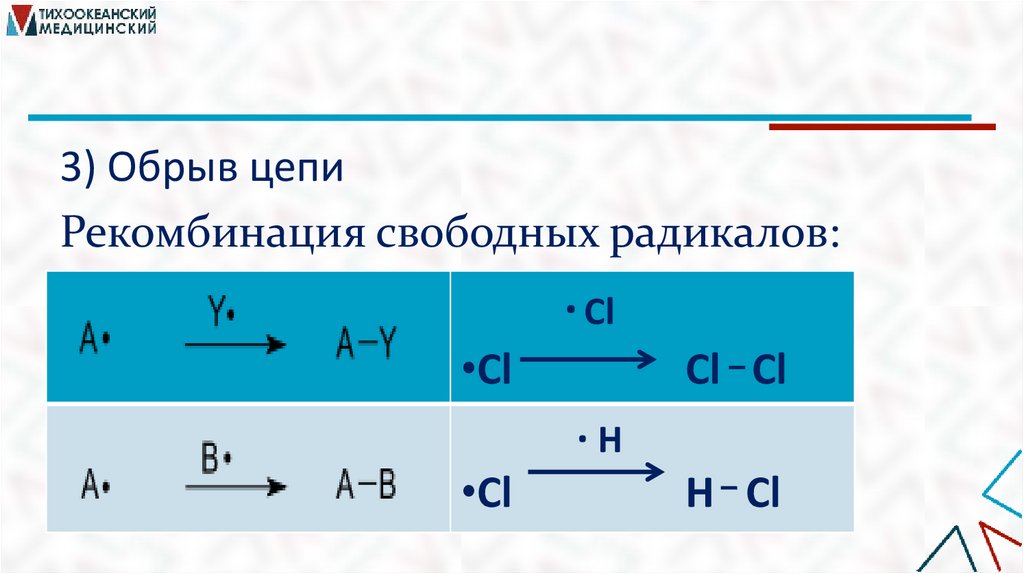
3) Обрыв цепиРекомбинация свободных радикалов:
∙ Cl
•Cl
Cl Cl
∙H
•Cl
H Cl
14.
Региоселективность реакций SRРеакция галогенирования (Br2, Cl2) протекающая по
механизму радикального замещения (SR), характеризуется
региоселективностью, т.е. избирательностью к месту
замещения.
При этом в первую очередь замещается атом водорода у
третичного, затем у вторичного и первичного атомов
углерода, что обусловлено меньшей энергией связи
С-Н у третичного атома углерода и большей стабильностью
третичного радикала.
15.
* Биологическая роль SR*Поражение кроветворных систем, кожных
покровов, желез внутренней секреции,
иммунной системы, мутации.
* Злокачественные новообразования в
организме.
* Изучение структур ферментов, мембран,
липидов.
* Синтез лекарств: противоопухолевые,
антибиотики.
16.
17.
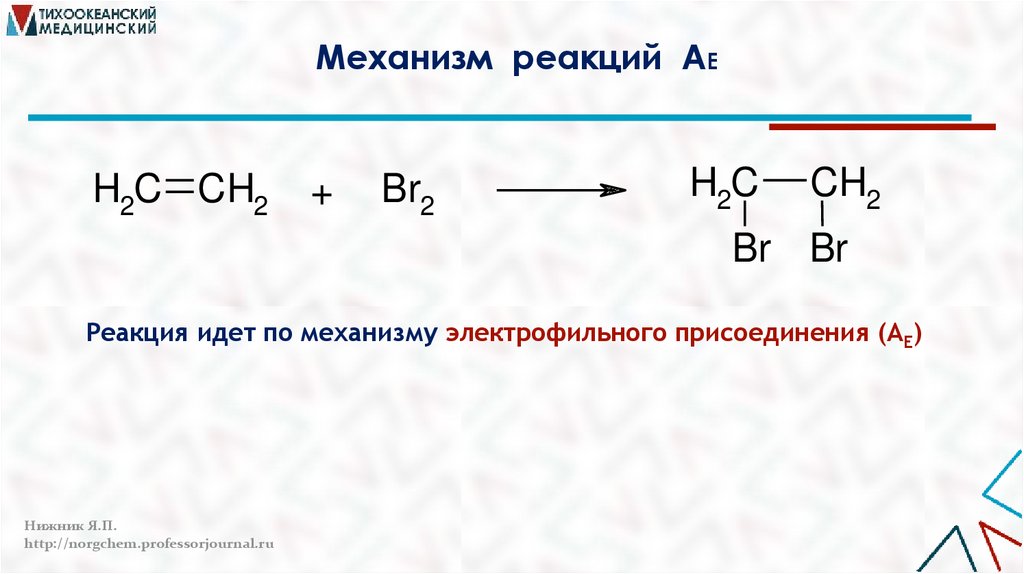
Механизм реакций АEH2C CH2
+
Br2
H2C
CH2
Br Br
Реакция идет по механизму электрофильного присоединения (AE)
Нижник Я.П.
http://norgchem.professorjournal.ru
18.
Реакции электрофильного присоединения (АЕ)—…
… реакции, в которых атаку на начальной стадии
осуществляет электрофил — частица,
заряженная положительно или имеющая
дефицит электронов. На конечной стадии
образующийся карбкатион подвергается
нуклеофильной атаке.
Чаще атакующей электрофильной частицей
является H+.
19.
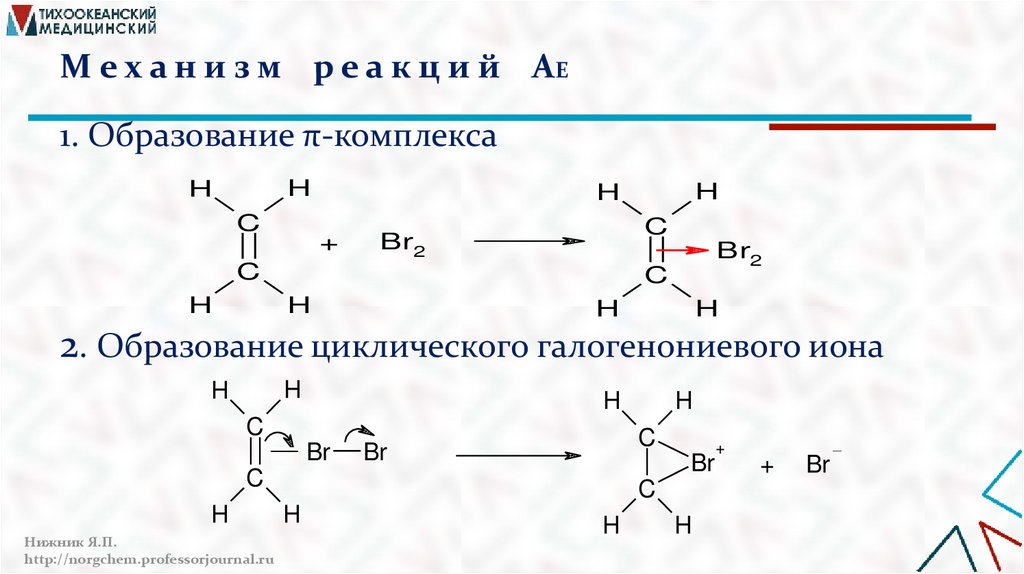
М е х а н и з м р е а к ц и й АE1. Образование π-комплекса
H
H
C
+
C
Br2
C
H
H
H
Br2
C
H
H
H
2. Образование циклического галогенониевого иона
H
H
C
Br
C
Br
Br
C
H
Нижник Я.П.
http://norgchem.professorjournal.ru
H
H
C
H
H
H
+
+
Br
20.
Механизмреакций
АE
3. Атака галогенониевого иона галогенид-ионом
H
H
C
Br
Br
C
H
C
+
Br
H
H
H
Br
C
H
H
Атака галогенид -ионом происходит со стороны, противоположной
по отношению атому галогена в галогенониевом ионе (в трансположение), образуется продукт транс-присоединения.
Нижник Я.П.
http://norgchem.professorjournal.ru
21.
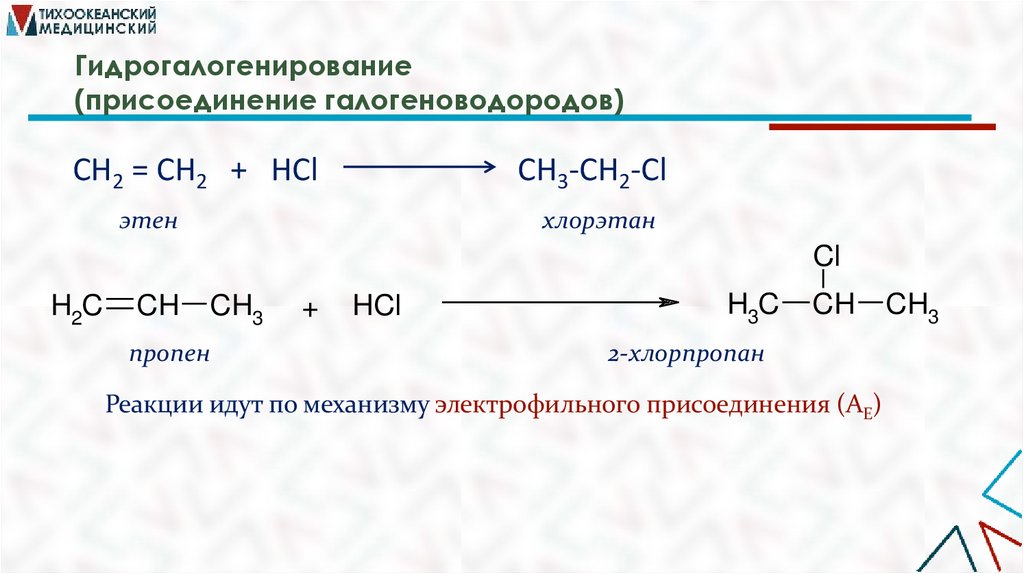
Гидрогалогенирование(присоединение галогеноводородов)
CH2 = CH2 + HCl
CH3-CH2-Cl
этен
хлорэтан
Cl
H2C
CH
CH3
пропен
+
HCl
H3C
CH
2-хлорпропан
Реакции идут по механизму электрофильного присоединения (AE)
CH3
22.
Механизмреакций
АE
(карбокатион)
Электрофил H+, образующийся при гетеролитическом разрыве связи в молекуле
HCl, атакует π-связь, образуя неустойчивый π-комплекс (быстрая стадия),
который превращается в карбкатион (ϭ-комплекс). Это медленная стадия,
определяющая скорость процесса в целом.
Нуклеофильная атака хлорид-анионом Cl– образовавшегося карбкатиона приводит к
конечному продукту (быстрая стадия).
23.
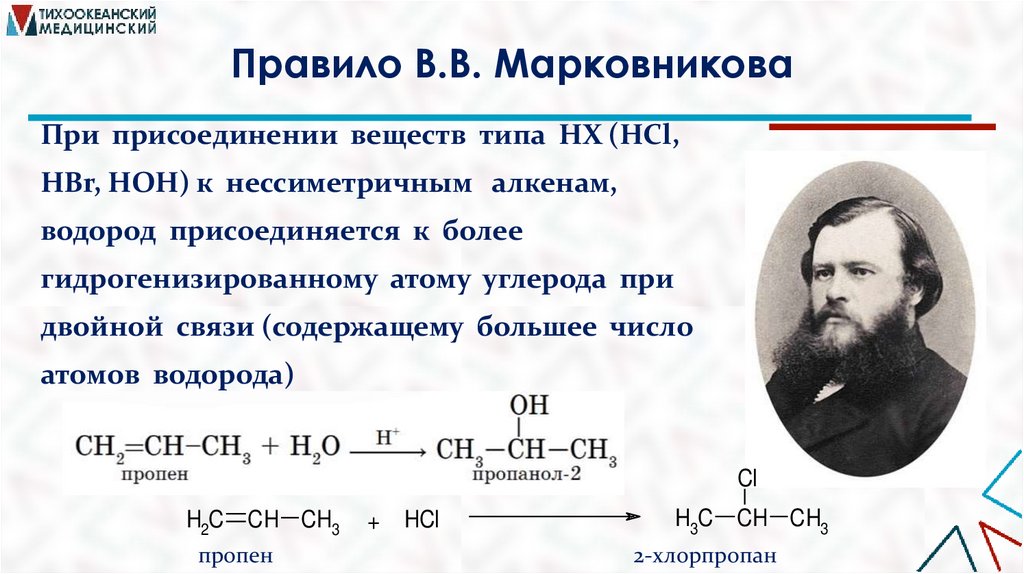
Правило В.В. МарковниковаПри присоединении веществ типа НХ (НCl,
HBr, HOH) к нессиметричным алкенам,
водород присоединяется к более
гидрогенизированному атому углерода при
двойной связи (содержащему большее число
атомов водорода)
Cl
H2C CH CH3
пропен
+
HCl
H3C CH CH3
2-хлорпропан
24.
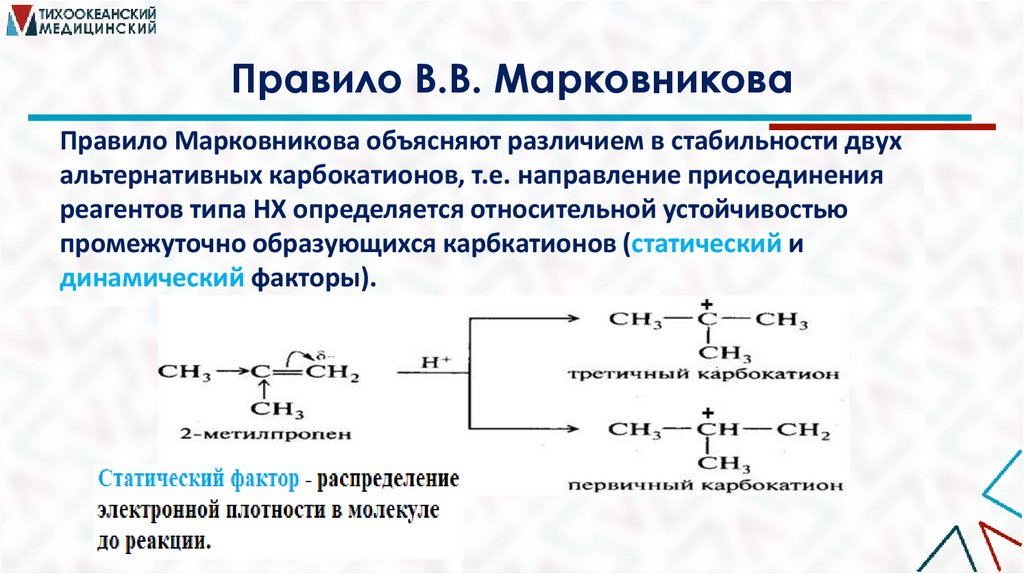
Правило В.В. МарковниковаПравило Марковникова объясняют различием в стабильности двух
альтернативных карбокатионов, т.е. направление присоединения
реагентов типа НХ определяется относительной устойчивостью
промежуточно образующихся карбкатионов (статический и
динамический факторы).
25.
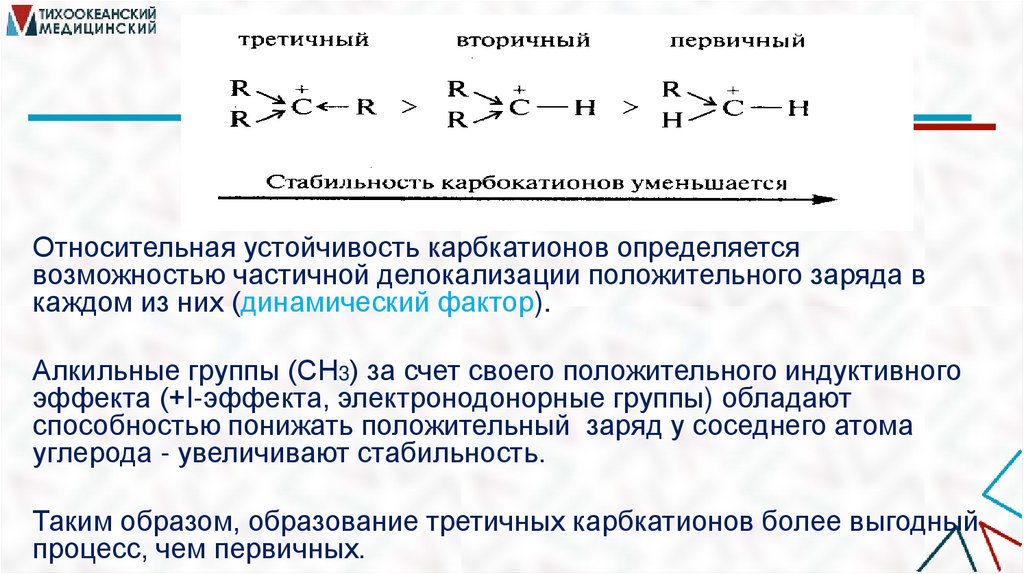
Относительная устойчивость карбкатионов определяетсявозможностью частичной делокализации положительного заряда в
каждом из них (динамический фактор).
Алкильные группы (СН3) за счет своего положительного индуктивного
эффекта (+I-эффекта, электронодонорные группы) обладают
способностью понижать положительный заряд у соседнего атома
углерода - увеличивают стабильность.
Таким образом, образование третичных карбкатионов более выгодный
процесс, чем первичных.
26.
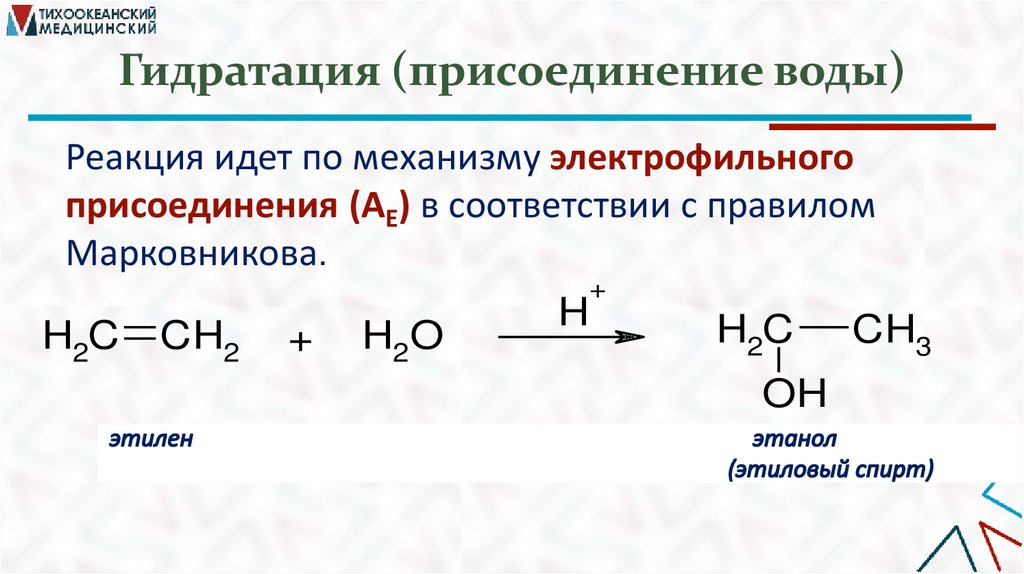
Гидратация (присоединение воды)Реакция идет по механизму электрофильного
присоединения (AE) в соответствии с правилом
Марковникова.
+
H2C
CH2
+
H2O
H
H2C
OH
CH3
27.
Механизм реакции гидратации алкенов (AE)+
H2C
CH
H3C
HC
H3C
CH2 CH3
+
HC
OH
CH2 CH3
CH2 CH3
H
HOH
+
+H
H2C
CH
+
H
CH2
H3C
HC
CH2
H
O
+
H
Электрофил H+, возникающий
при гетеролитическом разрыве
CH3
связи в молекуле H2SO4
(катализатор), атакует π-связь,
образуя неустойчивый
CH3
π-комплекс, который превращается в карбкатион (σ-комплекс).
Нуклеофильная атака молекулой
воды карбкатиона приводит к
образованию оксониевого иона
(положительный заряд на атоме
кислорода), при отщеплении от
которого иона водорода образуется
конечный продукт (соответствующий
спирт).
28.
* Биороль реакций AE*Расщепление жиров в организме, ЖК, углеводов.
*Процессы окисления в клетках ЖК липидов.
*Биосинтез БАВ: терпены, стероиды, гормоны.
*Процессы превращения в цикле Кребса (основной
катаболический путь) непредельных ЖК в
гидроксикислоты.
29.
Присоединение воды к двойной связи протекает в организмеи катализируется ферментами, например в цикле Кребса:
COOH
HC
CH
фумаратгидратаза
+
COOH
фумаровая кислота
Нижник Я.П.
http://norgchem.professorjournal.ru
H2O
COOH
HC
OH
CH2
COOH
яблочная кислота
30.
31.
Реакции электрофильного замещения (SE)Основной тип реакции для аренов – SЕ (sp2 гибридизованные атомы углерода), реагенты
галогены Hal2 (Cl2 , Br2), Н2SO4, НNО3,СН3Сl,
СН3СОСl.
π-электронное облако, расположенное нади под- плоскостью ароматического цикла
восприимчиво к атаке электрофилами.
32.
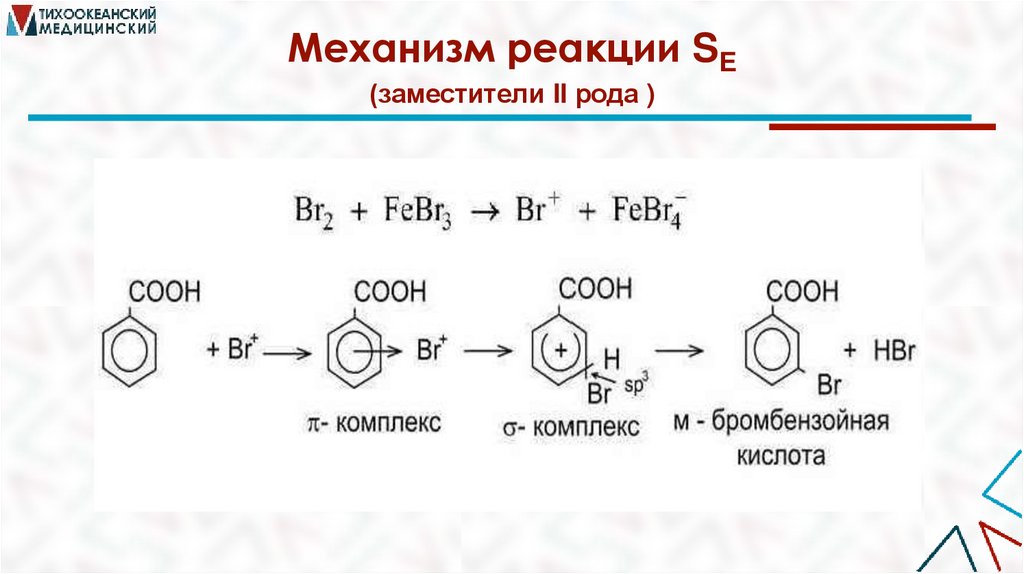
Реакции электрофильного замещения (SE)Атакующая частица — электрофил (положительно
заряженная частица или частица с дефицитом ē).
Уходящая частица — электрофуг. Процесс протекает в
4 стадии:
1. Генерирование электрофильной частицы.
2. Образование π–комплекса (быстрая стадия).
3. Образование σ–комплекса (медленная стадия).
4. Образование конечного ароматического продукта
реакции.
33.
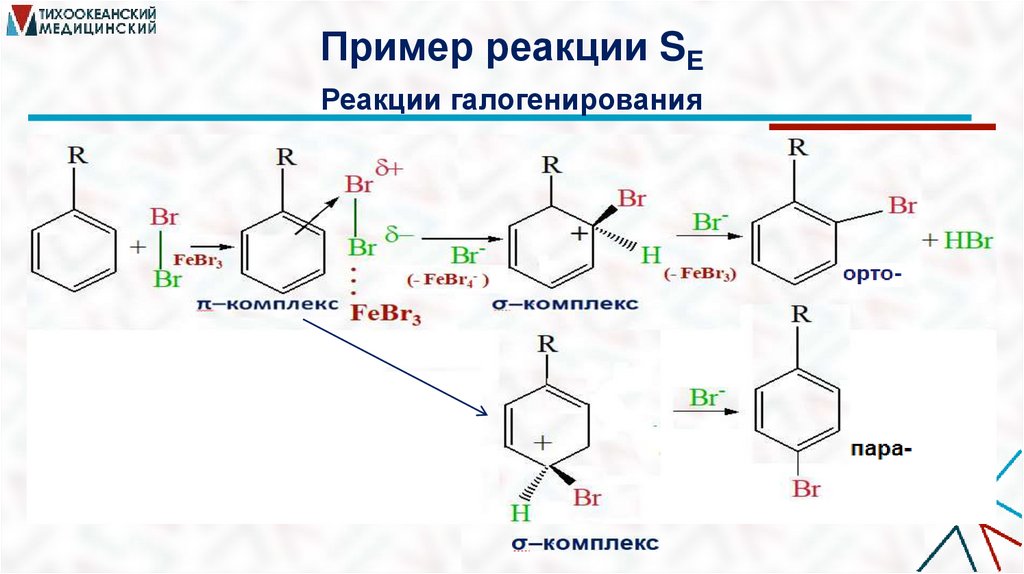
Пример реакции SEРеакции галогенирования
34.
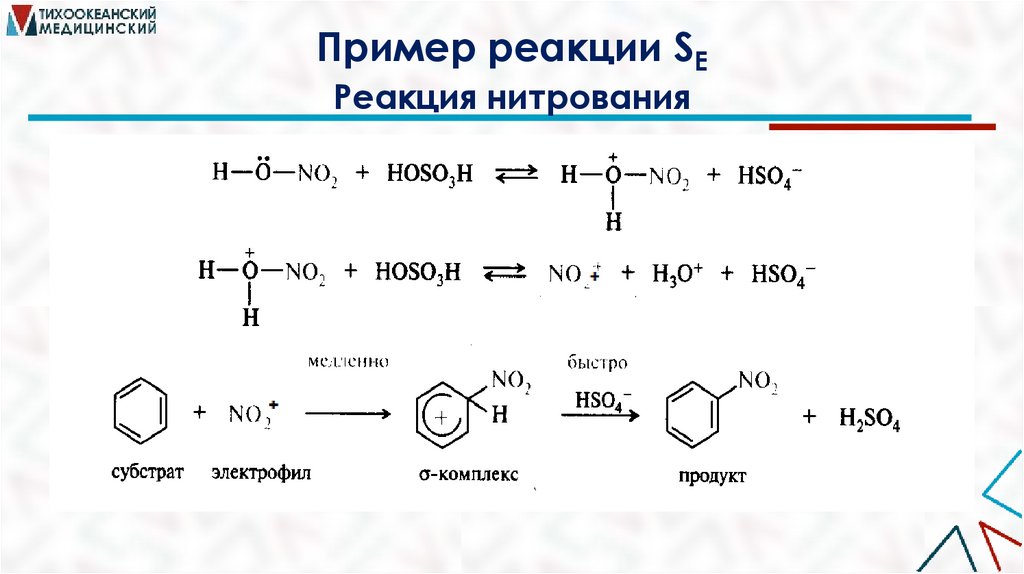
Пример реакции SEРеакция нитрования
35.
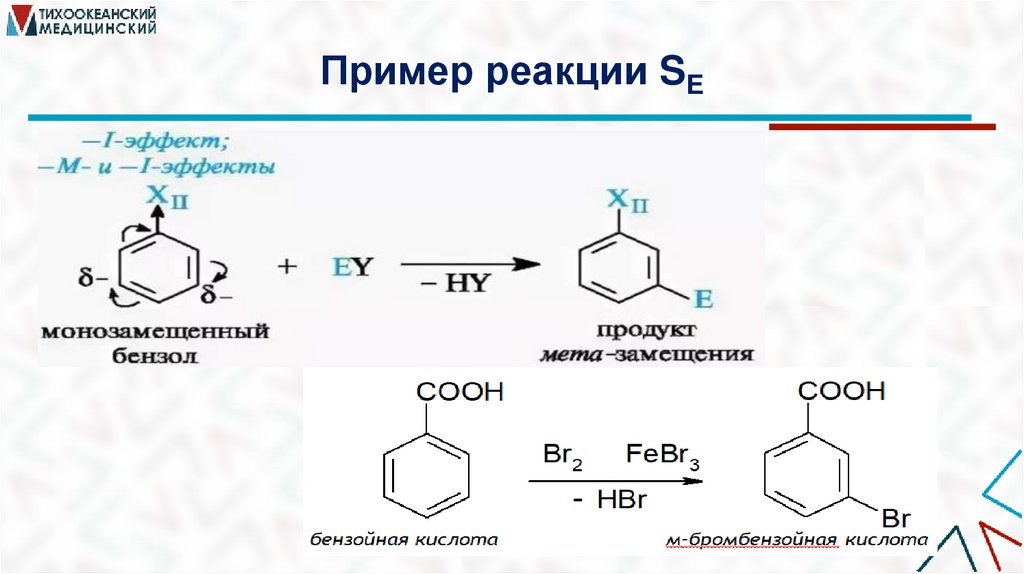
Ориентирующее действие заместителяПо ориентирующему и активирующему/дезактивирующему действию
заместители можно разделить на 3 группы:
1. Ориентанты первого рода: направляют электрофильное замещение в
орто- и пара-положения и активируют реакцию – она протекает легче,
чем с незамещённым бензолом. (алкильные группы, OH, NH2, CH3O)
2. Ориентанты второго рода: направляют электрофильное замещение в
мета-положения и дезактивируют реакцию – она протекает труднее, чем
с незамещённым бензолом. (COOH, CHO, CONH2, SO3H, NO2)
3. Галогены. Направляют электрофильное замещение в орто- и параположения и дезактивируют реакцию (F, Cl, Br, I).
36.
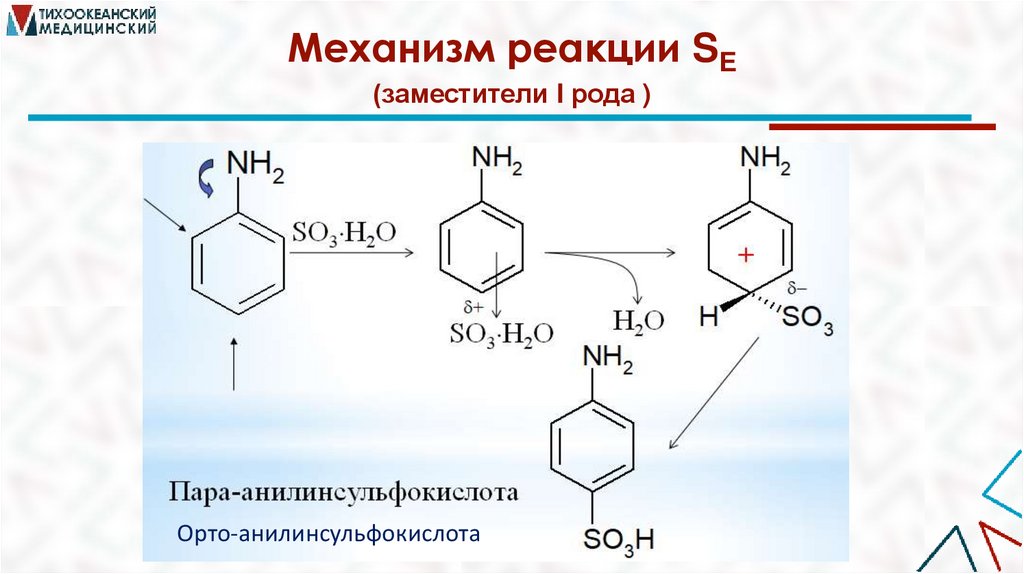
Механизм реакции SE(заместители I рода )
SE
Орто-анилинсульфокислота
37.
Пример реакции SE38.
Механизм реакции SE(заместители II рода )
39.
*Биологическая роль SE* Биосинтез ароматических гормонов и
аминокислот.
* Синтезы лекарственных препаратов:
сульфаниламидов, салицилатов,
антисептиков, гормональных препаратов,
сахарина и др.
40.
СПАСИБО ЗА ВНИМАНИЕЗавершающий слайд

























 Химия
Химия








