Похожие презентации:
Реакции осаждения
1.
Реакции осаждения2.
Протекание реакций осаждения приводит к образованиюгетерогенных систем, в которых насыщенный раствор и
осадок отделены друг от друга поверхностью раздела.
Способность осадка к растворению количественно
характеризуется величиной
Для электролитов -
AnBm ↔ nAx+ + mBy-
CaSO4 ↔ Ca2+ + SO42ПР = [Ca 2+] ∙ [SO42-]
Осадок труднорастворимого электролита образуется
только тогда, когда произведение концентраций
ионов превысит величину ПР.
Выпадает
Выпадает ли
ли осадок
осадок CaSO
CaSO44 при
(ПРсмешении
= 6.1 ·10-5) при смешении
22+
-2 моль/л ?
[SO
растворов
Na-3
моль/л,
[Ca
4 ]= 5·10
2SO
4 и CaCl
2 , ]= 5·10
если [SO42-]= 5·10-3 моль/л, [Ca2+]= 5·10-3 моль/л ?
2-]] ·· [Ca
2+]] =
-3 ·· 5·10
-3=2.5
-5
Ответ:
Ответ: [SO
[SO442[Ca2+
= 5·10
5·10-3
5·10-2
=2.5 ·10
·10-4
-5 <
-5
при
при данной
данной температуре
температуре ПР
ПР =
= 6.1
6.1 ·10
·10-5
> 2.5
2.5 ·10
·10-4
Поэтому
Поэтомуосадок
осадокне
образуется
образуется
3.
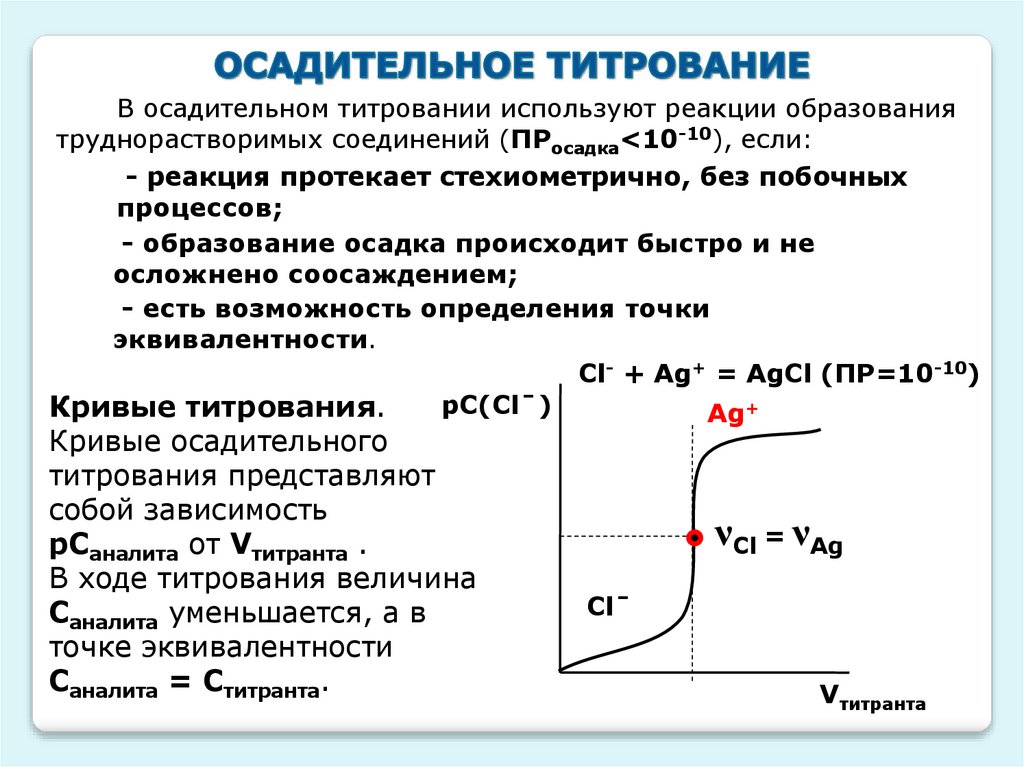
В осадительном титровании используют реакции образованиятруднорастворимых соединений (ПРосадка<10-10), если:
- реакция протекает стехиометрично, без побочных
процессов;
- образование осадка происходит быстро и не
осложнено соосаждением;
- есть возможность определения точки
эквивалентности.
Cl- + Ag+ = AgCl (ПР=10-10)
рС(Clˉ)
Кривые титрования.
Ag+
Кривые осадительного
титрования представляют
собой зависимость
рСаналита от Vтитранта .
В ходе титрования величина
Саналита уменьшается, а в
точке эквивалентности
Саналита = Ститранта.
νCl = νAg
Clˉ
Vтитранта
4.
В зависимости от реактива методы осаждения делятна:
аргентометрию, тиоцианатометрию, меркурометрию.
Метод:
Аргентометрия
Clˉ + Ag+ = AgCl
ПР=10-10
Реактив:
AgNO3 стандартизируют по NaCl или KCl
Аналит:
Clˉ, Brˉ
Индикатор: K2CrO4
Условия:
рН от 7 до 10
Мешают ионы NH4+, Ba2+, Sr2+, Pb2+, Bi3+
5.
В основе гравиметрического анализа лежит
реакция осаждения аналита реагентом-осадителем.
Особые требования предъявляются к полноте
осаждения определяемого компонента:
концентрация оставшегося неосаждённого иона в
растворе не должна превышать 10-6 моль/л.
• Аналитическим сигналом в гравиметрических
методах анализа является
чистого
компонента или его осажденной формы.
• Гравиметрия – это абсолютный (безэталонный)
метод, погрешность которого не превышает 0.1%.
6.
1. Обработка точной навески или точного объёма(аликвоты) анализируемой пробы реактивами для
перевода аналита в растворённое состояние.
2. Выбор реагента-осадителя и осаждение
соединения (осаждаемой формы), содержащего
определяемый компонент.
3. Фильтрование полученной смеси для
отделения осадка от надосадочной жидкости.
4. Промывание осадка для удаления
надосадочной жидкости и адсорбированных
примесей с его поверхности.
5. Высушивание или прокаливание осадка для
превращения его в более подходящую для
взвешивания гравиметрическую форму.
6. Взвешивание гравиметрической формы и
вычисление содержания аналита в пробе.
7.
m X F m гр .Масса гравиметрической формы mгр. прямо
пропорциональна массе аналита в пробе mX
F – гравиметрический фактор:
а MX
F
b M гр .
МХ – молекулярная масса определяемого вещества,
Мгр. – молекулярная масса гравиметрической формы,
a и b – числа, необходимые для уравнивания числа молей
определяемого компонента в числителе и знаменателе.
Например, при определении массы Fe в
пробе гравиметрической формой может
служить Fe2O3
2 M Fe
F
M Fe 2 O3







 Химия
Химия








