Похожие презентации:
Ионные уравнения
1. Ионные уравнения
2.
Реакции, протекающие между ионами, называютсяионными реакциями
Условия протекания реакций обмена между
сильными электролитами до конца:
1. Образование малорастворимого вещества (осадка ↓)
молекулярное уравнение:
AgNO3 + HCl → AgCl↓ + HNO3
полное ионное уравнение:
Ag+ + NO3- + H+ + Cl- → AgCl↓ + H+ + NO3сокращенное ионное уравнение:
Ag+ + Cl- → AgCl↓
3.
2. Образование газообразных или летучих веществNa2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
2Na+ + CO32- + 2H+ + 2Cl- → 2Na+ + 2Cl- + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
3. Образование малодиссоциирующих веществ –
слабых электролитов (вода, оксиды)
NaOH + HCl → NaCl + H2O
Na+ + OH- + H+ + Cl- → Na+ + Cl- + H2O
OH- + H+ → H2O
реакция нейтрализации
4.
Если исходными веществами являются сильныеэлектролиты,
которые
не
образуют
малорастворимых
или
малодиссоциирующих
веществ, то такие реакции не протекают.
Например,
2NaCl + Ca(NO3)2 = 2NaNO3 + CaCl2
2Na+ + 2Cl- + Ca 2+ +2NO3- 2Na+ +2NO3- + Ca 2+ +2Cl-
5.
Диссоциация воды.Водородный показатель
6.
Вода является очень слабым электролитом и диссоциируетпо уравнению:
H O H+ + OH2
При 250С [Н+] = [ОН-] = 10-7 моль/л.
Кдис[H2O] = [H+][OH-] = 10-14 = Кw
Произведение концентраций ионов водорода Н+
и гидроксид-ионов ОН- называется ионным
произведением воды Кw
7.
Водородный показатель рН - это отрицательный десятичный логарифм концентрацииионов водорода Н+
рН = lg [Н+]
если [Н+] = 10-7 моль/л , то рН = lg 10-7 = 7
среда раствора нейтральная
• если [Н+] > 10-7 моль/л, то рН < 7
среда раствора кислая, например,
[Н+] = 10-4 моль/л, то рН=4 < 7
•если [Н+] < 10-7 моль/л, то рН > 7
среда раствора щелочная
8.
Гидроксильный показатель рОНpОH = -lg[ОH-]
Кw= [H+][OH-] = 10-14
lg Кw= lg[H+] + lg[ОH-] = -14
рН + рОН = 14
9.
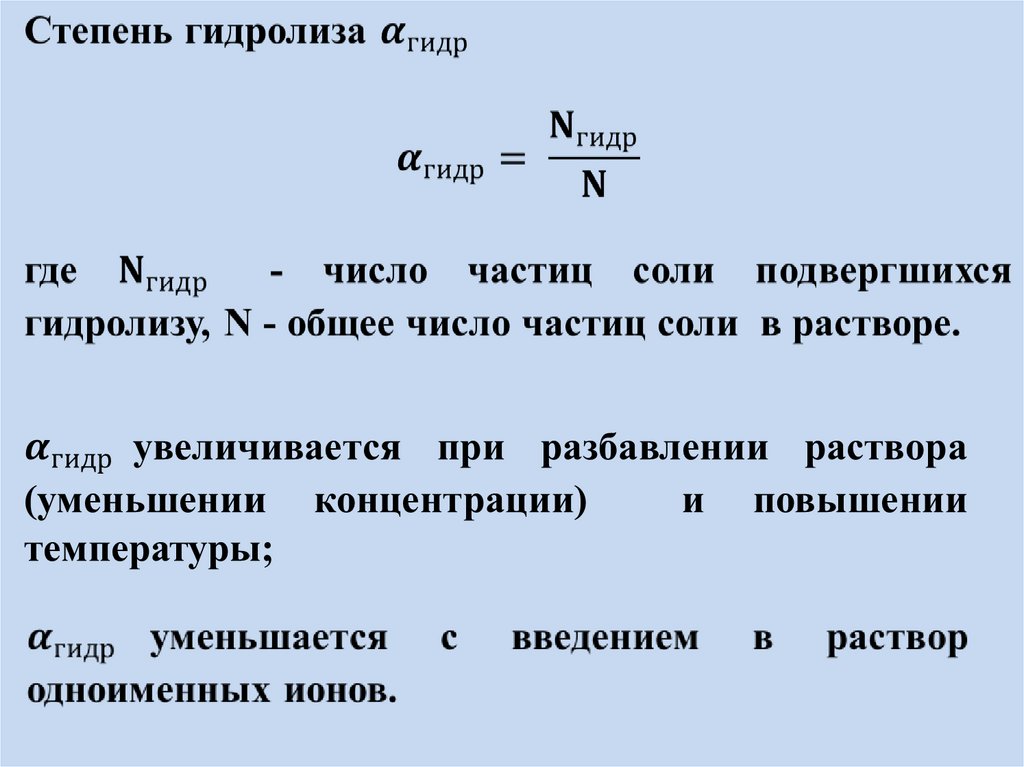
Реакции обменного разложения между водой инекоторыми солями называются гидролизом
В зависимости от силы исходной кислоты и
исходного основания, образовавших соль, выделяют 4
типа солей.
1. Соли, образованные сильной
кислотой и
сильным основанием (KCl, Na2SO4)
NaСl Na+ + ClNa+ +Cl- +HOH Cl- + Na+ + HOH
новых ионов не образуется ─ гидролиза нет
10.
2. Соли, образованные сильным основанием ислабой кислотой (CH3COONa, K2SO3).
Гидролиз по аниону :
1. Реакция среды - щелочная, рН>7.
2. При гидролизе солей, образованных слабыми
многоосновными кислотами образуются кислые соли
К2S - соль образована сильным основанием КОН и
слабой двухосновной кислотой Н2S. Если слабый
электролит,
образующий
соль,
подвергается
ступенчатой диссоциации, то и гидролиз идет
ступенчато: с водой взаимодействуют ионы слабой
кислоты – сульфид- S2- и гидросульфид- НS- ионы
11.
I ступеньК2S 2К+ + S2Сокращённое уравнение гидролиза:
S2- + НОН НS- + ОНПолное ионное уравнение гидролиза:
2К+ + S2- + НОН 2К+ + НS- + ОНК2S + НОН КНS + КОН
КНS - гидросульфид калия
II ступень
НS- + НОН Н2S + ОНК+ + НS- + НОН К+ + Н2S + ОНКНS + НОН Н2S + КОН.
обычно ограничиваются написанием уравнений
реакций, протекающих по первой ступени
12.
3. Соли, образованные сильной кислотой и слабымоснованием (Cu(NO3)2, Al2(SO4)3)
Гидролиз по катиону:
1. Среда кислая, рН<7.
2. При гидролизе солей, образованных слабыми
многокислотными
основные соли
основаниями
образуются
13.
I ступеньAlCl3 Al3+ + 3ClAl3+ + НОН AlОН2+ + Н+
Al3+ + 3Cl-+ НОН AlОН2+ +3Cl- + Н+
AlCl3 + НОН AlОНCl2 + НCl
AlОНCl2 – дихлорид гидроксоалюминия
II ступень
AlOH2+ + НОН Al(ОН)2+ + Н+
AlOH2+ + 2Cl- + НОН Al(ОН)2+ + 2Cl- + Н+
AlOHCl2 + НОН Al(ОН)2Cl + НCl.
Al(ОН)2Cl – хлорид дигидроксоалюминия
III ступень
Al(OH)2+ + НОН Al(ОН)3 + Н+
Al(OH)2+ + Cl- + НОН Al(ОН)3 + Cl- + Н+
Al(OH)2Cl + Н2О Al(ОН)3 + НCl.
14.
4. Соли, образованные слабой кислотой и слабымоснованием (Cr2(SO3)3, CH3COONH4 )
Гидролиз по катиону и по аниону.
1. Реакция среды или нейтральная, или
слабокислая, или слабощелочная.
2. Гидролиз может быть необратимым, если хотя бы
один из продуктов реакции гидролиза уходит из
сферы реакции.
15.
Fe2S3 2Fe3+ + 3S2─2Fe3+ + 6OH─ → 2Fe(OH)3↓
3S2─ + 6H+ → 3H2S↑
Fe2S3 + 6HOH → 2Fe(OH)3↓ + 3H2S↑
16.
17.
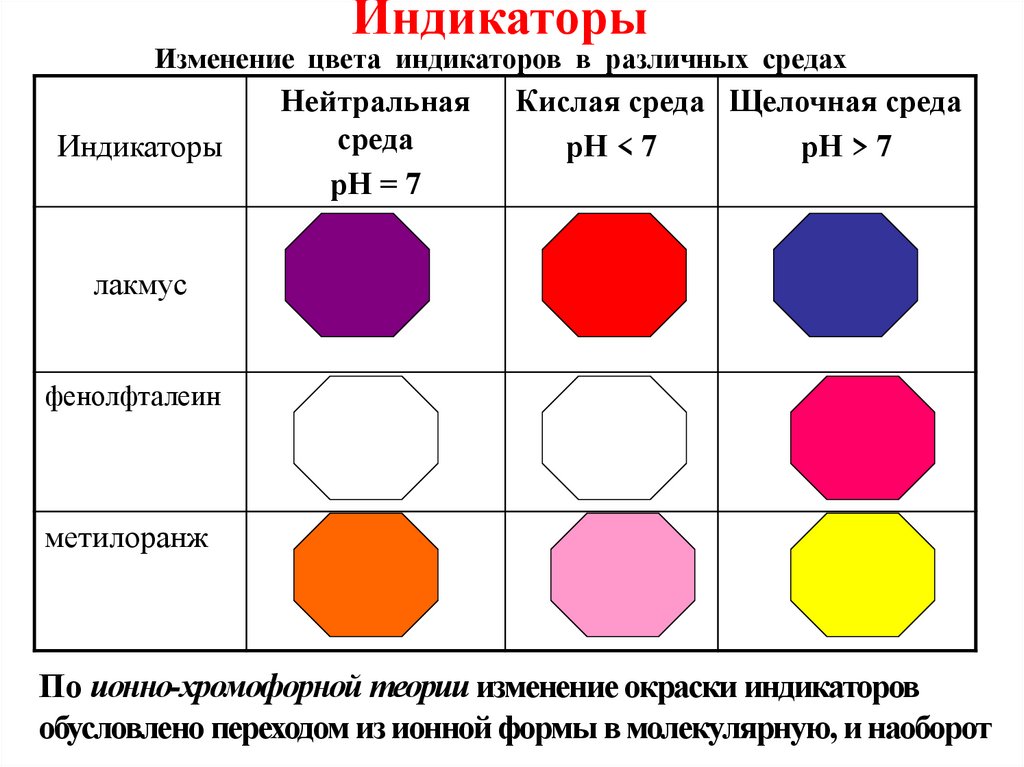
ИндикаторыИзменение цвета индикаторов в различных средах
Индикаторы
Нейтральная
среда
рН = 7
Кислая среда Щелочная среда
рН < 7
рН > 7
лакмус
фенолфталеин
метилоранж
По ионно-хромофорной теории изменение окраски индикаторов
обусловлено переходом из ионной формы в молекулярную, и наоборот














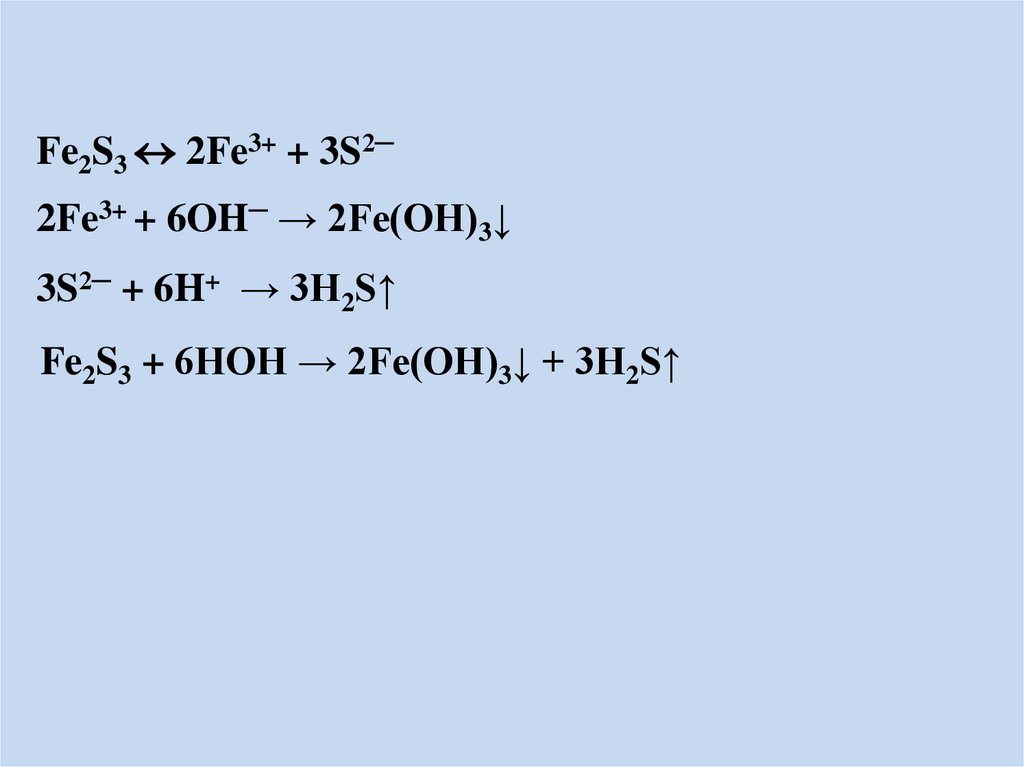
 Химия
Химия








