Похожие презентации:
Агрегатные состояния. Фазовые переходы
1.
2.
Объяснение свойств вещества,исходя из представлений о его
молекулярном строении,
составляет предмет
молекулярно-кинетической
теории вещества.
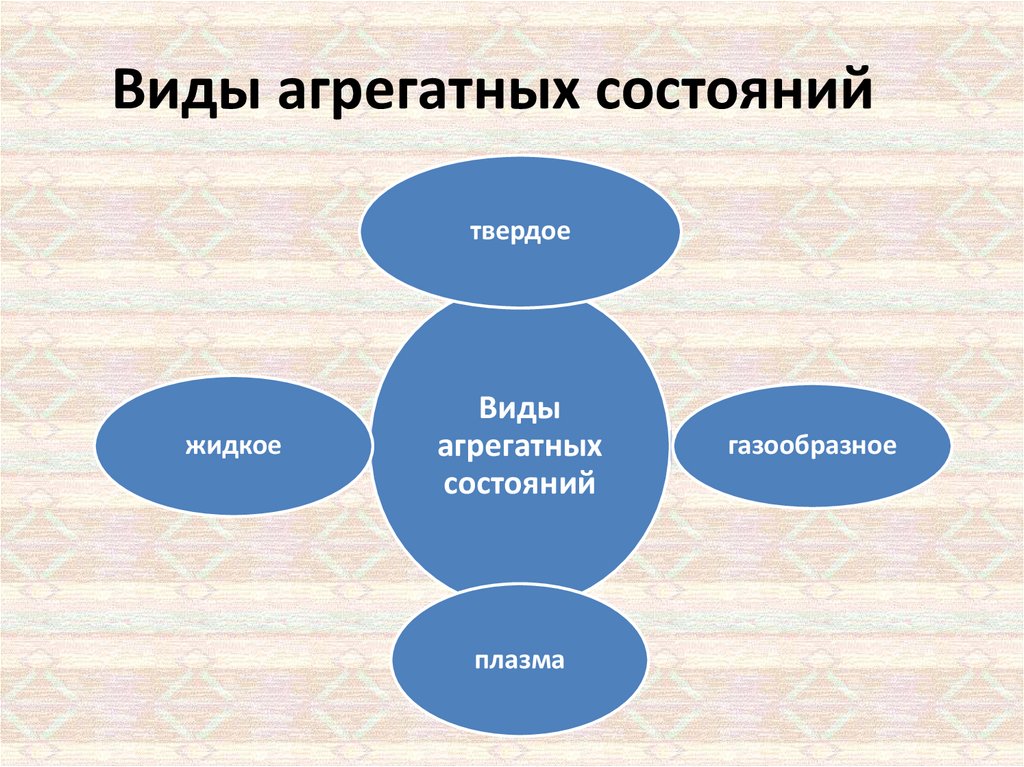
3. Виды агрегатных состояний
твердоежидкое
Виды
агрегатных
состояний
плазма
газообразное
4.
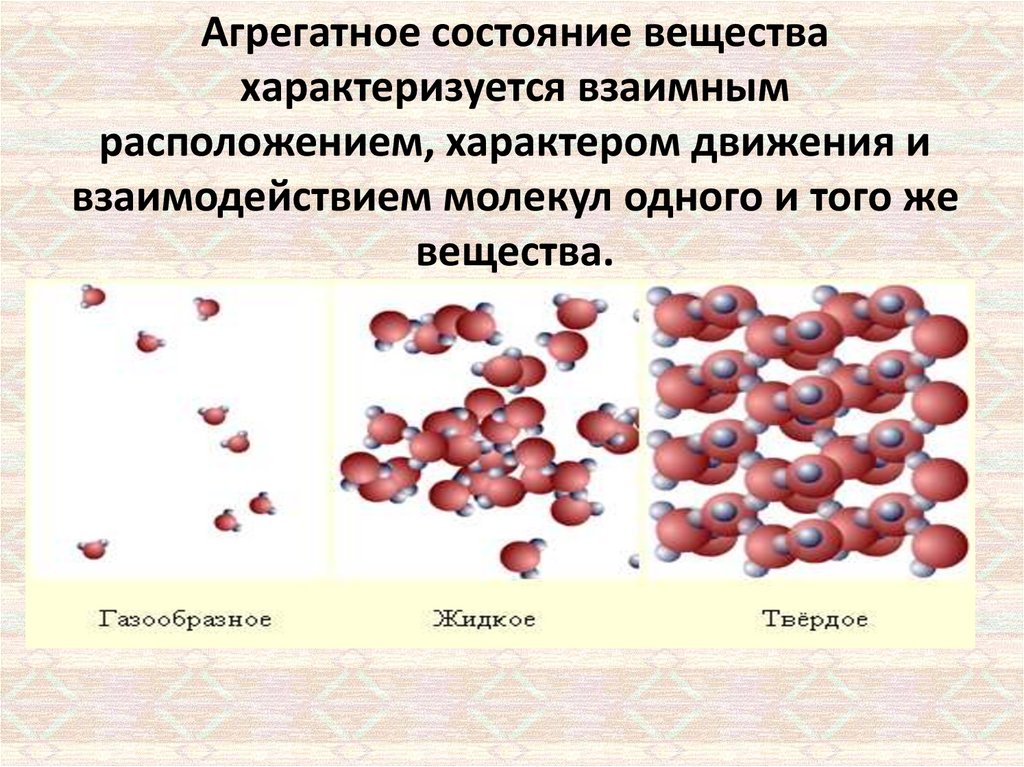
Агрегатное состояние веществахарактеризуется взаимным
расположением, характером движения и
взаимодействием молекул одного и того же
вещества.
5.
• Реализация того или иного агрегатногосостояния вещества зависит от соотношения
кинетической и потенциальной энергии
молекул, входящих в его состав.
• Потенциальная энергия молекулы
характеризует степень её связи с другими
частицами.
• Кинетическая энергия молекул препятствует
тенденции сцепления их между собой.
6.
Твердые кристаллические телаХарактеризуются в расположении равновесных
положений атомов
• Силы электрического отталкивания ядер молекул
противодействуют (на расстоянии, меньшем
диаметру молекулы) уменьшению расстояния
между молекулами, вызванному их взаимным
притяжением.
• Каждая молекула занимает определённый объём в
пространстве, притягивая соседние молекулы и
одновременно отталкивая их, не давая занять то
место, где она сама расположена.
Благодаря такому взаимодействию молекулы плотно
заполняют пространство.
• Молекулы в твёрдом теле располагаются
упорядоченно.
7. Твёрдое тело
ТВЕРДОЕ ТЕ́ЛО, агрегатное состояниевещества, отличающееся
стабильностью формы и характером
теплового движения атомов, которые
совершают малые колебания вокруг
положений равновесия. Различают
кристаллические и аморфные твердые
тела.
8.
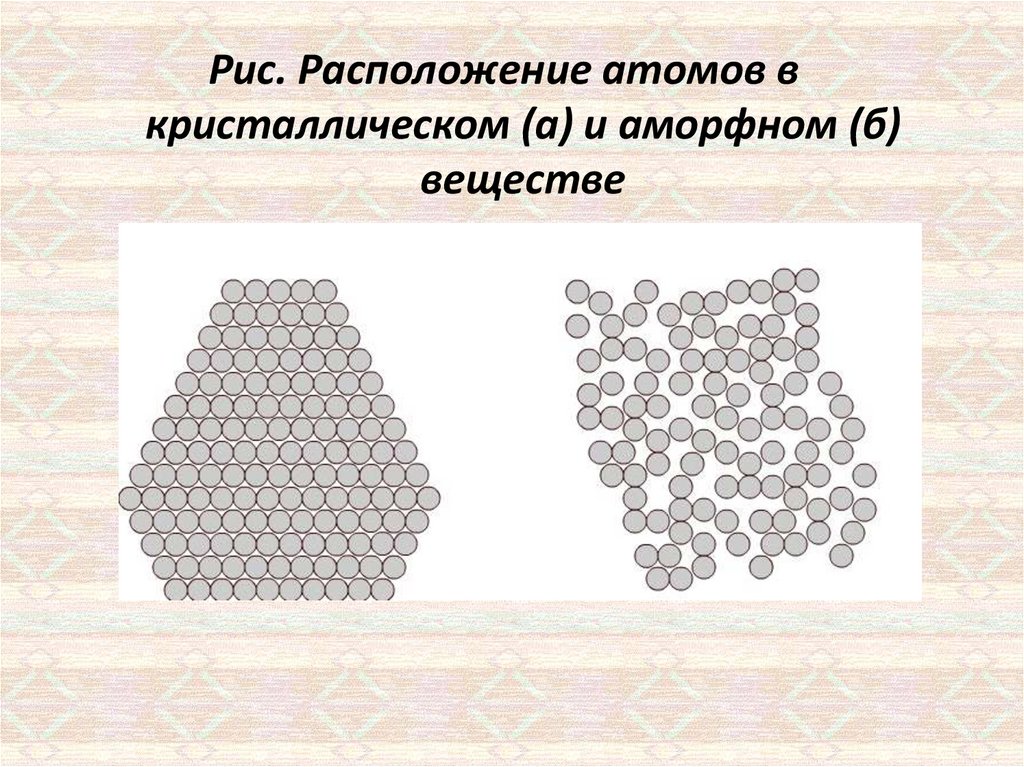
Рис. Расположение атомов вкристаллическом (а) и аморфном (б)
веществе
9.
Твёрдое кристаллическое тело10. Твёрдое кристаллическое тело
Типы кристаллических решеток11.
Положения равновесия, относительно которых происходяттепловые колебания частиц, называются узлами
кристаллической решетки.
Монокристалл — твердое тело, частицы которого образуют
единую кристаллическую решетку (одиночный кристалл).
Анизотропия монокристаллов. Одним из главных свойств
монокристаллов, которым они отличаются от жидкостей и
газов, является анизотропия их физических свойств.
Поликристалл — твердое тело, состоящее из беспорядочно
ориентированных монокристаллов. Поликристаллическими
являются большинство твердых тел, с которыми мы имеем
дело в быту — соль, сахар, различные металлические изделия.
Беспорядочная ориентация сросшихся микрокристалликов, из
которых они состоят, приводит к исчезновению анизотропии
свойств.
12.
• Аморфные тела – это твёрдые тела, гдесохраняется только ближний порядок в расположении
атомов. (Кремнезём, смола, стекло, канифоль, сахарный
леденец). (демонстрация схемы расположения молекул
кремнезема в кристаллическом и аморфном состоянии).
• Отличие в характере движения: частицы не только
совершают колебательные движения, но совершают скачки
(движения характерные для жидкой фазы состояния
вещества)
• С течением времени все аморфные тела перерождаются в
кристаллические. Только для разных веществ различны: для
сахара на это уходит несколько месяцев, а для камня
миллионы лет. Очень старое стекло становиться мутным,
потому что в нем образовывается масса мелких
непрозрачных кристалликов.
13.
Характерной особенностью аморфных телявляется их изотропность, т. е.
независимость всех физических свойств
(механических, оптических и т. д.) от
направления внешнего воздействия.
Молекулы и атомы в изотропных твердых
телах располагаются хаотично, образуя
лишь небольшие локальные группы,
содержащие несколько частиц (ближний
порядок).
Если аморфное тело нагревать, то оно
постепенно размягчается, и переход в
жидкое состояние занимает значительный
интервал температур.
14.
Свойства аморфных тел.• В аморфных твердых телах атомы
колеблются около хаотически
расположенных точек
• Сохраняют форму и объем.
• Не имеют строгого порядка расположения
частиц.
• Отсутствие постоянной температуры
плавления (пример изменения формы тела на
основе поделки из пластеина и свечи).
• Текучесть.
• Изотропия свойств (слайд о механическом
воздействии на образ слюды и стекла).
15.
При нагревании твёрдого тела средняякинетическая энергия молекул, колеблющихся
около положения равновесия, возрастает. Рост
кинетической энергии молекулы приводит к
увеличению амплитуды её колебаний.
Уменьшение энергии связи при нагревании
позволяет молекулам перескакивать из
одного положения равновесия в другое. В
результате нарушается правильное
расположение частиц, характерное для
кристаллической решётки твердого тела.
Происходит фазовый переход вещества из
твёрдого состояния в жидкое.
16.
При фазовом переходе твёрдое тело –жидкость происходит нарушение
симметрии системы. Относительные
положения молекул в жидкости не
фиксированы.
17.
ГА́З (франц. gaz, от греч. chaos — хаос),агрегатное состояние вещества, в
котором составляющие его атомы и
молекулы почти свободно и хаотически
движутся в промежутках между
столкновениями, во время которых
происходит резкое изменение характера
их движения.
18.
Свойства большинства газов — прозрачность,бесцветность и легкость — затрудняло их
изучение, поэтому физика и химия газов
развивались медленно. Только в 17 в. было
доказано, что воздух обладает весом (Э.
Торричелли и Б. Паскаль). Тогда же Я. ван Гельмонт
ввел термин газы для обозначения
воздухоподобных веществ. И только к середине 19
в. были установлены основные закономерности,
которым подчиняются газы.
Наиболее полно изучены были свойства достаточно
разряженных газов, в которых расстояния между
молекулами при нормальных условиях порядка 10
нм, что значительно больше радиуса действия сил
межмолекулярного взаимодействия. Такой газ,
молекулы которого рассматриваются как
невзаимодействующие материальные точки,
называется идеальным газом.
19.
Любое вещество можно перевести в газообразное состояниесоответствующим подбором давления и температуры.
Поэтому возможную область существования газообразного
состояния графически изображают в переменных: давление р
— температура Т (на р-Т-диаграмме).
Существует критическая температура Тк, ниже которой эта
область ограничена кривыми сублимации (возгонки) и
парообразования, т. е. при любом давлении ниже
критического рк существует температура Т, определяемая
кривой сублимации или парообразования, выше которой
вещество становится газообразным.
При температурах ниже Тк можно сконденсировать газ —
перевести его в другое агрегатное состояние (твердое или
жидкое). При этом фазовое превращение газа в жидкость или
твердое тело происходит скачкообразно: незначительное
изменение давления приводит к изменению ряда свойств
вещества (например, плотности, энтальпии, теплоемкости
и др.). Процессы конденсации газов, особенно сжижение газов,
имеют важное техническое значение.
20.
Жидкость• Вещество находится в жидком
состоянии, если средняя кинетическая
энергия молекул соизмерима со средней
потенциальной энергией их притяжения.
21.
ЖИ́ДКОСТЬ, агрегатное состояние вещества,сочетающее в себе черты твердого
состояния (сохранение объема, определенная
прочность на разрыв) и газообразного
(изменчивость формы).
Для жидкости характерны ближний порядок в
расположении частиц (молекул, атомов) и
малое различие в кинетической энергии
теплового движения молекул и их
потенциальной энергии взаимодействия.
Тепловое движение молекул жидкости состоит
из колебаний около положений равновесия и
сравнительно редких перескоков из одного
равновесного положения в другое, с этим
связана текучесть жидкости.
22.
• Под действием внешней силы жидкостьтечет, сохраняя свой объем, и принимает
форму сосуда.
• Сжимаемость жидкости невелика и мало
отличается от сжимаемости
кристаллических твердых тел из-за
примерно одинаковой плотности упаковки
частиц вещества в этих агрегатных
состояниях.
23.
ПЛА́ЗМА(от греч. plasma — вылепленное, оформленное),
ионизованный газ, в котором концентрации
положительных и отрицательных зарядов равны
(квазинейтральность). В состоянии плазмы
находится подавляющая часть вещества
Вселенной: звезды, галактические туманности и
межзвездная среда. Около Земли плазма
существует в виде солнечного ветра,
магнитосферы и ионосферы.
Высокотемпературная плазма (Т ~ 106 — 108К) из
смеси дейтерия и трития исследуется с целью
осуществления управляемого термоядерного
синтеза. Низкотемпературная плазма (Т Ј 105К)
используется в различных газоразрядных
приборах (газовых лазерах, ионных приборах,
МГД-генераторах, плазмотронах, плазменных
двигателях и т. д.), а также в технике (см.
24.
Переход системы из одного агрегатногосостояния в другое называется
ФАЗОВЫМ ПЕРЕХОДОМ
При фазовом переходе скачкообразно
изменяется какая-либо физическая величина
или симметрия системы.
25. Жидкость
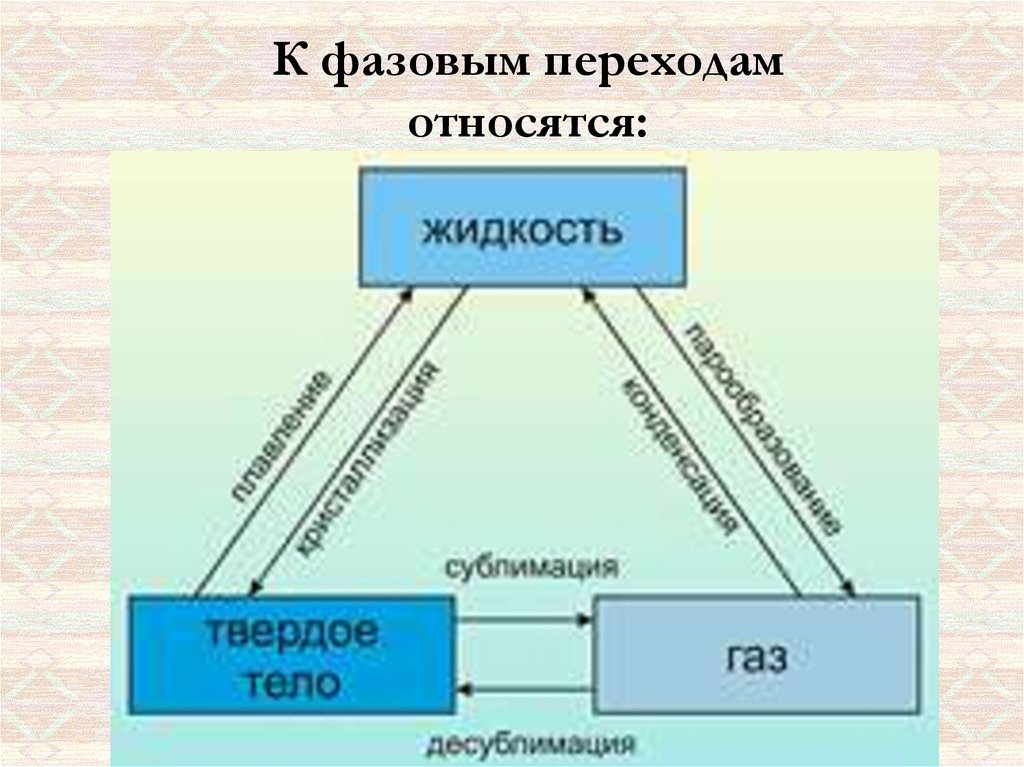
К фазовым переходамотносятся:
26.
27.
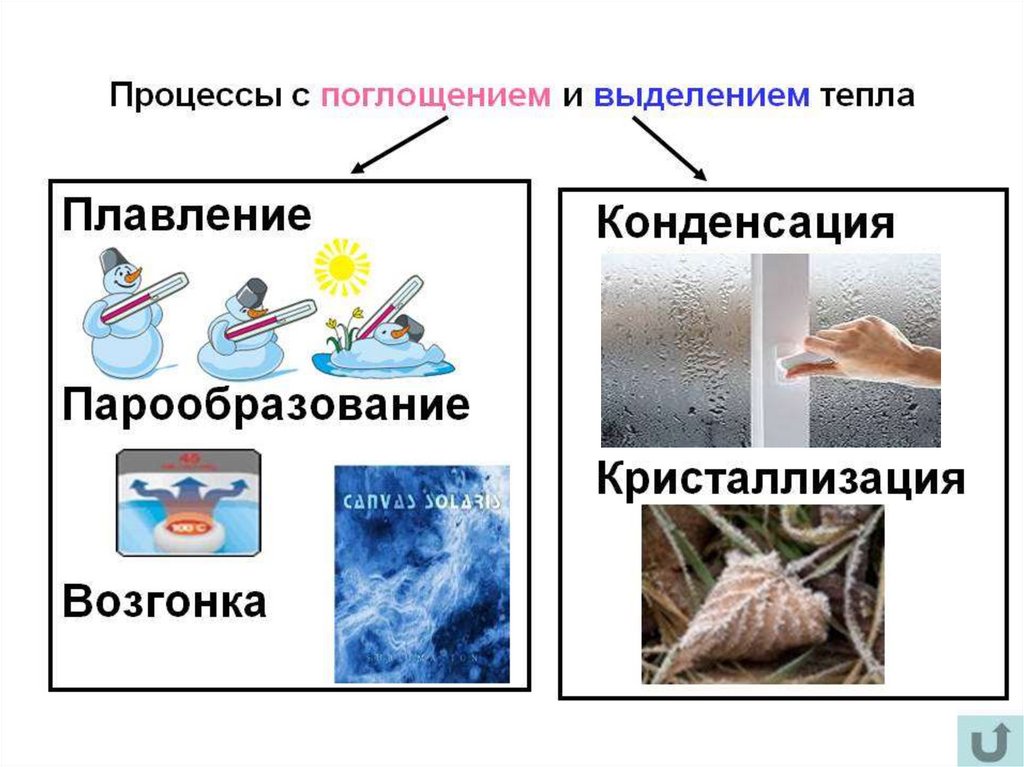
• собой.Плавление - переход тела из кристаллического твёрдого состояния в
жидкое. Плавление происходит с поглощением удельной теплоты
плавления и является фазовым переходом первого рода.
Способность плавиться относится к физическим свойствам вещества
При нагревании увеличивается температура вещества, и возрастает
скорость теплового движения частиц , при этом увеличивается внутренняя
энергия тела.
Когда температура твердого тело достигает температуры плавления ,
кристаллическая решетка твердого вещества начинает разрушаться.
Таким образом, основная часть энергия нагревателя, пдводимая к
твердому телу, идет на уменьшение связей между частицами вещества, т. е.
на разрушение кристаллической решетки.
При этом возрастает энергия взаимодействия между частицами.
Расплавленное вещество обладает большим запасом внутренней энергии,
чем в твердом состоянии.
Оставшаяся часть теплоты плавления расходуется на совершение работы
по изменению объема тела при его плавлении.
28.
• Присобой.
плавлении объем большинства кристаллических тел увеличивается
(на 3-6%), а при отвердевании уменьшается.
Но, существуют вещества, у которых при плавлении объем уменьшается, а
при отвердевании - увеличивается.
К ним относятся, например, вода и чугун, кремний и некоторые другие. .
Именно поэтому лёд плавает на поверхности воды, а твердый чугун - в
собственном расплаве. Твердые тела, называемые аморфными ( янтарь,
смола, стекло) не имеют определенной температуры плавления
Количество теплоты, необходимой для плавления вещества,
равно произведению удельной теплоты плавления на массу
данного вещества.
Удельная теплота плавления показывает, какое кол теплоты необходимо для
полного превращения 1 кг вещества из твердого состояния в жидкое, взятого
при темп плавления.
Единицей удельной теплоты плавления в СИ служит 1Дж/кг.
В процессе плавления температура кристалла остается постоянной. Эта
температура называется температурой плавления. У каждого вещества своя
температура плавления.
Температура плавления для данного вещества зависит от атмосферного
давления.
У кристаллических тел при температуре плавления можно наблюдать
вещество одновременно
в твердом и жидком состояниях.
29.
• собой.Испарением называется фазовый переход из жидкого состояния в
газообразное. С точки зрения молекулярно-кинетической теории, испарение –
это процесс, при котором с поверхности жидкости вылетают наиболее
быстрые молекулы, кинетическая энергия которых превышает энергию их
связи с остальными молекулами жидкости. Это приводит к уменьшению
средней кинетической энергии оставшихся молекул, т. е. к охлаждению
жидкости (если нет подвода энергии от окружающих тел). При этом жидкость
покидают более быстрые молекулы, обладающие большей скоростью.
При любой температуре в жидкости находятся такие молекулы,
которые обладают достаточной кинетической энергией, чтобы
преодолеть силы сцепления между молекулами и совершить
работу выхода из жидкости. Скорость испарения жидкости
зависит от:
1) от рода вещества;
2) от площади поверхности испарения;
3) от температуры жидкости;
4) от скорости удаления паров с поверхности жидкости, т.е. от наличия ветра.
30.
• собой.Испарение происходит при любой температуре.
С повышением температуры скорость испарения жидкости возрастает, так
как возрастает средняя кинетическая энергия ее молекул, а следовательно,
возрастает и число таких молекул, у которых кинетическая энергия достаточна
для испарения.
Скорость испарения возрастает и при ветре, который удаляет с поверхности
жидкости ее пар и тем самым препятствует возвращению молекул в жидкость.
Конденсация – это процесс, обратный процессу испарения. При конденсации
молекулы пара возвращаются в жидкость. При испарении температура
жидкости понижается, т.к. внутренняя энергия жидкости уменьшается
из-за потери быстрых молекул.
Но, если подводить к жидкости тепло, то ее температура может не изменяться.
31.
• собой.Иониза́ция — эндотермический процессобразования ионов из нейтральных атомов или
молекул.
Положительно заряженный ион образуется,
если электрон в атоме или молекуле получает
достаточную энергию для преодоления
потенциального барьера, равную
ионизационному потенциалу. Отрицательно
заряженный ион, наоборот, образуется при
захвате дополнительного электрона атомом с
высвобождением энергии.
32.
Сублимация (возго́нка) — переход вещества изтвёрдого состояния сразу в газообразное, минуя жидкое.
Поскольку при возгонке изменяется удельный объём
вещества и поглощается энергия (теплота сублимации),
возгонка является фазовым переходом первого рода.
Обратным процессом является десублимация. Примером
десублимации являются такие атмосферные явления, как
иней на поверхности земли и изморозь на ветвях деревьев
и проводах.


























 Физика
Физика








