Похожие презентации:
Агрегатные состояния вещества
1.
2.
Объяснение свойств вещества,исходя из представлений о его
молекулярном строении,
составляет предмет молекулярнокинетической
теории вещества.
3. Виды агрегатных состояний
твердоежидкое
Виды
агрегатны
х
состояний
плазма
газообразное
4.
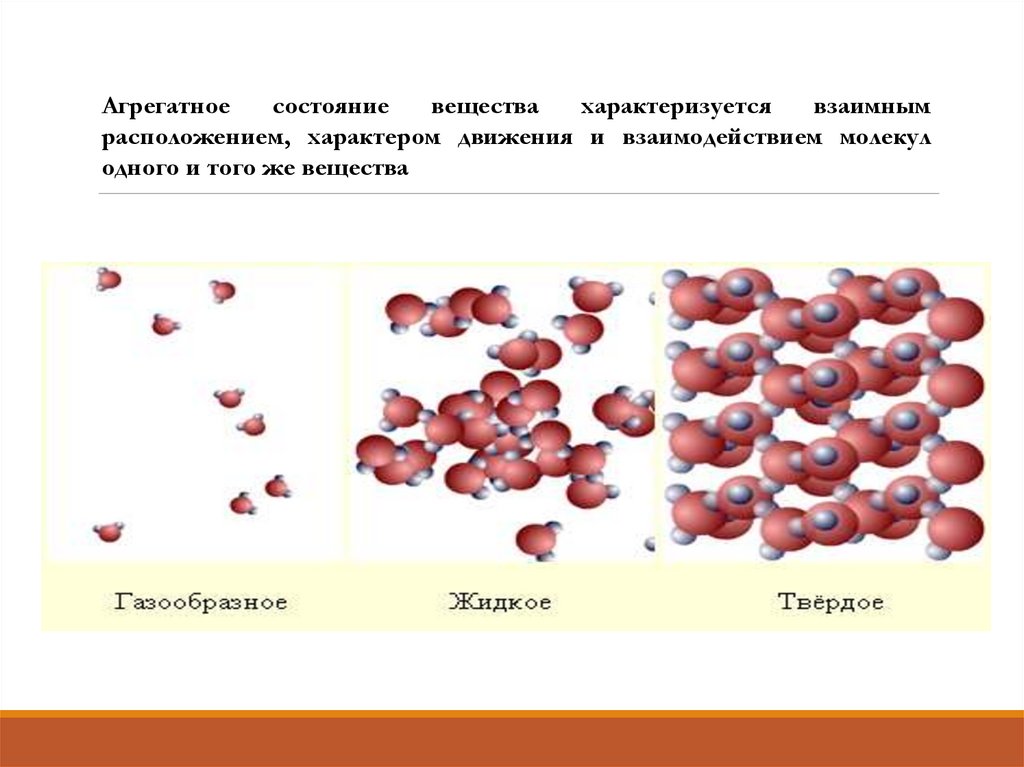
Агрегатноесостояние
вещества
характеризуется
взаимным
расположением, характером движения и взаимодействием молекул
одного и того же вещества
5.
Реализация того или иного агрегатного состояния вещества зависит отсоотношения кинетической и потенциальной энергии молекул, входящих в
его состав.
Потенциальная энергия молекулы характеризует степень её связи с
другими частицами.
Кинетическая энергия молекул препятствует тенденции сцепления их
между собой.
6. Твёрдое тело
ТВЕРДОЕТЕ́ЛО,
агрегатное
состояние
вещества, отличающееся стабильностью
формы и характером теплового движения
атомов,
которые
совершают
малые
колебания вокруг положений равновесия.
Различают кристаллические и аморфные
твердые тела.
7.
Твёрдое кристаллическое тело8. Твёрдое кристаллическое тело
Типы кристаллических решеток9.
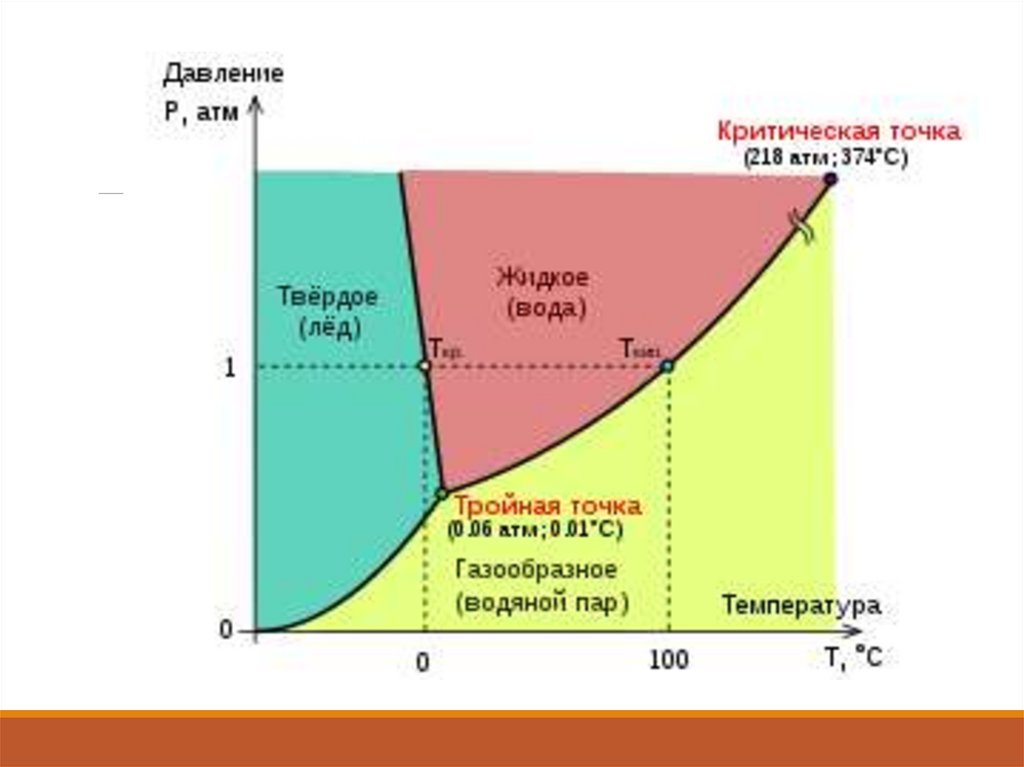
Любое вещество можно перевести в газообразное состояниесоответствующим подбором давления и температуры. Поэтому
возможную область существования газообразного состояния
графически изображают в переменных: давление р — температура Т
(на р-Т-диаграмме).
Существует критическая температура Тк, ниже которой эта область
ограничена кривыми сублимации (возгонки) и парообразования, т. е.
при любом давлении ниже критического рк существует температура
Т, определяемая кривой сублимации или парообразования, выше
которой вещество становится газообразным.
При температурах ниже Тк можно сконденсировать газ — перевести
его в другое агрегатное состояние (твердое или жидкое). При этом
фазовое превращение газа в жидкость или твердое тело происходит
скачкообразно: незначительное изменение давления приводит к
изменению ряда свойств вещества (например, плотности, энтальпии,
теплоемкости и др.). Процессы конденсации газов, особенно сжижение
газов, имеют важное техническое значение.
10.
Переход системы из одного агрегатногосостояния в другое называется
ФАЗОВЫМ ПЕРЕХОДОМ
При фазовом переходе скачкообразно изменяется какая-либо физическая
величина или симметрия системы.
11.
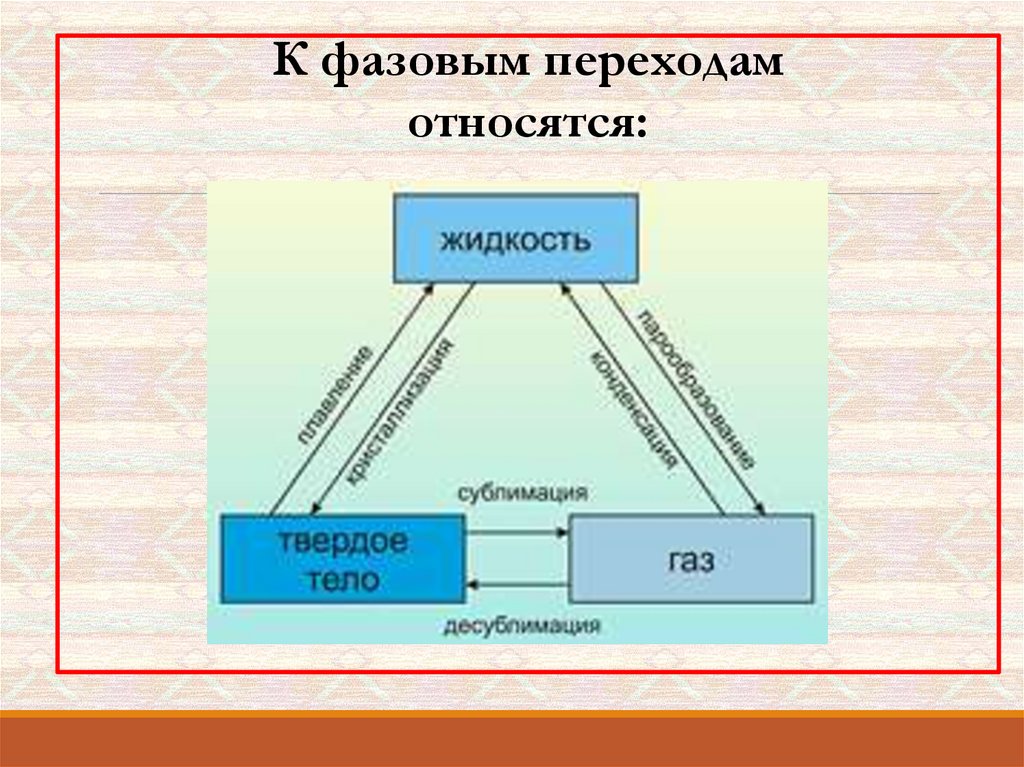
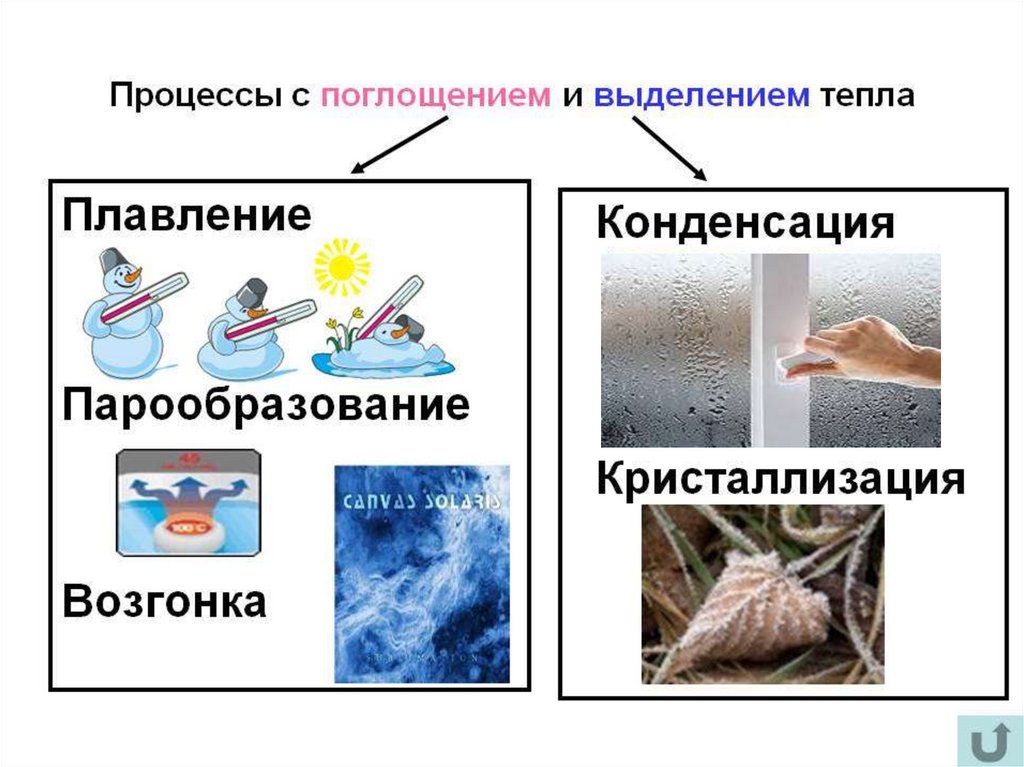
К фазовым переходамотносятся:
12.
13.
Плавление - переход тела из кристаллического твёрдого состояния вжидкое. Плавление происходит с поглощением удельной теплоты
плавления и является фазовым переходом первого рода.
Способность плавиться относится к физическим свойствам вещества
При нагревании увеличивается температура вещества, и возрастает
скорость теплового движения частиц , при этом увеличивается внутренняя
энергия тела.
Когда температура твердого тело достигает температуры плавления ,
кристаллическая решетка твердого вещества начинает разрушаться.
Таким образом, основная часть энергия нагревателя, пдводимая к
твердому телу, идет на уменьшение связей между частицами вещества, т. е.
на разрушение кристаллической решетки.
При этом возрастает энергия взаимодействия между частицами.
Расплавленное вещество обладает большим запасом внутренней энергии,
чем в твердом состоянии.
Оставшаяся часть теплоты плавления расходуется на совершение работы
по изменению объема тела при его плавлении.
14.
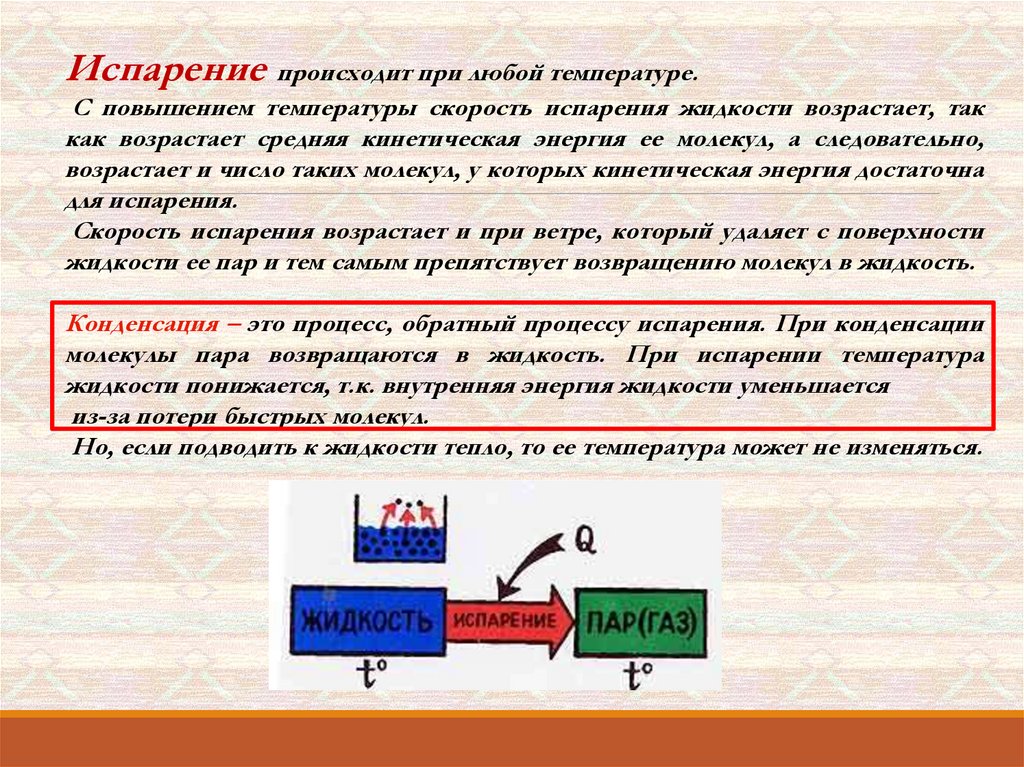
Испарением называется фазовый переход из жидкого состояния вгазообразное. С точки зрения молекулярно-кинетической теории, испарение –
это процесс, при котором с поверхности жидкости вылетают наиболее
быстрые молекулы, кинетическая энергия которых превышает энергию их
связи с остальными молекулами жидкости. Это приводит к уменьшению
средней кинетической энергии оставшихся молекул, т. е. к охлаждению
жидкости (если нет подвода энергии от окружающих тел). При этом жидкость
покидают более быстрые молекулы, обладающие большей скоростью.
При любой температуре в жидкости находятся такие молекулы,
которые обладают достаточной кинетической энергией, чтобы
преодолеть силы сцепления между молекулами и совершить
работу выхода из жидкости. Скорость испарения жидкости
зависит от:
1) от рода вещества;
2) от площади поверхности испарения;
3) от температуры жидкости;
4) от скорости удаления паров с поверхности жидкости, т.е. от наличия ветра.
15.
Испарение происходит при любой температуре.С повышением температуры скорость испарения жидкости возрастает, так
как возрастает средняя кинетическая энергия ее молекул, а следовательно,
возрастает и число таких молекул, у которых кинетическая энергия достаточна
для испарения.
Скорость испарения возрастает и при ветре, который удаляет с поверхности
жидкости ее пар и тем самым препятствует возвращению молекул в жидкость.
Конденсация – это процесс, обратный процессу испарения. При конденсации
молекулы пара возвращаются в жидкость. При испарении температура
жидкости понижается, т.к. внутренняя энергия жидкости уменьшается
из-за потери быстрых молекул.
Но, если подводить к жидкости тепло, то ее температура может не изменяться.
16.
Иониза́ция — эндотермический процесс образованияионов из нейтральных атомов или молекул.
Положительно заряженный ион образуется, если
электрон в атоме или молекуле получает достаточную
энергию для преодоления потенциального барьера,
равную ионизационному потенциалу. Отрицательно
заряженный ион, наоборот, образуется при захвате
дополнительного электрона атомом с высвобождением
энергии.
17.
Сублимация (возго́нка) — переход вещества из твёрдогосостояния сразу в газообразное, минуя жидкое. Поскольку
при возгонке изменяется удельный объём вещества и
поглощается энергия (теплота сублимации), возгонка
является фазовым переходом первого рода.
Обратным процессом является десублимация. Примером
десублимации являются такие атмосферные явления,
как иней на поверхности земли и изморозь на ветвях
деревьев и проводах.











 Физика
Физика








