Похожие презентации:
Хлор
1.
ХлорХимический элемент
2.
Цель: характеризовать особенности строения исвойств хлора как представителя галогенов
Прогнозируемый результат
1. Давать характеристику хлору как химическому
элементу (вспоминаем 8 класс)
2. Описывать по плану хлор как простое вещество
3. Приводить аргументы в подтверждение
принадлежности хлора к семейству галогенов
4. Объяснять особые свойства хлора, подтверждая
конкретными примерами
3.
Опасный, но необходимый…В 1916 г. в первую мировую войну
немцы впервые использовали
отравляющие вещества в войне с
англичанами. В результате этой
атаки пострадали 1500 тыс.
человек.
96%
отравляющих
веществ содержат этот элемент в
соединениях.
?
4.
Опасный, но необходимый…Не путаем! В каком случае речь идет о хлоре как о химическом
элементе, в каком как о простом веществе?
Хлор
Химический
элемент
Простое
вещество
5.
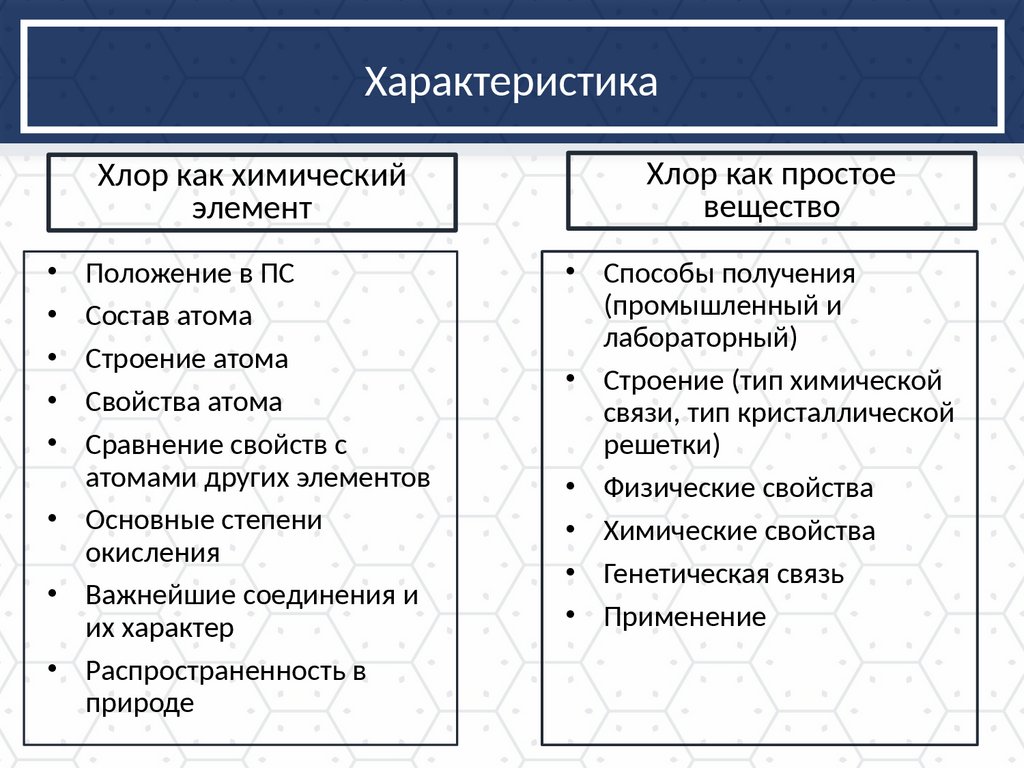
ХарактеристикаХлор как химический
элемент
Хлор как простое
вещество
Положение в ПС
Состав атома
Строение атома
Свойства атома
Сравнение свойств с
атомами других элементов
• Основные степени
окисления
• Важнейшие соединения и
их характер
• Распространенность в
природе
• Способы получения
(промышленный и
лабораторный)
• Строение (тип химической
связи, тип кристаллической
решетки)
• Физические свойства
• Химические свойства
• Генетическая связь
• Применение
6.
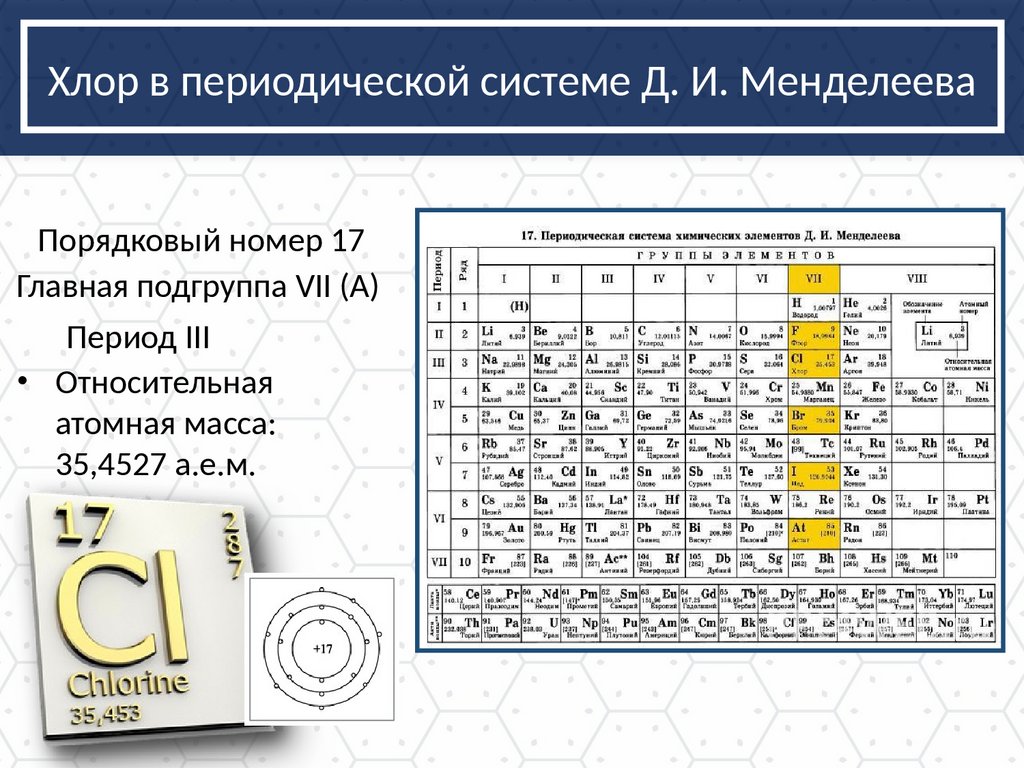
Хлор в периодической системе Д. И. МенделееваПорядковый номер 17
Главная подгруппа VII (А)
Период III
• Относительная
атомная масса:
35,4527 а.е.м.
7.
Нахождение Cl в природеВ природе хлор встречается только в виде
соединений в составе минералов, поскольку он
очень активен
Галит NaCl
(соль)
Сильвин KCl
Сильвинит
KCl · NaCl
8.
Нахождение Cl в природеВ земной коре хлор - самый распространённый
галоген.
Содержание хлора в земной коре составляет
0,013%
Самые большие запасы хлора содержатся в составе
солей вод морей и океанов.
Содержание Cl в морской воде в среднем около
18,8 г/л
9.
Хлор – простоевещество
10.
Получение хлора 1774 гДля получения хлора в свободном состоянии надо
окислить его ионы
Карл Шееле
«Я поместил смесь черной магнезии с муриевой кислотой
в реторту, к горлышку которой присоединил пузырь,
лишенный воздуха, и поставил ее на песчаную баню.
Пузырь наполнился газом, который имел желто-зеленый
цвет и пронзительный запах».
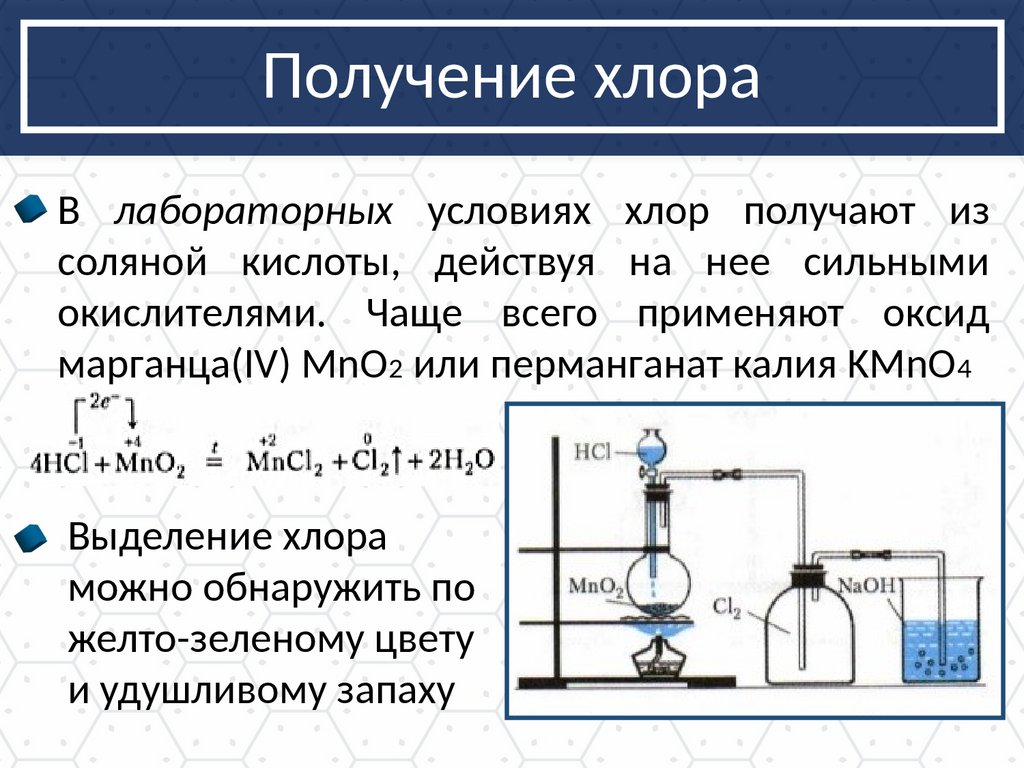
MnO2+ 4HCl Cl2+ MnCl2
+ 2H2O
Для этого в промышленности используют постоянный
электрический ток
11.
Получение хлораВ лабораторных условиях хлор получают из
соляной кислоты, действуя на нее сильными
окислителями. Чаще всего применяют оксид
марганца(IV) MnO2 или перманганат калия KMnO4
Выделение хлора
можно обнаружить по
желто-зеленому цвету
и удушливому запаху
12.
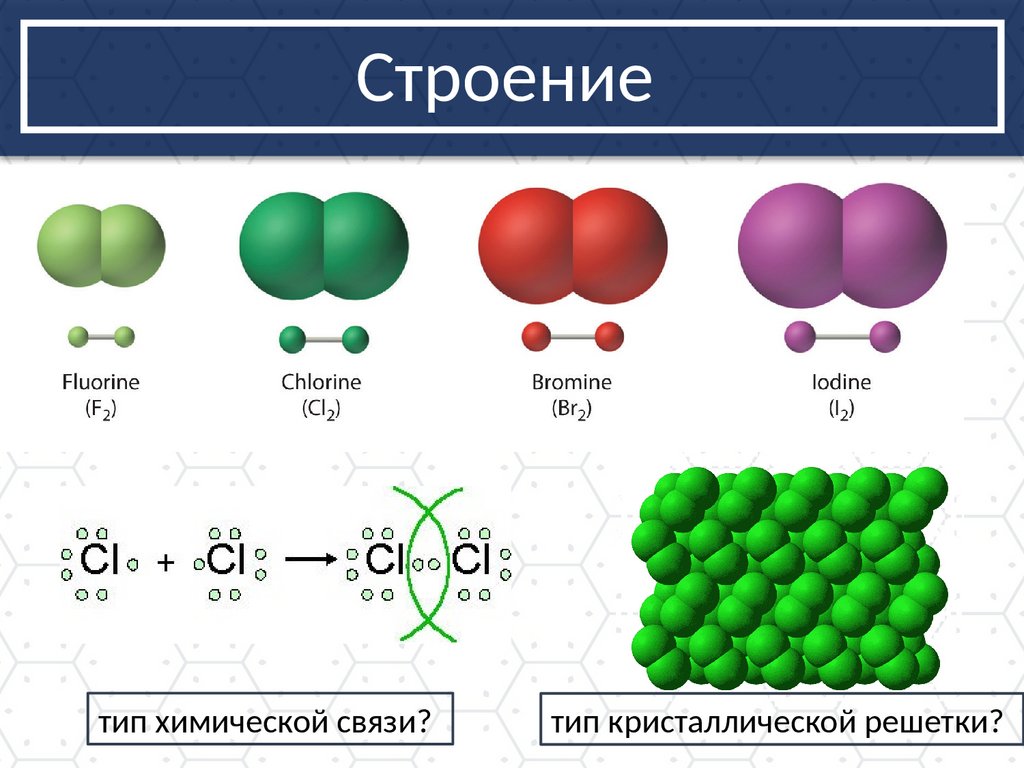
Строениетип химической связи?
тип кристаллической решетки?
13.
Физические свойстваХлор при обычных условиях – газ желто-зеленого
цвета с резким удушливым запахом, почти в 2,5
раза тяжелее воздуха
При атмосферном давлении хлор при -34°C
переходит в жидкое состояние, а при -101°C
затвердевает.
14.
Физические свойстваХлор под давлением около 0,6 МПа уже при
комнатной температуре превращается в жидкость.
В таком виде хлор обычно хранят и транспортируют
в стальных баллонах или цистернах
Хлор хорошо растворим во многих органических
растворителях
15.
Химические свойства+ + + + + +
+ + + + + + + + + + +
+
+
+
+
+
+
K Li Al Mg Fe Cu Au H2 O2 Cl2 I2 N2 S P C Si H2O оксид кислота кислота- щел соль NH3
окислите очь
ль
16.
Взаимодействие хлора с другими элементамиI. Взаимодействие хлора с простыми веществами
1. Хлор реагирует почти со всеми металлами с образованием солей
(При повышенной температуре хлор реагирует также с медью,
железом и некоторыми др. металлами
С некоторыми металлами хлор реагирует при обычной температуре,
например с сурьмой
2. Хлор реагирует с водородом. Реакция хлора с водородом
начинается при нагревании или освещении
17.
Взаимодействие хлора с другими элементамиII . Взаимодействие хлора со сложными веществами
1. Хлор реагирует с водой. Можно наблюдать, как реагирует
хлор с водой, если выставить на свет колбу, наполненную
раствором хлора в воде – хлорной водой. Через некоторое
время можно заметить выделение пузырьков газа – это
кислород. Раствор постепенно утрачивает зеленоватый цвет, а
синий лакмус в нем приобретает красный цвет. Происходит
реакция, в которой образуются две кислоты
2. Хлор реагирует со щелочами
3. Хлор вытесняет из солей бром и йод
4. Хлор реагирует с СО
5. Хлор реагирует с сероводородом и аммиаком
18.
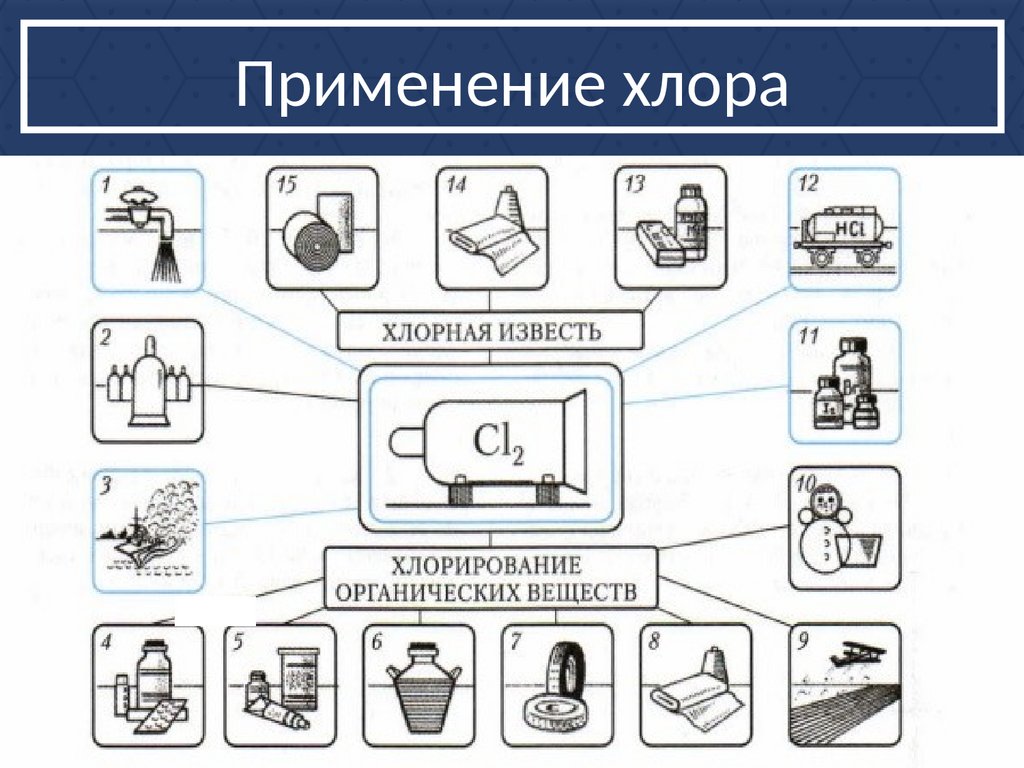
Применение хлора19.
Генетический рядГимнастика для ума
. KCl HCl Cl2 Br2 НВrО HBr KBr
5. HCl NaCl Cl2 NaClO NaClO3 NaClO4 CsClO4
6. НВrO3 HBr Br2 HBrO НВгO3 КВrO3 КВr
7. KMnO4 I2 HIO3 КIO3 KI I2 NaIO3
4
Ну вот и все!














 Химия
Химия








