Похожие презентации:
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
1. Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння.
2. Пригадаємо!
3.
Класифікації хімічних реакційНеоборотні
Оборотні
Ендотермічні
Екзотермічні
(за оборотністю)
За зміною
ступенів
окиснення
Окисно-відновні
За
напрямком
Без зміни СТ.ОК.
За тепловим
ефектом
Обміну
Заміщення
Розкладу
Сполучення
За кількістю і
складом
реагентів і
продуктів
реакції
4. Мета уроку:
познайомитися з класифікацією реакційза тепловим ефектом: з екзотермічними і
ендотермічними реакціями;
навчитися писати термохімічні рівняння
реакцій;
навчитися розв’язувати задачі з
використанням термохімічних рівнянь
реакцій.
5. Тепловий ефект реакції – кількість теплоти, що виділяється чи поглинається під час хімічних реакції.
Тепловий ефект позначається:а) Q – показує скільки теплоти (в кДж) виділилося або
поглинулося під час реакції;
б) ∆ Н – показує різницю між вмістом енергії у
вихідних речовинах і кінцевих продуктах
(ентальпія)
∆Н=-Q
Тепловий ефект вимірюється в Дж або в кДж
6. Термохімічні рівняння – хімічні рівняння, в яких зазначено кількість теплоти, що виділяється або поглинається.
7.
Класифікація реакцій затепловим ефектом
Екзотермічні
Відбуваються з виділенням
тепла
Способи запису термохімічного
рівняння
2Mg + O2 → 2MgO + Q
2Mg + O2 → 2MgO + 1205 кДж
2Mg + O2 → 2MgO; ∆ Н ‹ 0
2Mg + O2 → 2MgO; ∆Н = -1205кДж
Ендотермічні
Відбуваються з поглинанням
теплоти
Способи запису термохімічного
рівняння
СаСО3 → СаО +СО2- Q
СаСО3 → СаО +СО2-180кДж
СаСО3 → СаО +СО2; ∆ Н › 0
СаСО3 → СаО +СО2; ∆ Н =180 кДж
8. Закріпи свої знання!
9. Які з наведених реакцій є екзотермічними:
СН4+ННевірно!2О→СО2+3Н2 ─ Q
СаО +Молодець!
Н2О → Са(ОН)2 + Q
Невірно!
Молодець!
N2 + O2 →2NO; ∆Н›О СО +Н2О→СО2+Н2 ; ∆Н ‹ О
10. Запишіть рівняння горіння водню. Тепловий ефект реакції дорівнює 572кдж.
2Н2 + О2 → 2Н2О + 572кДжабо
2Н2 + О2 → 2Н2О; ∆Н= -572 кДж
11.
Що можна сказати про тип реакції перетворенняречовини на іншу згідно зі схемою:
Б)
∆Н
Перебіг реакції
Екзотермічна реакція
Енергія системи
Енергія системи
А)
∆Н
Перебіг реакції
Ендотермічна реакція
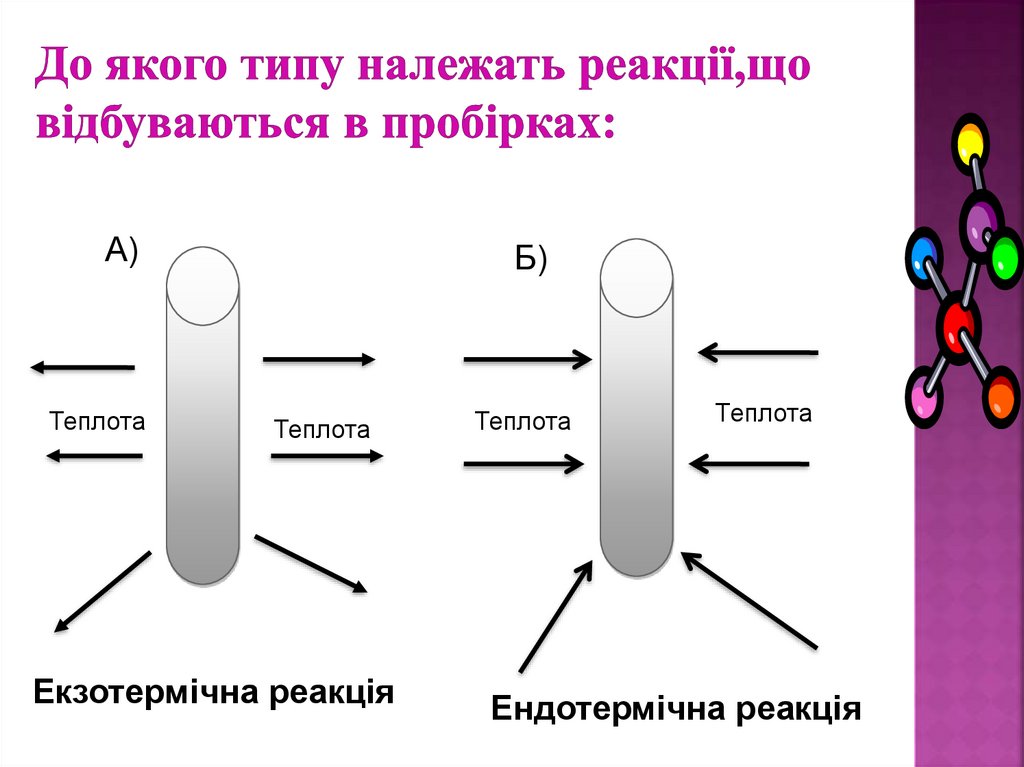
12. До якого типу належать реакції,що відбуваються в пробірках:
А)Теплота
Б)
Теплота
Екзотермічна реакція
Теплота
Теплота
Ендотермічна реакція
13.
14.
15. Обчислення за термохімічними рівняннями
№1. Скільки тепла виділиться в результатіспалювання 18г вугілля?
№2. У результаті взаємодії алюмінію масою 9 г з
киснем виділилося 274,44 кДж теплоти.
Скласти термохімічне рівняння.
№3. Яка маса металу утвориться, якщо для
розкладу меркурій оксиду витратилося 33,4
кДж теплоти? 2HgO →2Hg + O2 ─ 167кДж.
16. Домашнє завдання:
Опрацювати § 18, письмово зробитиопорний конспект за презентацією та
обчислити задачі надані в презентації,
№ 211 .















 Химия
Химия