Похожие презентации:
Материаловедение. Основы физико-химического материаловедения
1.
Шахлевич Г.М.Кафедра ЭТТ
Материаловедение
Основы физико-химического
материаловедения
2.
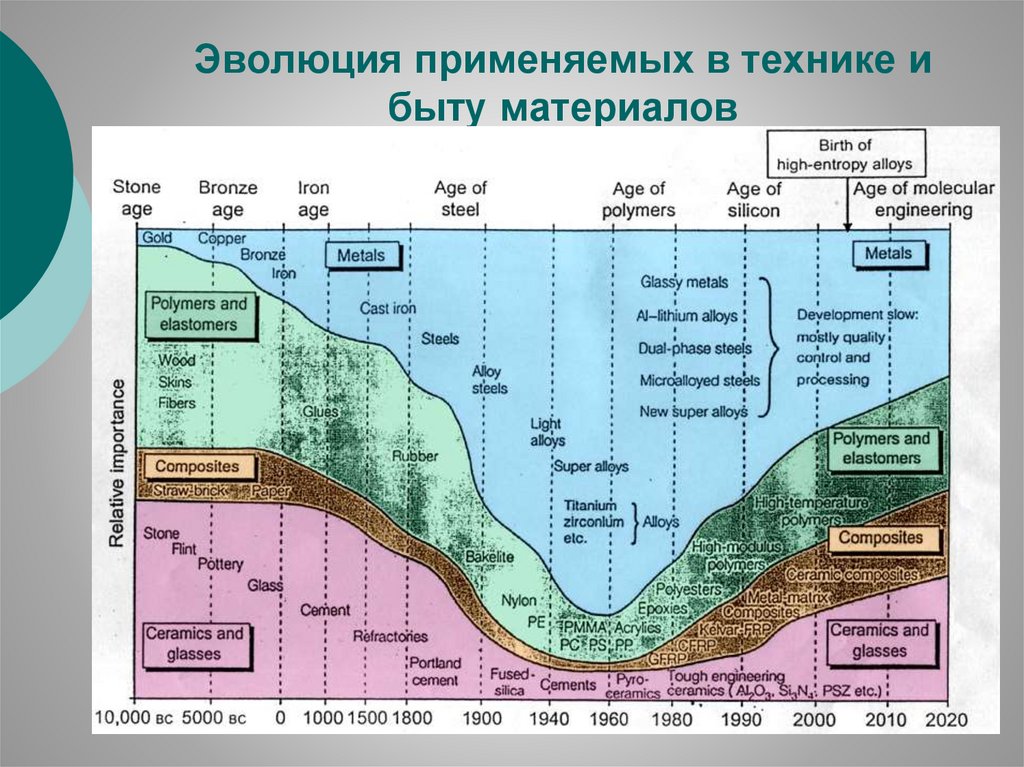
Эволюция применяемых в технике ибыту материалов
3.
Кинжалы из гробницы Тутанхамона(14-й век до нашей эры)
4.
Макро- и микроструктура дамасского мечаИзготовлен из литой стали очень высокой чистоты, содержащей 1,5 –
1,7 % С (заэвтектоидная высокоуглеродистая сталь).
Микроструктура: светлые полосы – мелкие зерна цементита
вторичного; темные полосы – очень мелкие включения перлита в
цементитной матрице. Структура получена многократной ковкой (165
циклов нагрева и охлаждения). Карбиды, при этом частично
растворяются и распределяются в аустените в виде тонких слоев
(термомеханическая обработка). Булатные клинки не закаливались
т.к. закалка ведет к образованию остаточного аустенита и, в
результате перекристаллизации, к исчезновению узора.
5.
Типы химических связейФизическая природа всех типов химической связи
едина – это ядерно-электронное взаимодействие.
Тип химической связи определяется:
1. Характером распределения электронной плотности делокализованных валентных электронов между центрами
образующих связь атомов.
2. Относительной электроотрицательностью (χ) образующих связь атомов.
По Полингу, электроотрицательность – это способность атома оттягивать на себя электроны, осуществляющие химическую связь
χ = (I + Eсв)/2.
3. Количеством валентных электронов и их распределением по энергетическим уровням
У s- и р-элементов валентными являются электроны внешнего
энергетического уровня (Na 1s22s22p63s1, Mg 1s22s22p6 3s2); у dи f- элементов – s-электроны внешнего и d-электроны предвнешнего уровня (Sc 1s22s22p63s23p64s23d1)
6.
Современная теория химической связиБазируется на следующих основных методах:
метод валентных связей описывает ее чисто
качественно, как возникновение общей пары
электронов
метод молекулярных орбиталей описывает ее
количественно и базируется на принципах
построения электронных орбиталей (принцип
запрета Паули, принцип минимальной энергии,
правило Гунда и др.)
метод отталкивания электронных пар (валентных углов) позволяет получить представление
о пространственной конфигурации молекул
7.
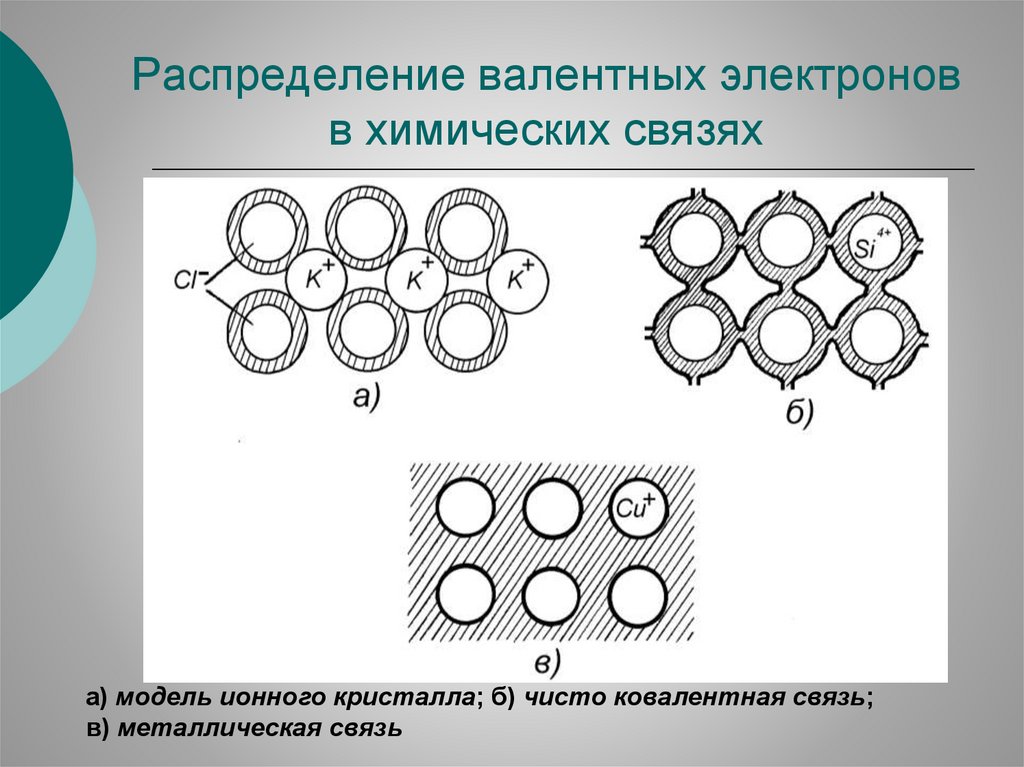
Распределение валентных электроновв химических связях
а) модель ионного кристалла; б) чисто ковалентная связь;
в) металлическая связь
8.
Образование ионного соединенияна примере NaCl
9.
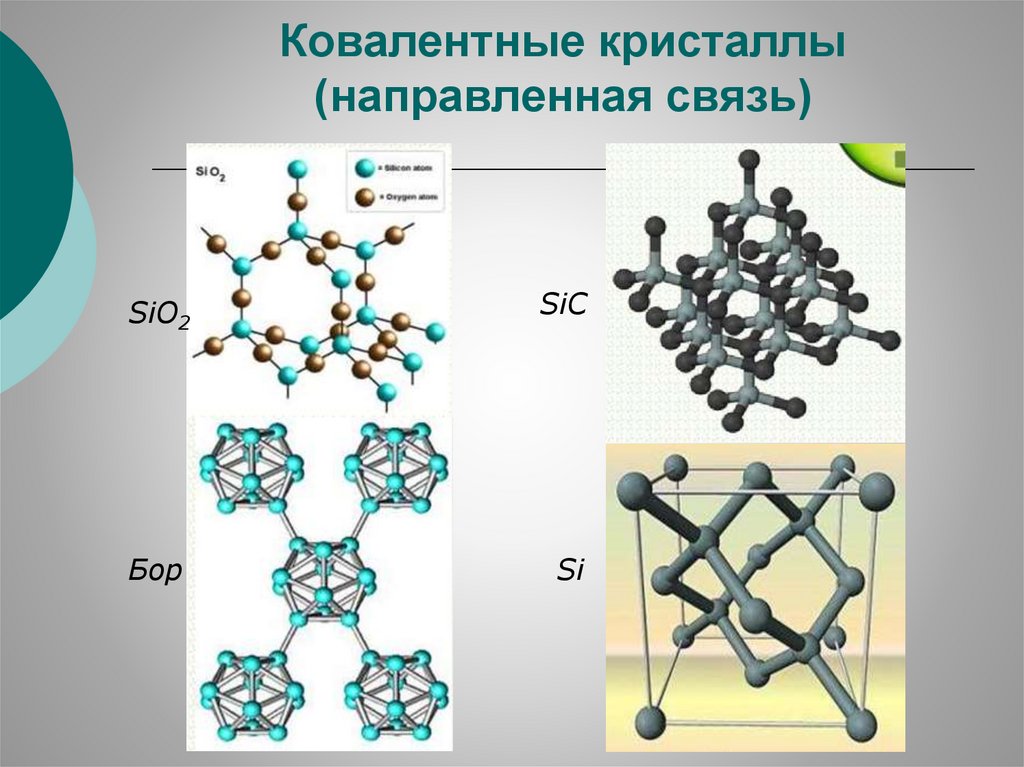
Ковалентные кристаллы(направленная связь)
SiO2
SiC
Бор
Si
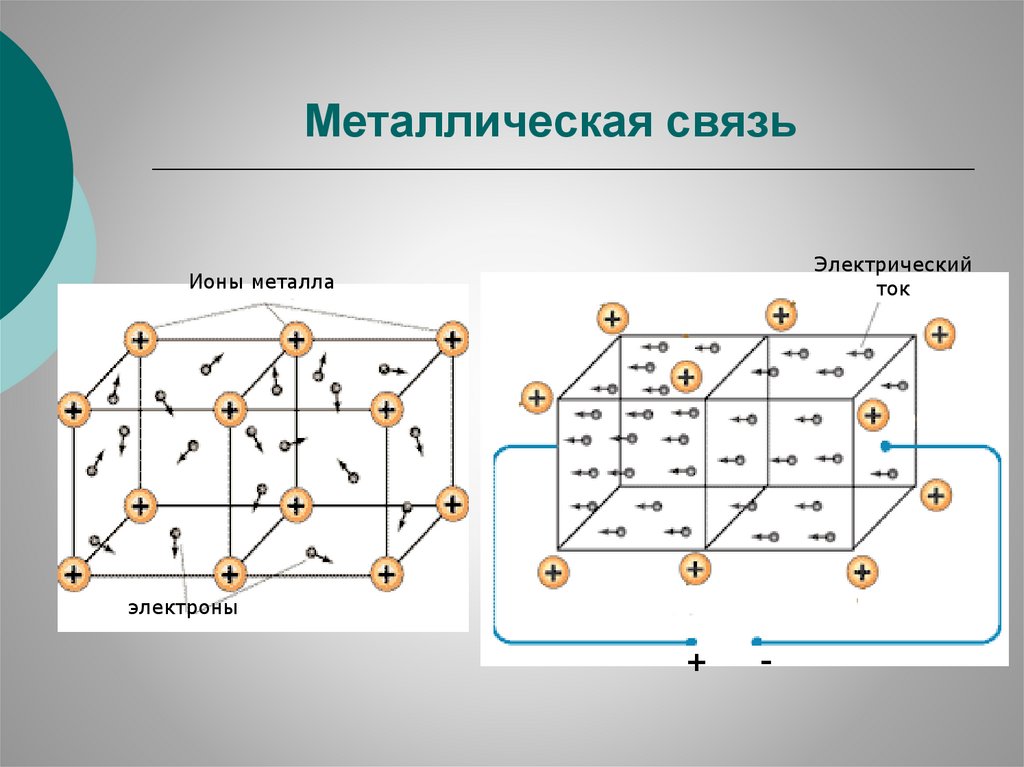
10.
Металлическая связьЭлектрический
ток
Ионы металла
электроны
+
-
11.
Зависимость энергии химической связи отрасстояния между атомами в кристалле
Е(r)
Eот
Ерез
ro
r
Епр
Еот – энергия отталкивания
Епр – энергия притяжения
Ерез – результирующая энергия
ro - равновесное расстояние
между атомами (на дне
потенциальной ямы)
12.
Элементарная ячейка13.
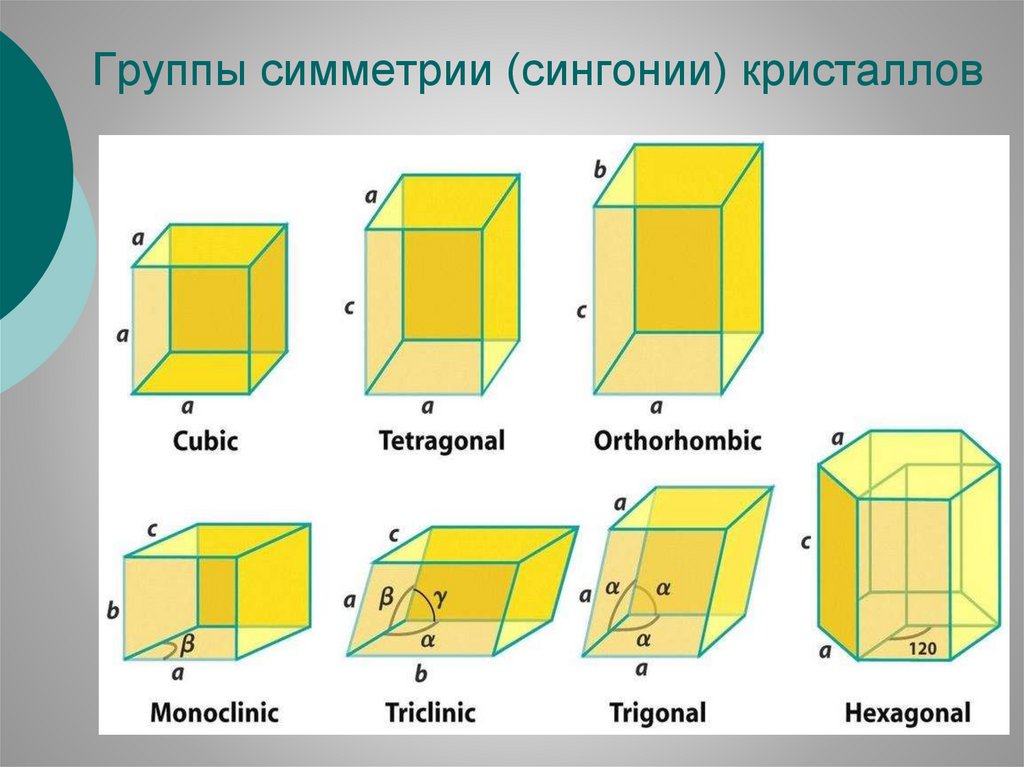
КЛАССИФИКАЦИЯ КРИСТАЛЛИЧЕСКИХРЕШЕТОК ПО СИММЕТРИИ
Все кристаллические материалы объединяет
главное свойство кристаллического состояния —
закономерное положение атомов в кристаллической решётке. В зависимости от пространственной
симметрии, решётки подразделяют на 7 кристаллических систем.
По форме элементарной ячейки они разбиты на
6 сингоний. Все возможные сочетания имеющихся в решётке поворотных осей и зеркальных
плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом
винтовых осей и скользящих плоскостей симметрии - на 230 пространственных групп.
14.
Группы симметрии (сингонии) кристаллов15.
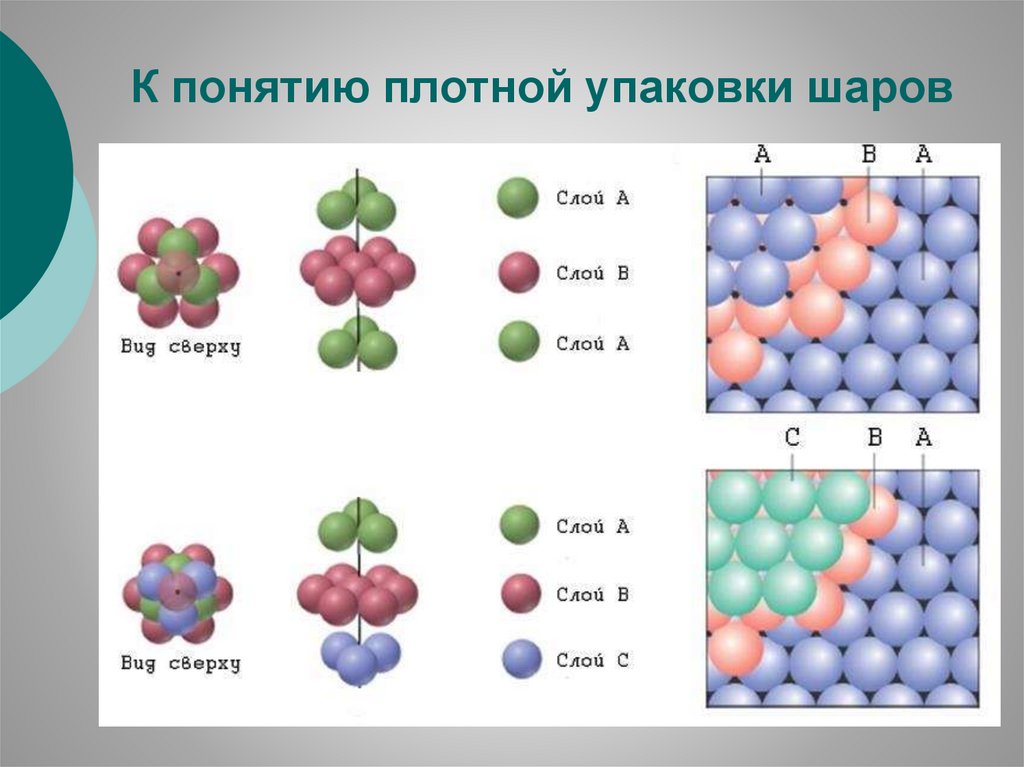
К понятию плотной упаковки шаров16.
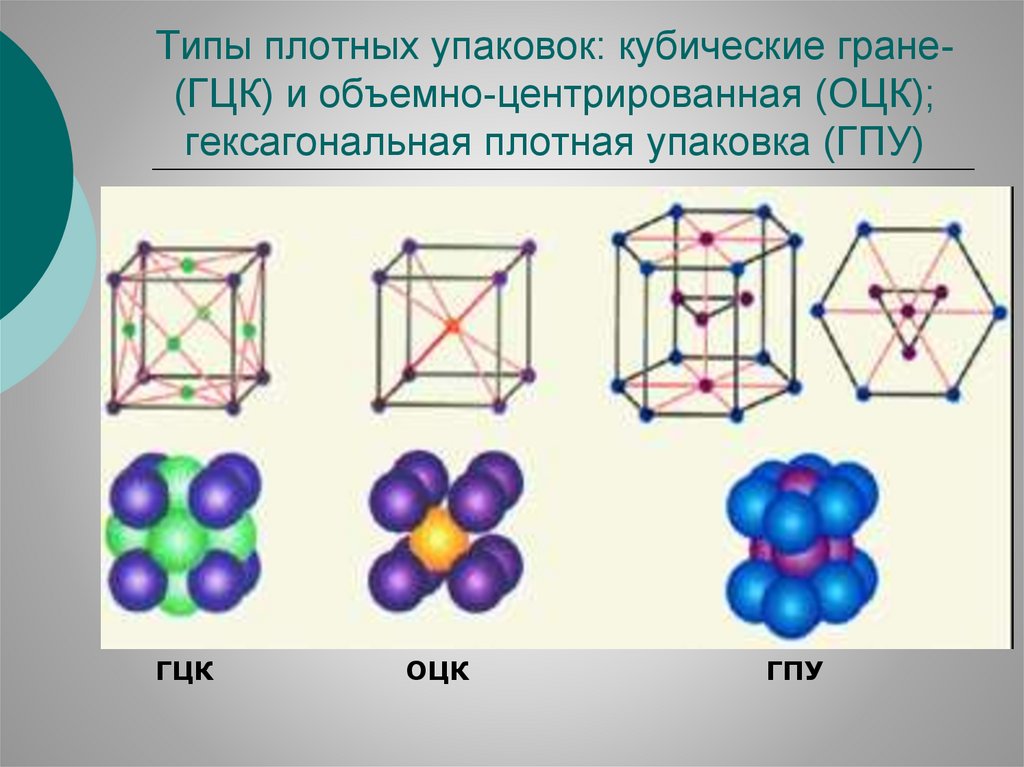
Типы плотных упаковок: кубические гране(ГЦК) и объемно-центрированная (ОЦК);гексагональная плотная упаковка (ГПУ)
ГЦК
ОЦК
ГПУ
17.
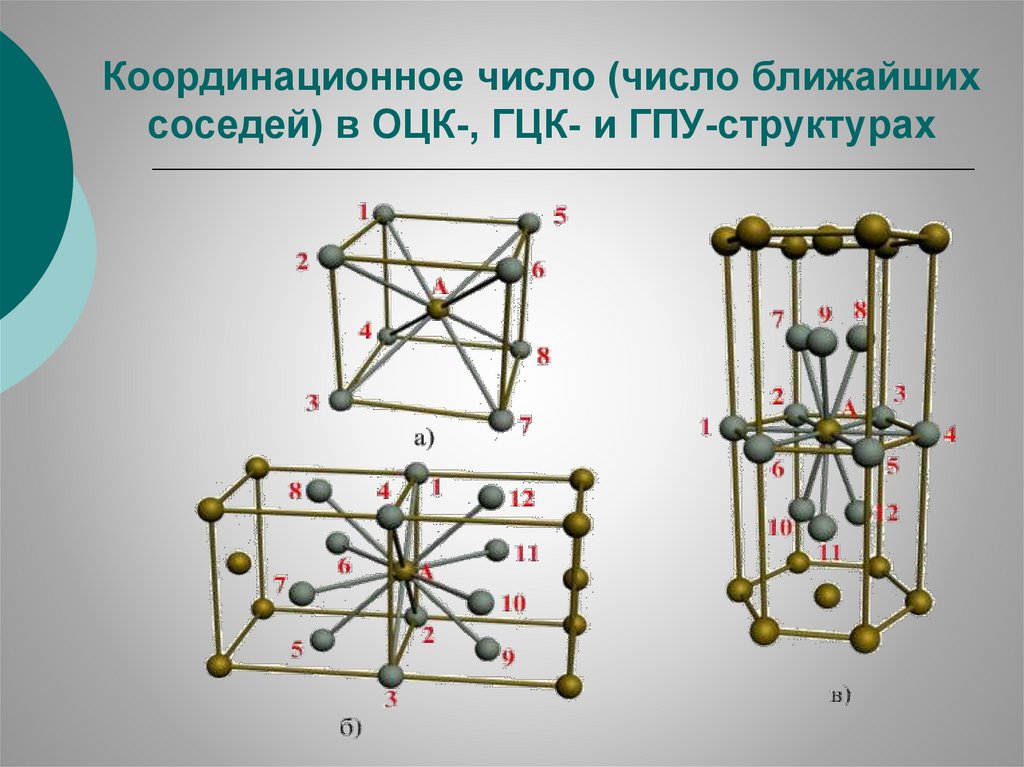
Координационное число (число ближайшихсоседей) в ОЦК-, ГЦК- и ГПУ-структурах
18.
Основные кристаллографическиеплоскости кубической решетки
19.
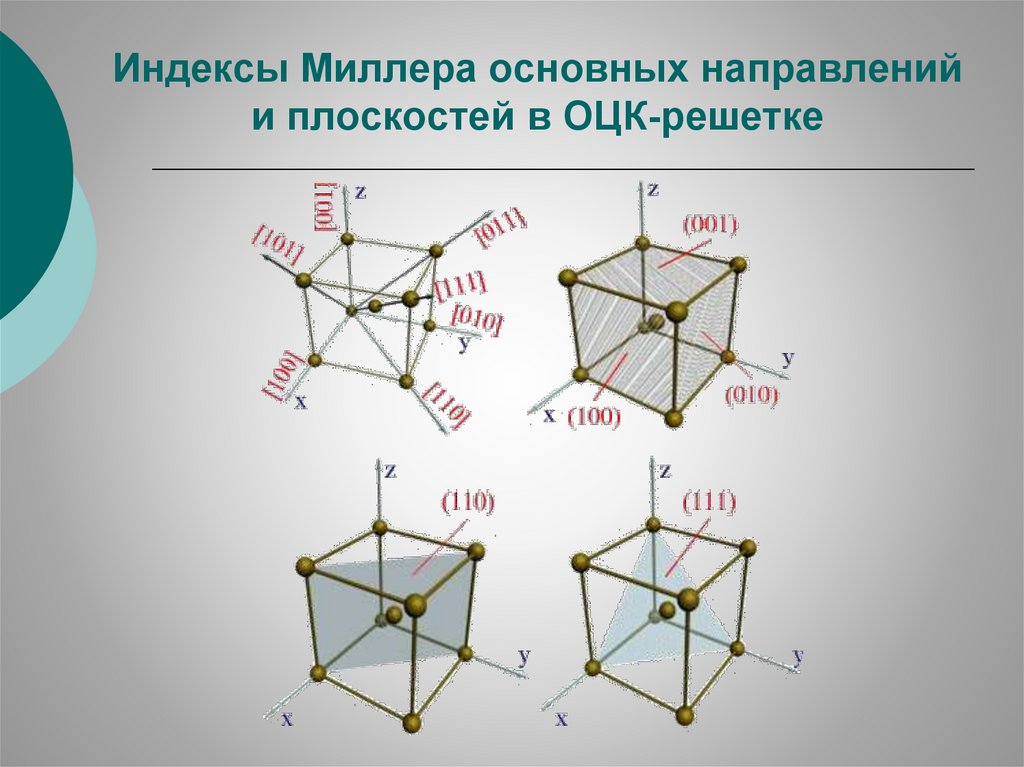
Индексы Миллера основных направленийи плоскостей в ОЦК-решетке
20.
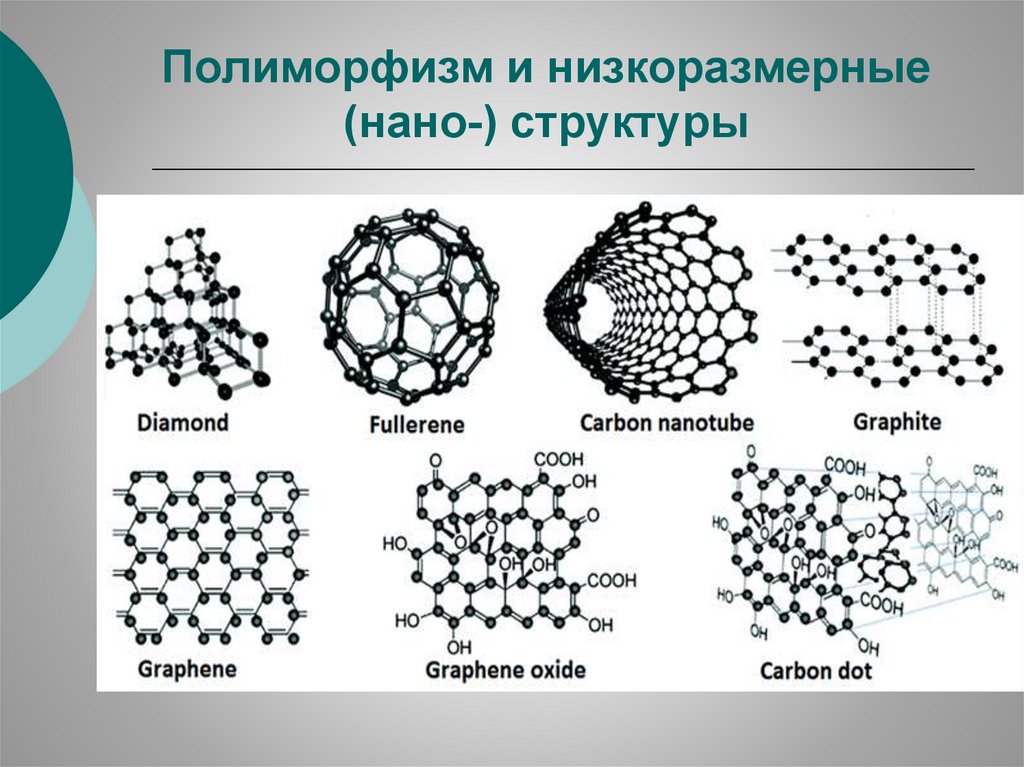
Полиморфизм и низкоразмерные(нано-) структуры
21.
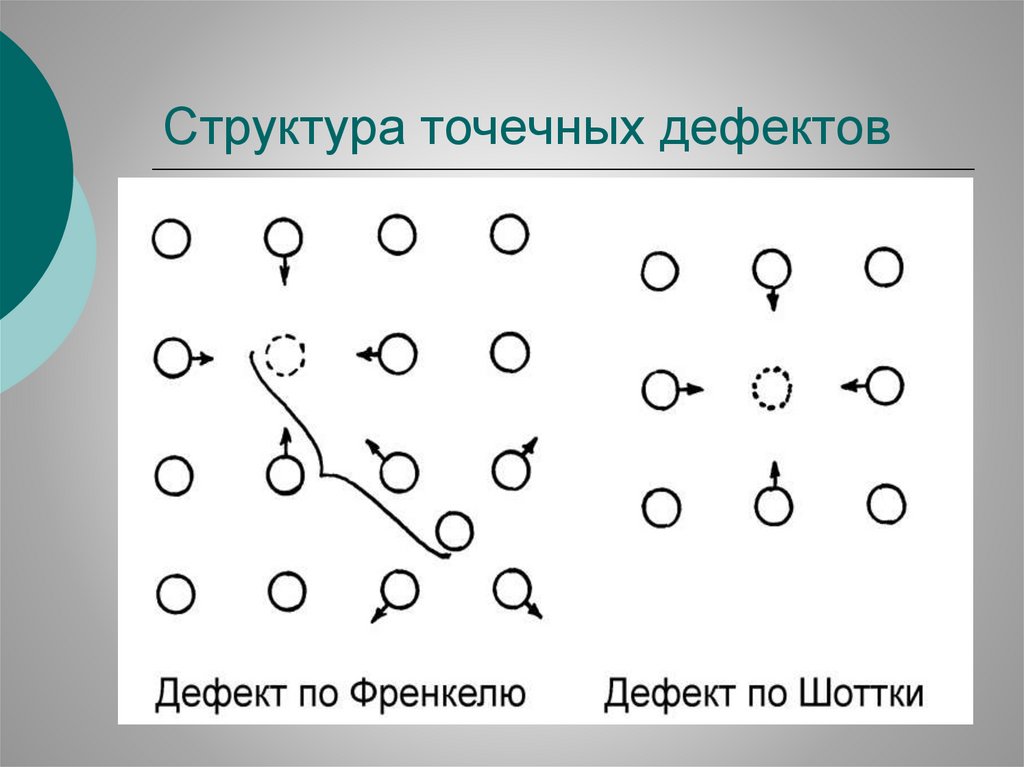
Структура точечных дефектов22.
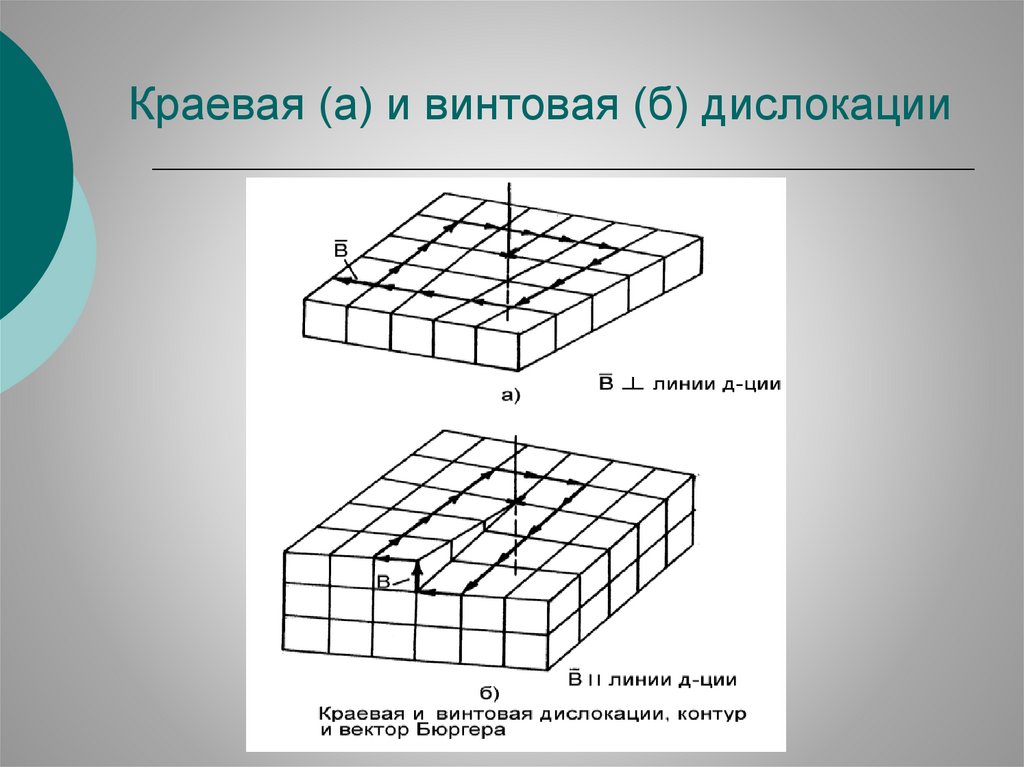
Краевая (а) и винтовая (б) дислокации23.
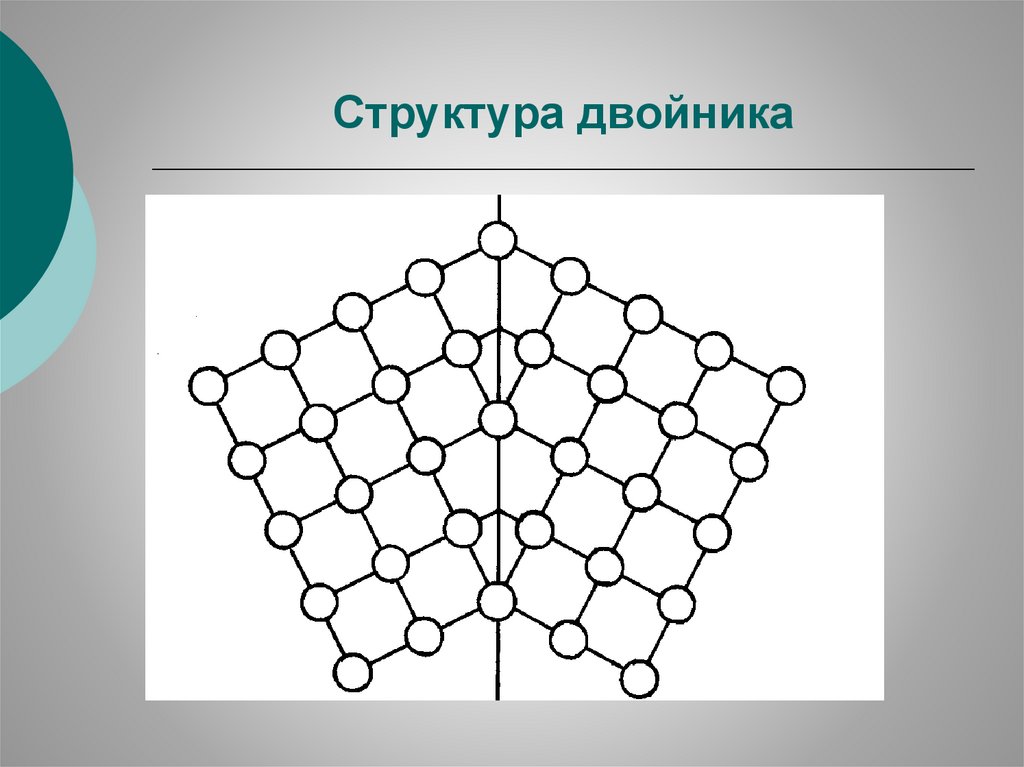
Структура двойника24.
Участие дислокации в пластическойдеформации кристалла
Расчетное усилие сдвига одной части кристалла Fe относительно другой на 2–3 порядка выше фактического (τф = 29 МПа;
τр = 13000 МПа). Это объясняется тем, что сдвиг не является
одновременным смещением всех атомов одной части кристалла
относительно другой, а происходит путем последовательного
смещения отдельных групп атомов, т.е. за счет постепенного
перемещения дислокаций, что требует значительно меньшего
усилия. Каждый последовательный элементарный акт перемещения дислокации из одного положения в другое совершается
путем разрыва связей лишь в одной атомной плоскости.
25.
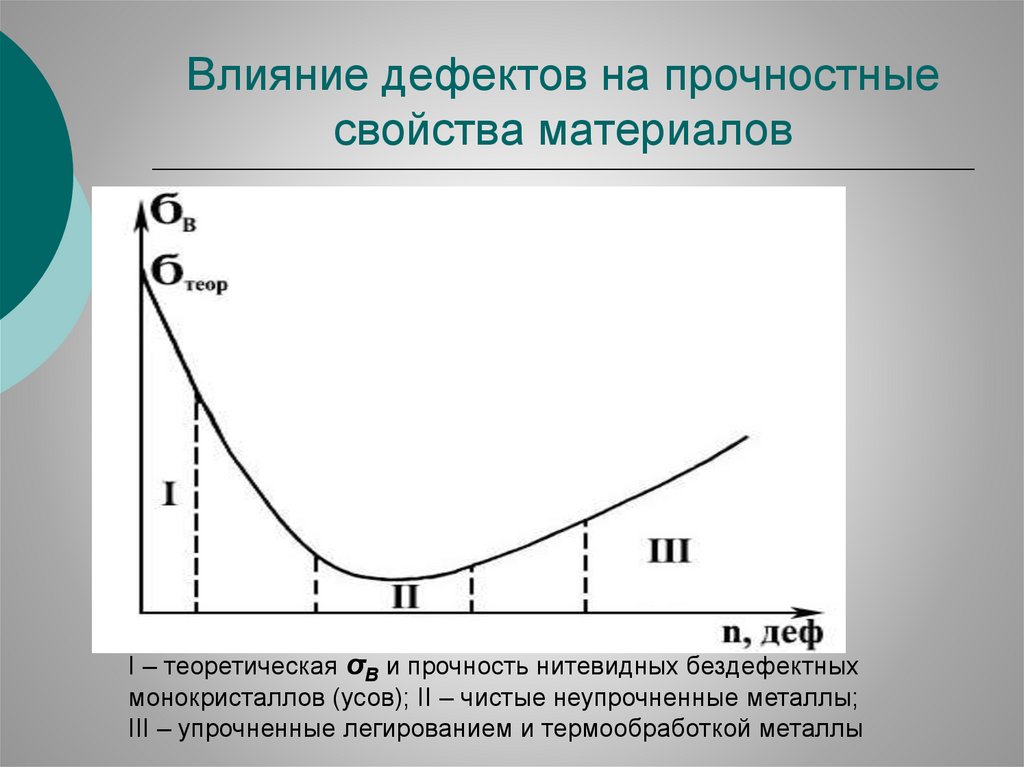
Влияние дефектов на прочностныесвойства материалов
І – теоретическая σВ и прочность нитевидных бездефектных
монокристаллов (усов); ІІ – чистые неупрочненные металлы;
ІІІ – упрочненные легированием и термообработкой металлы
26.
Оптическая металлографияСплав алюминия
Ледебурит
27.
Видманштеттеновы фигурымикроструктуры железных метеоритов
28.
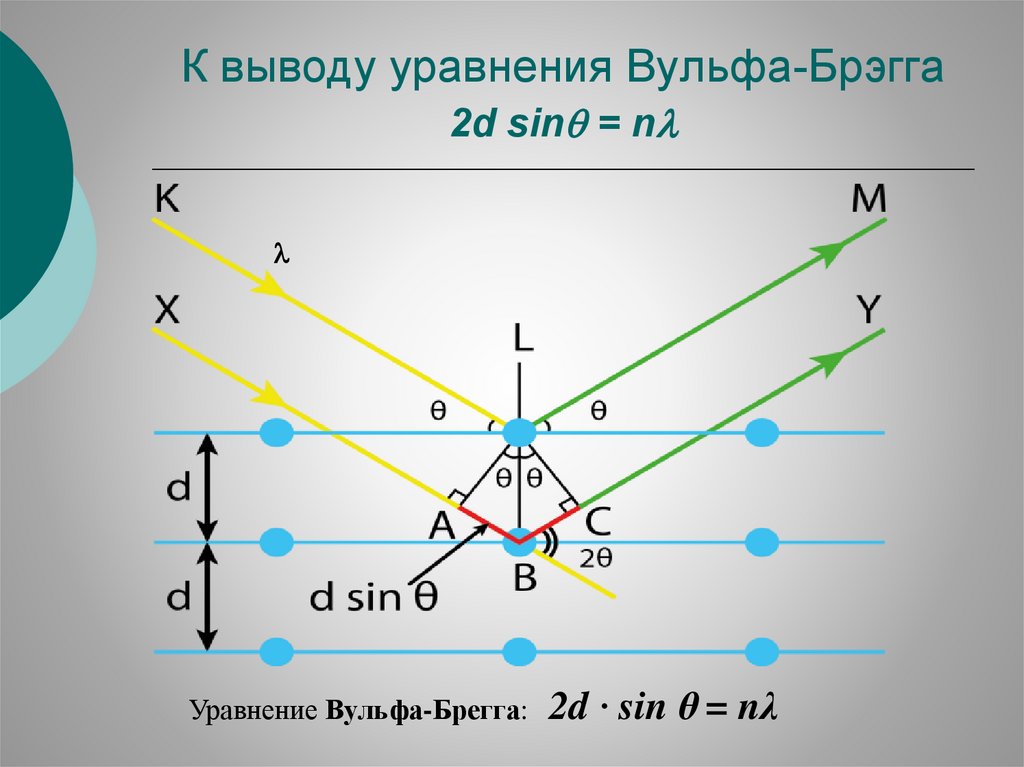
К выводу уравнения Вульфа-Брэгга2d sin = n
Уравнение Вульфа-Брегга:
2d · sin θ = nλ
29.
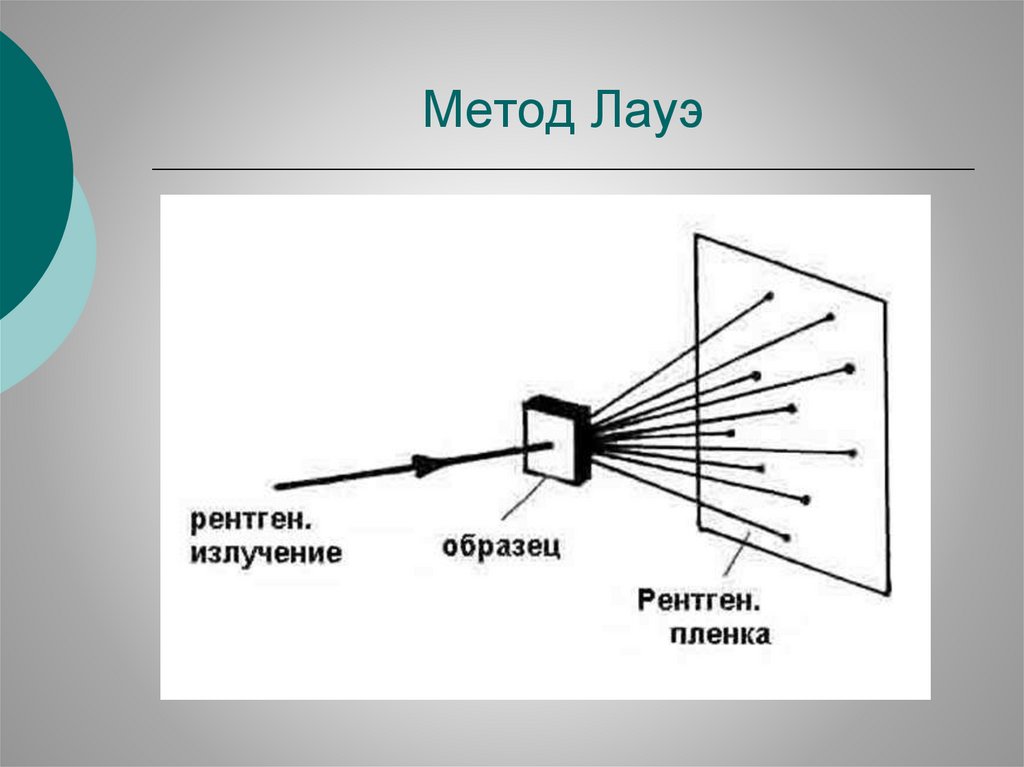
Метод Лауэ30.
Метод порошков (поликристаллов)31.
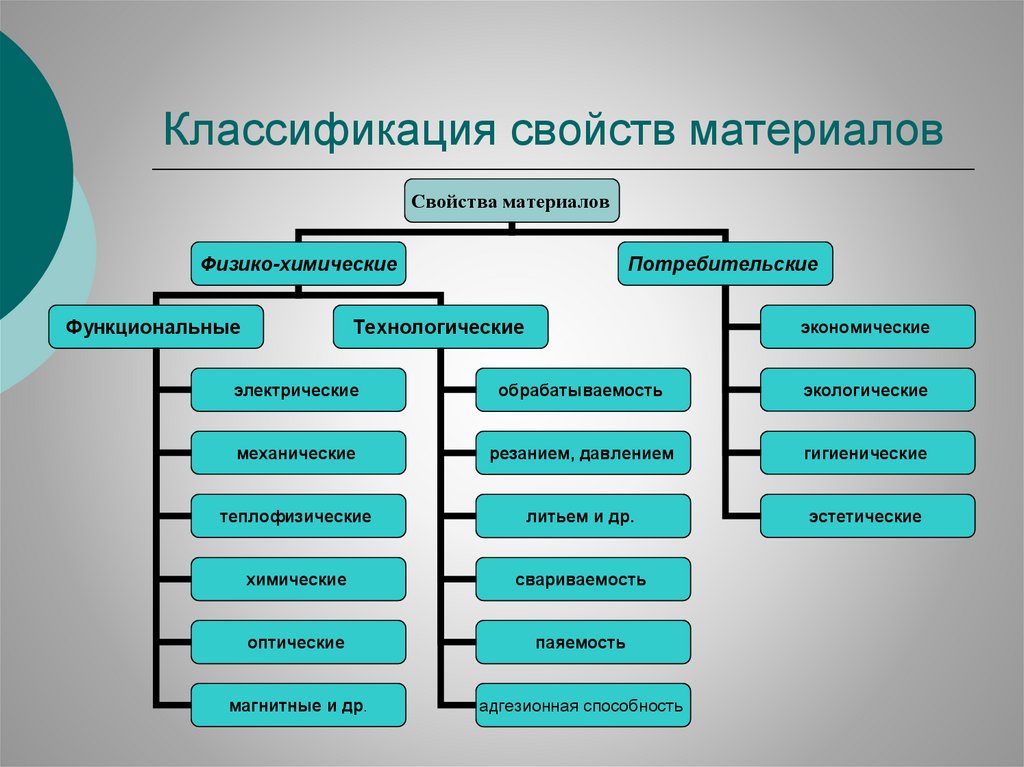
Классификация свойств материаловСвойства материалов
Физико-химические
Функциональные
Потребительские
Технологические
экономические
электрические
обрабатываемость
экологические
механические
резанием, давлением
гигиенические
теплофизические
литьем и др.
эстетические
химические
свариваемость
оптические
паяемость
магнитные и др.
адгезионная способность
32.
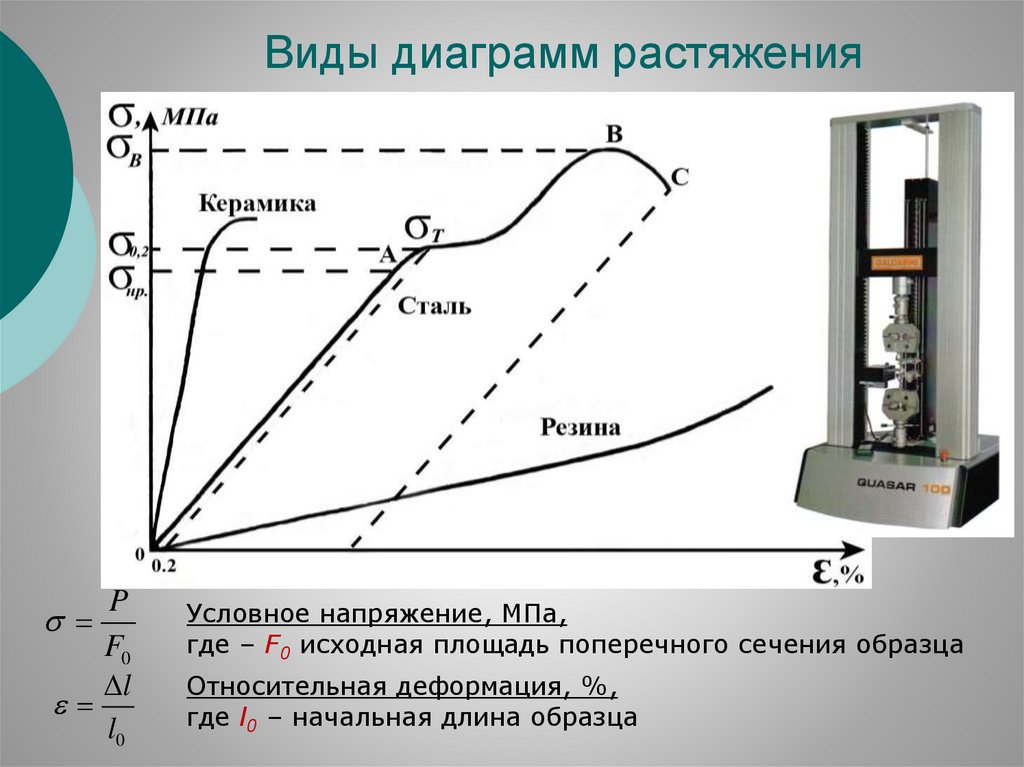
Виды диаграмм растяженияP
F0
l
l0
Условное напряжение, МПа,
где – F0 исходная площадь поперечного сечения образца
Относительная деформация, %,
где l0 – начальная длина образца
33.
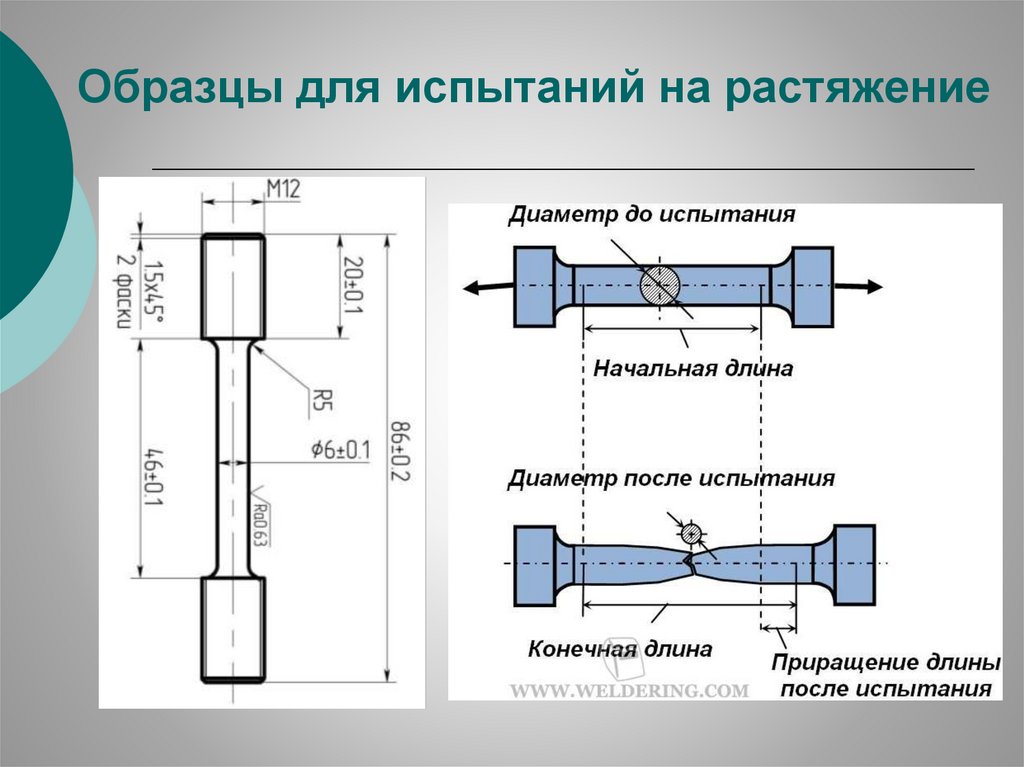
Образцы для испытаний на растяжение34.
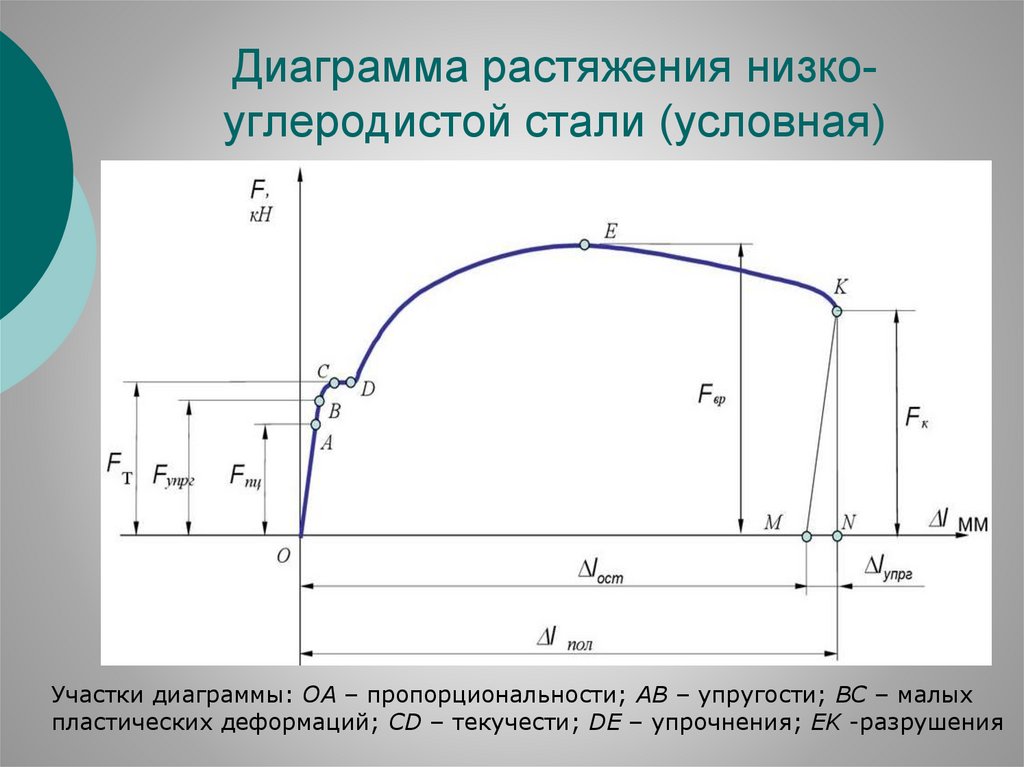
Диаграмма растяжения низкоуглеродистой стали (условная)Участки диаграммы: ОА – пропорциональности; АВ – упругости; ВС – малых
пластических деформаций; СD – текучести; DE – упрочнения; EK -разрушения
35.
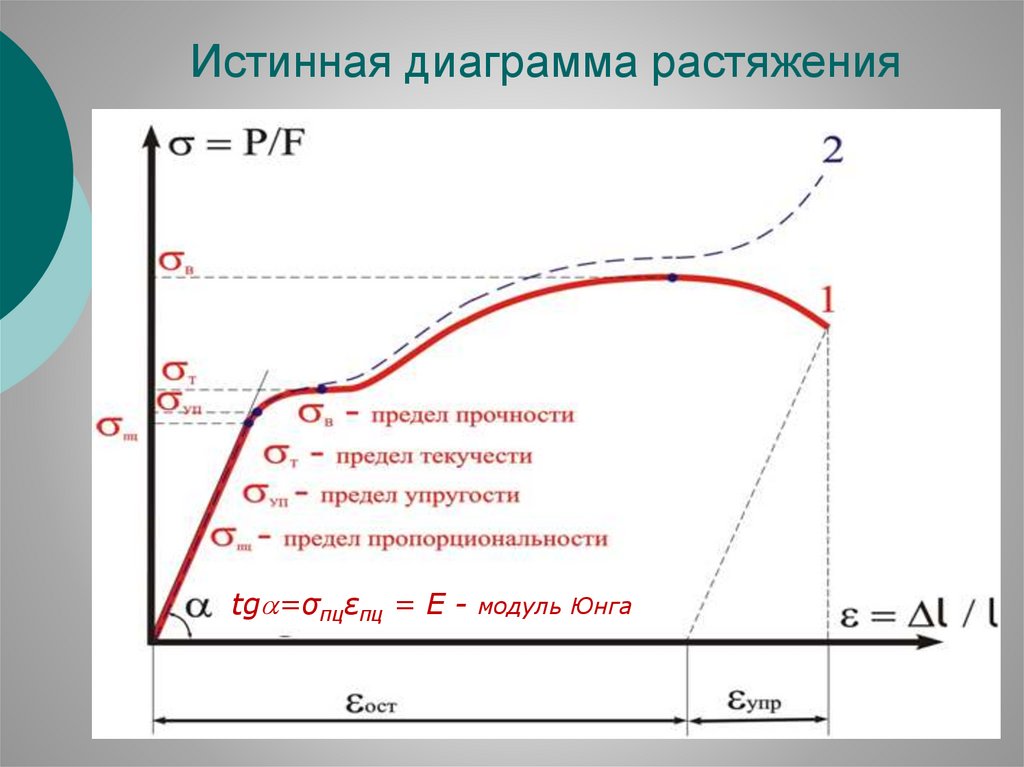
Истинная диаграмма растяженияtg =σпцεпц = E - модуль Юнга
36.
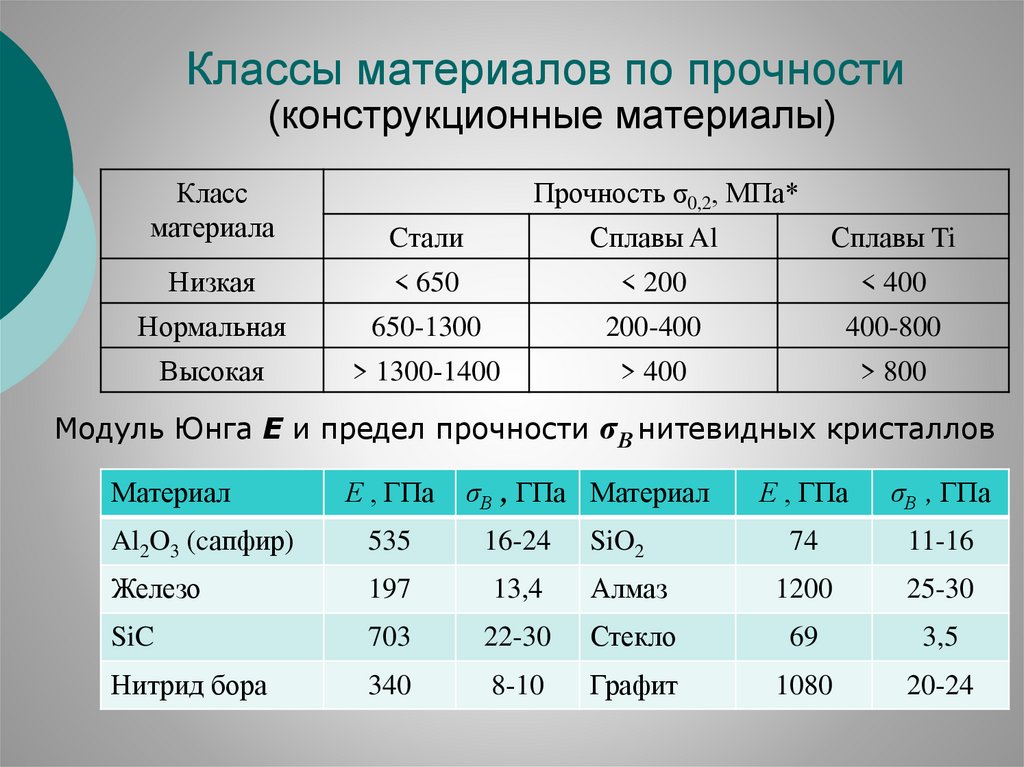
Классы материалов по прочности(конструкционные материалы)
Класс
материала
Cтали
Сплавы Al
Сплавы Ti
Низкая
< 650
< 200
< 400
Нормальная
650-1300
200-400
400-800
Высокая
> 1300-1400
> 400
> 800
Прочность σ0,2, МПа*
Модуль Юнга Е и предел прочности σВ нитевидных кристаллов
Материал
Е , ГПа
σВ , ГПа Материал
Е , ГПа
σВ , ГПа
Al2O3 (cапфир)
535
16-24
SiO2
74
11-16
Железо
197
13,4
Алмаз
1200
25-30
SiC
703
22-30
Стекло
69
3,5
Нитрид бора
340
8-10
Графит
1080
20-24
37.
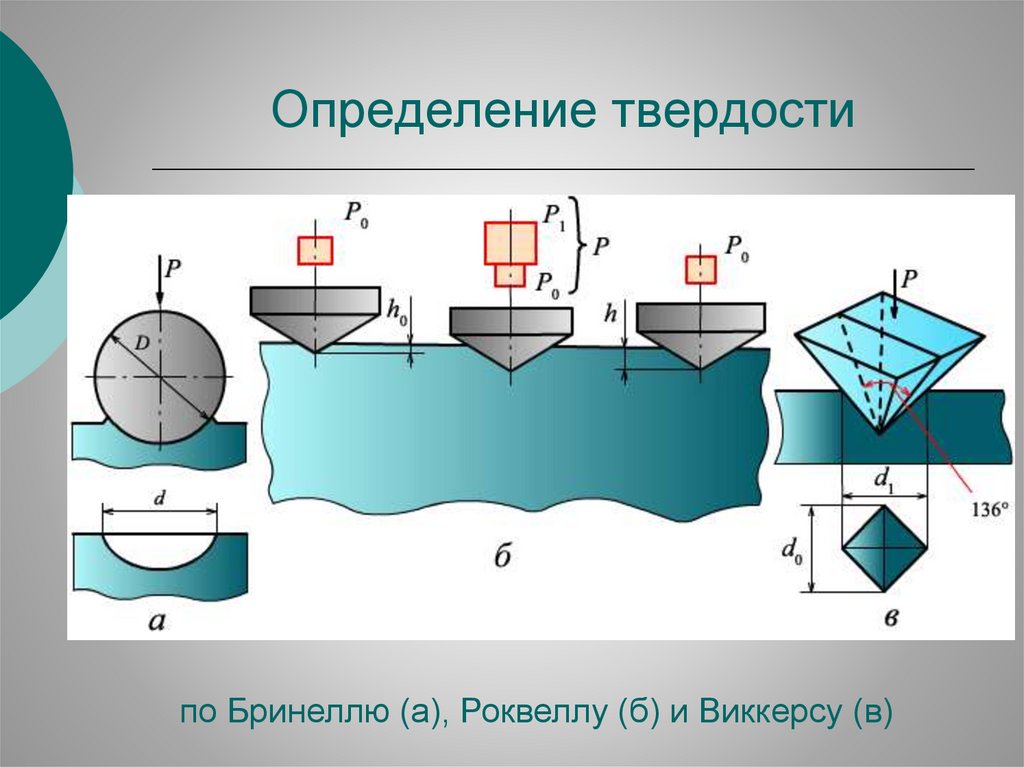
Определение твердостипо Бринеллю (а), Роквеллу (б) и Виккерсу (в)
38.
Измерение твердостиHB = 0,102 F / D(D- D2-d2).
Обычно D = 10 мм;F = 29430 Н для сталей и чугунов; F = 9800 H для
сплавов Al, Cu и Ni и 2450 Н для мягких сплавов. Обозначается, 185НВ.
Между пределом прочности и твердостью по Бринеллю имеется следующая связь: для сталей – σB = 0,34 НВ; для сплавов Cu – σB = 0,34 НВ;
для алюминиевых сплавов - σB = 0,34 НВ.
HRC (HRA) = 100 - е; HRB = 130 - е,
где е = (h - ho )/0,002; ho - глубина вдавливания под действием
силы Fo ; h - остаточная глубина после снятия F1. Выбор индентора, шкалы и нагрузок определяется твёрдостью материала.
Твёрдость по Роквеллу обозначается цифрами, характеризующими ее величину и буквами НR с указанием шкалы. Например,
61HRC (твердость 61 по шкале С, индентор – алмазный конус).
Твёрдость по Виккерсу: алмазный индентор в виде 4-хгранной
пирамиды, нагрузка F (Н) и измерении средней величины
диагоналей d (мм) отпечатка: HV = 0,189 F/d
39.
Испытания на ударную вязкостьМаятниковый копер
40.
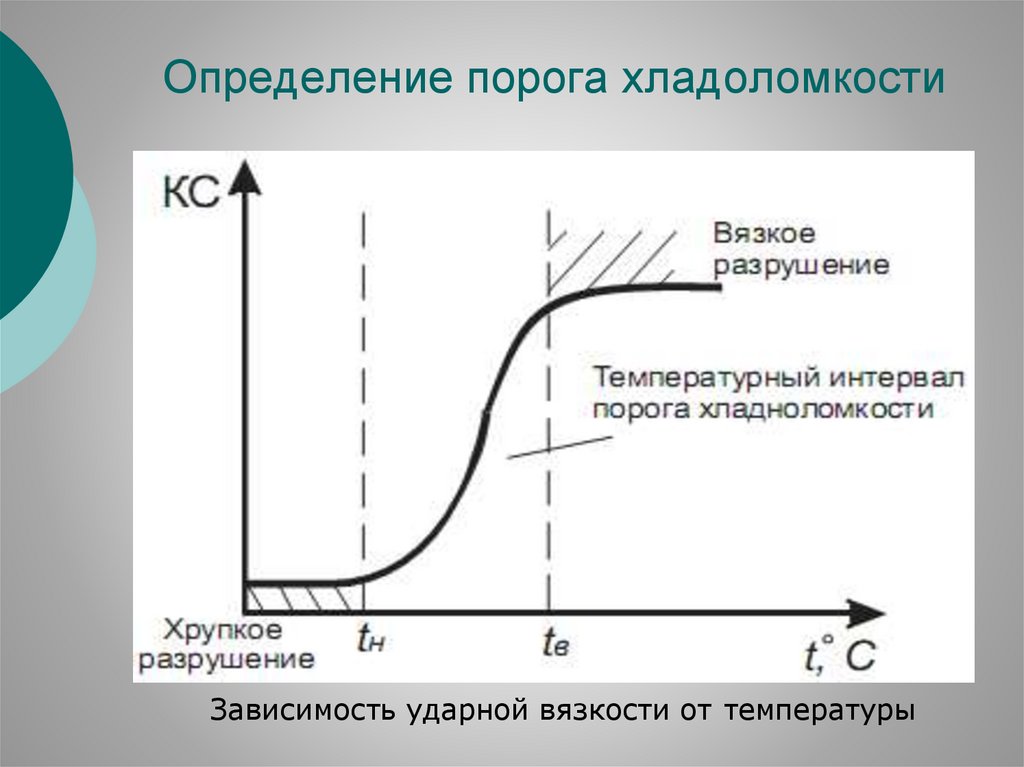
Определение порога хладоломкостиЗависимость ударной вязкости от температуры
41.
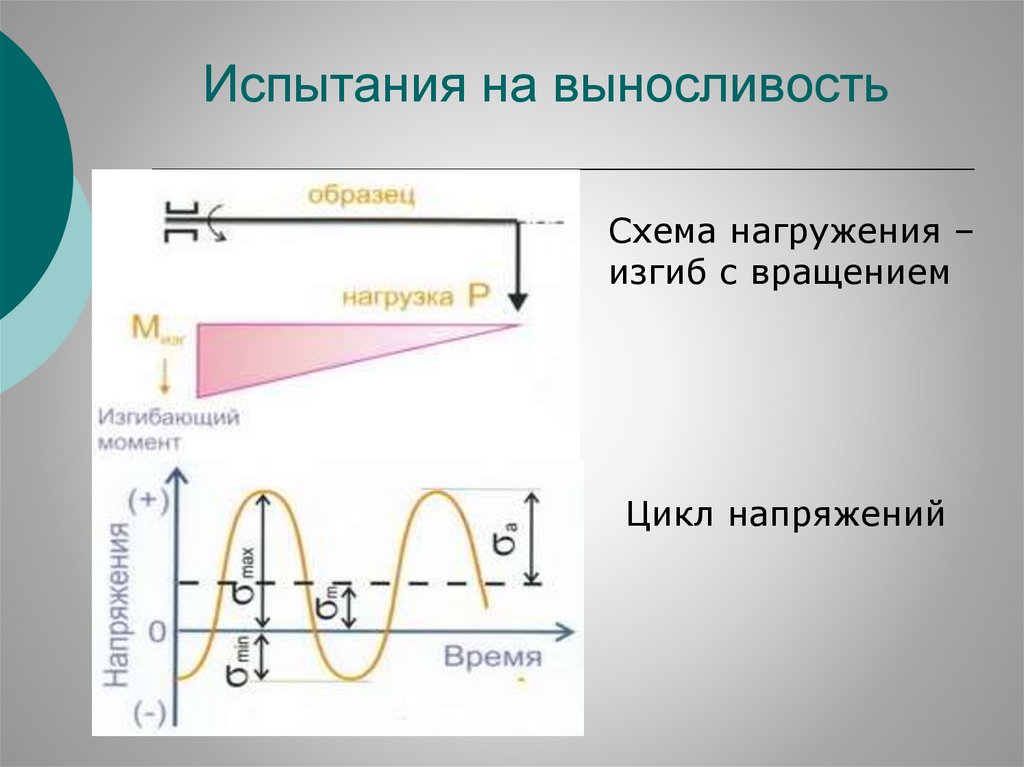
Структура излома металла42.
Испытания на выносливостьСхема нагружения –
изгиб с вращением
Цикл напряжений
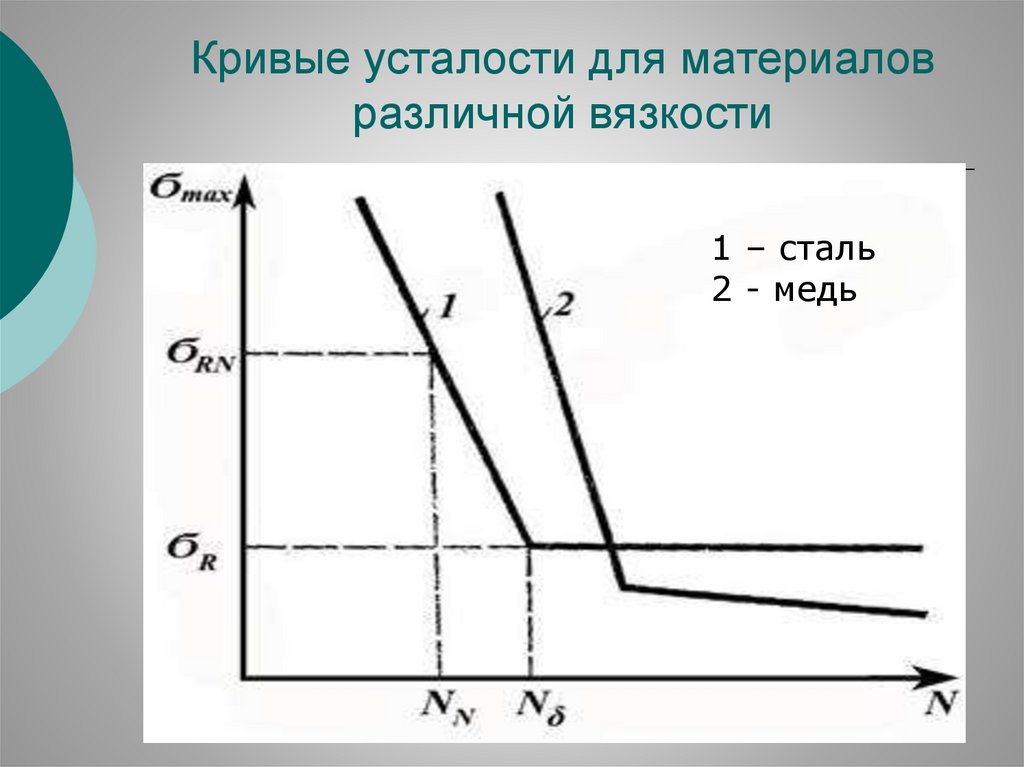
43.
Кривые усталости для материаловразличной вязкости
1 – сталь
2 - медь
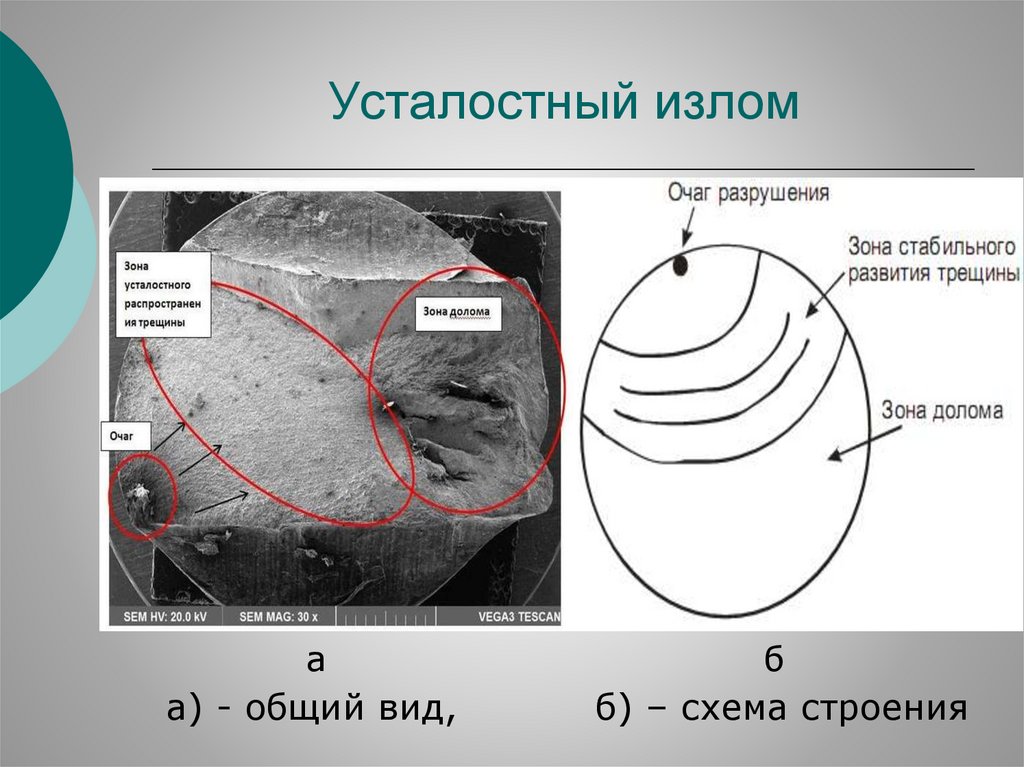
44.
Усталостный излома
а) - общий вид,
б
б) – схема строения
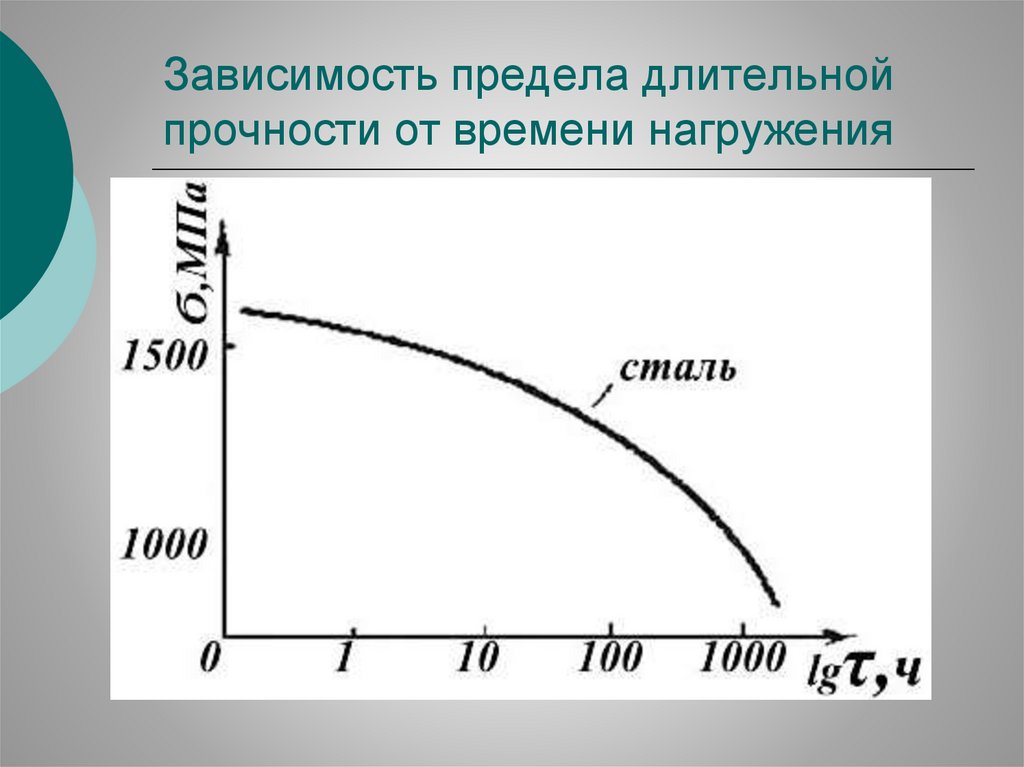
45.
Зависимость предела длительнойпрочности от времени нагружения
46.
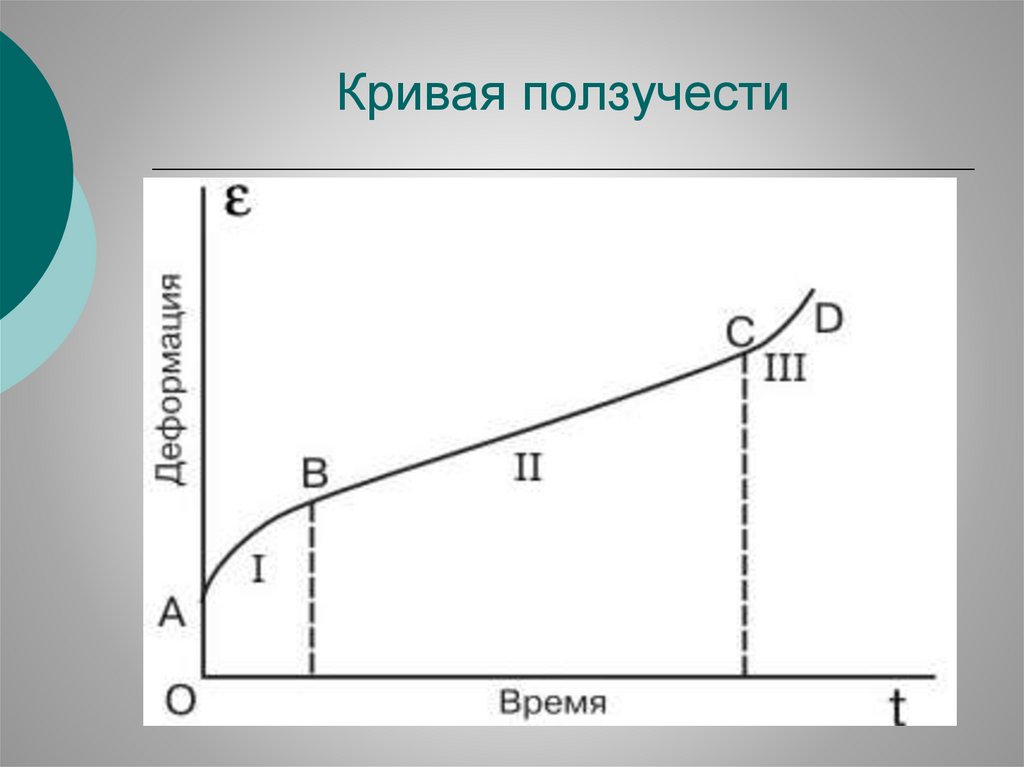
Кривая ползучести47.
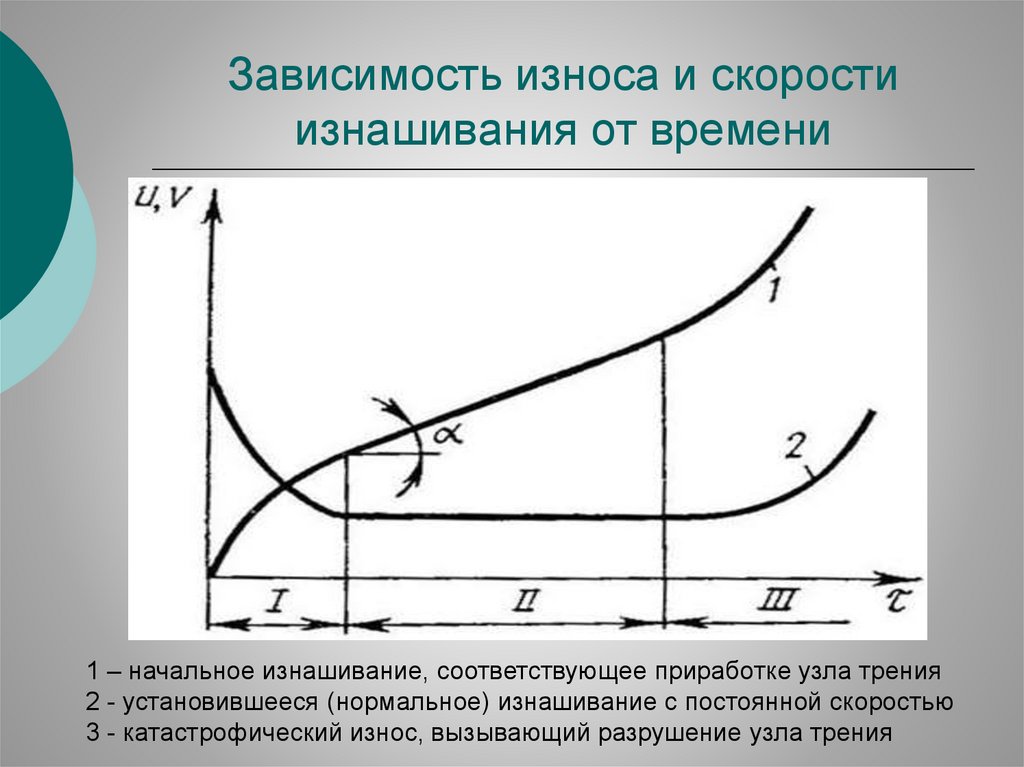
Зависимость износа и скоростиизнашивания от времени
1 – начальное изнашивание, соответствующее приработке узла трения
2 - установившееся (нормальное) изнашивание с постоянной скоростью
3 - катастрофический износ, вызывающий разрушение узла трения
48.
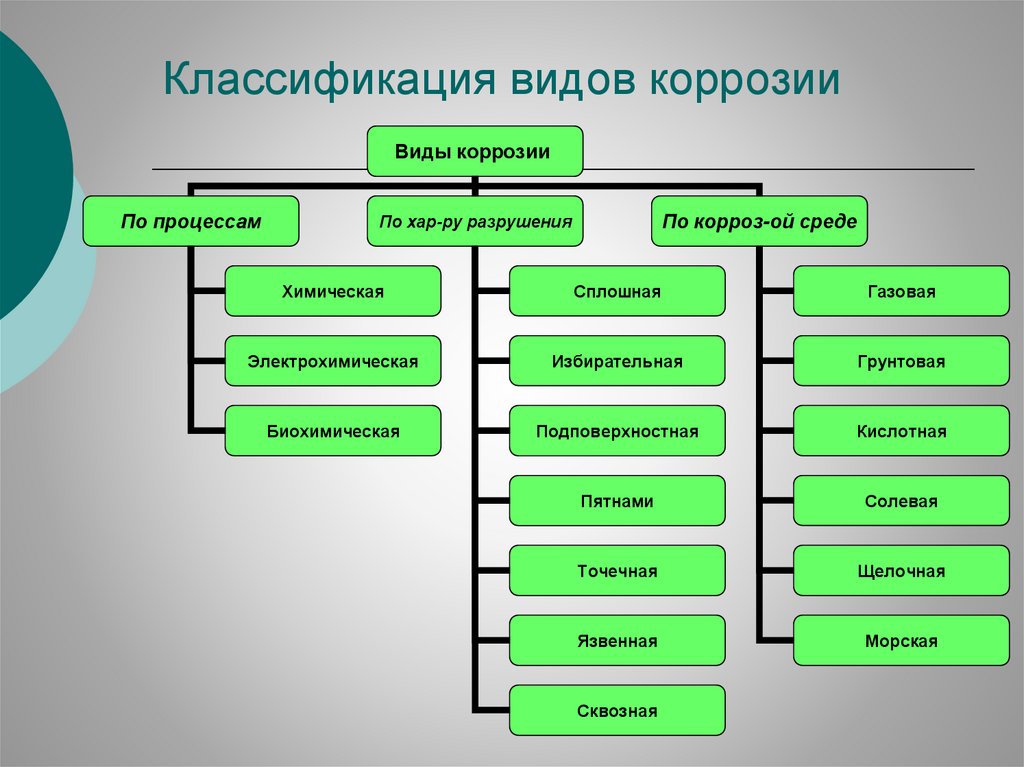
Классификация видов коррозииВиды коррозии
По процессам
По корроз-ой среде
По хар-ру разрушения
Химическая
Сплошная
Газовая
Электрохимическая
Избирательная
Грунтовая
Биохимическая
Подповерхностная
Кислотная
Пятнами
Солевая
Точечная
Щелочная
Язвенная
Морская
Сквозная
49.
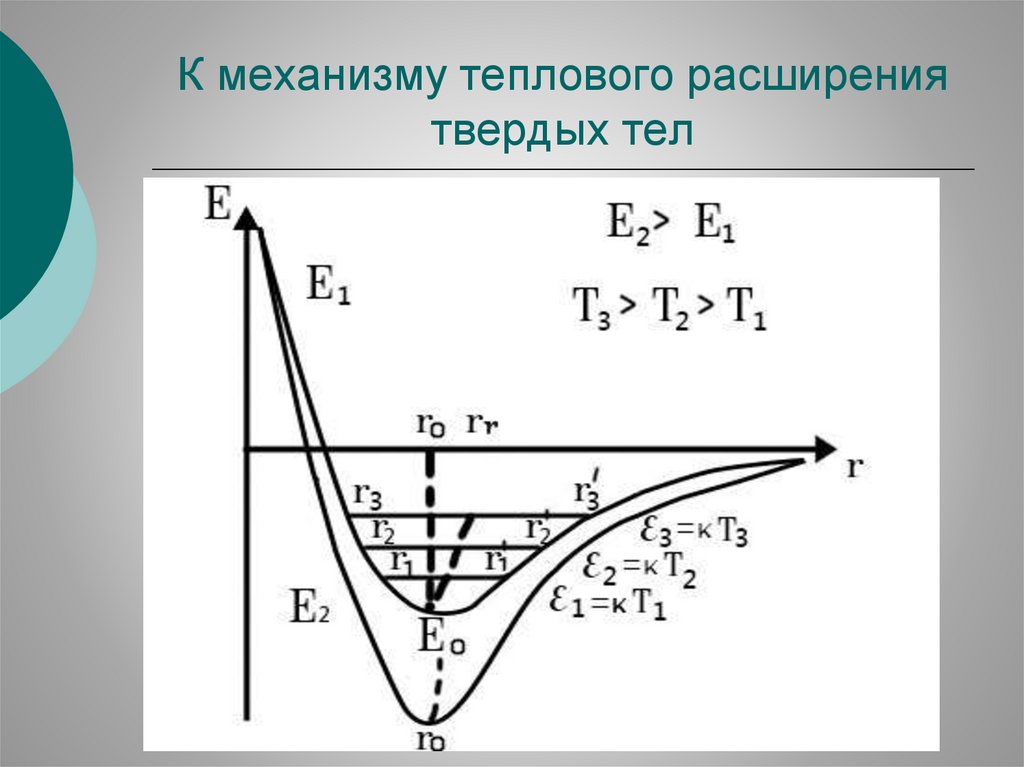
К механизму теплового расширениятвердых тел
50.
Предпосылки теории электронныхсостояний
Квантовые частицы неотличимы
Вероятностный характер нахождения электрона в том
или ином месте кристалла
Трансляционная инвариантность – при сдвиге на
постоянную кристаллической решетки вероятность
нахождения электрона не изменяется
Электрон, находящийся на орбитали атома, связан с ядром.
Вероятность его перемещения по кристаллу при внешних
воздействиях мала. Такой «квазисвязанный» электрон
находится в «потенциальной яме».
Под влиянием света, температуры, поля и т.д.) электрон
может увеличить свою кинетическую энергию и перейти на
следующий энергетический уровень, вплоть до полного
освобождения от ядра
51.
Элементы зонной теории твердого телаЭнергетический спектр электрона в изолированном атоме
представляет собой ряд линий, разделенных запрещенными промежутками. Уже в молекуле, вследствие
взаимодействия между атомами, линии расщепляются,
образуя полосы.
При объединении атомов в кристалл значение энергии
атома изменяется по отношению к изолированному
атому. Ядра кристаллической решетки создают
потенциальное поле U (r ) . Т.е., объединение атомов ‒
чисто квантовый процесс, в ходе которого возникает
новая система уровней энергии, характеризующая
молекулу (или кристалл в целом).
52.
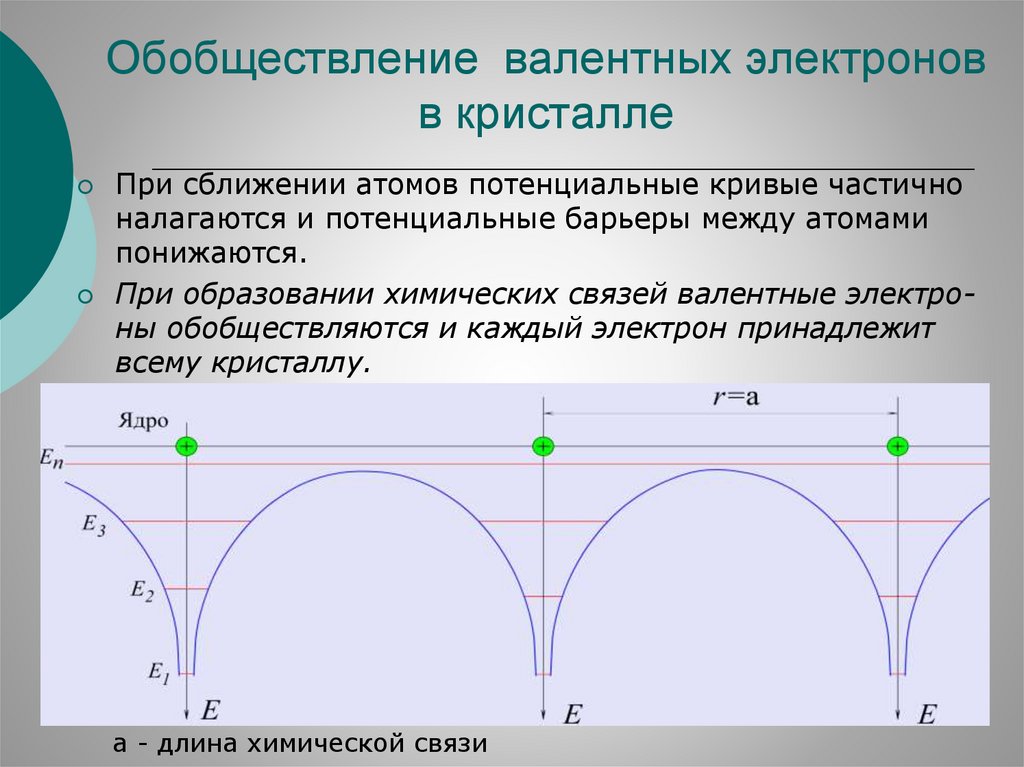
Обобществление валентных электроновв кристалле
При сближении атомов потенциальные кривые частично
налагаются и потенциальные барьеры между атомами
понижаются.
При образовании химических связей валентные электроны обобществляются и каждый электрон принадлежит
всему кристаллу.
а - длина химической связи
53.
Свободный электронный газЭлектрон в кристалле не совсем свободен, т.к. находится в периодическом поле всей решетки.
Т.е., даже «свободный» электрон будет принадлежать всем атомам кристалла. При этом он может
перемещаться по кристаллу от атома к атому без
изменения энергии.
Для металлов вводят понятие свободный электронный
газ. Электронный газ – теоретическая модель, описывающая поведение электронов проводимости, упорядоченное движение которых (дрейф) обусловливает электропроводность). В модели электронного газа пренебрегают
кулоновским взаимодействием между электронами по
сравнению со взаимодействием с ионами кристаллической решетки (модель независимых электронов)
54.
Уравнение Шредингера для электронав решетке
Периодическое изменение потенциальной энергии кристалла
накладывает ограничения на периодическую волновую
функцию электрона, названные граничными условиями
Борна – Кармана
L Ni ai
(r N i a i ) (r )
где i принимает значения, соответствующие размерности решетки
Бравэ; ai – вектор элементарной трансляции; Ni – целое число
При сдвиге на постоянную кристаллической решетки вероятность
нахождения электрона не изменяется
Уравнение Шредингера для электрона в решетке:
ˆ
H
U r (r ) E (r )
2m
2
55.
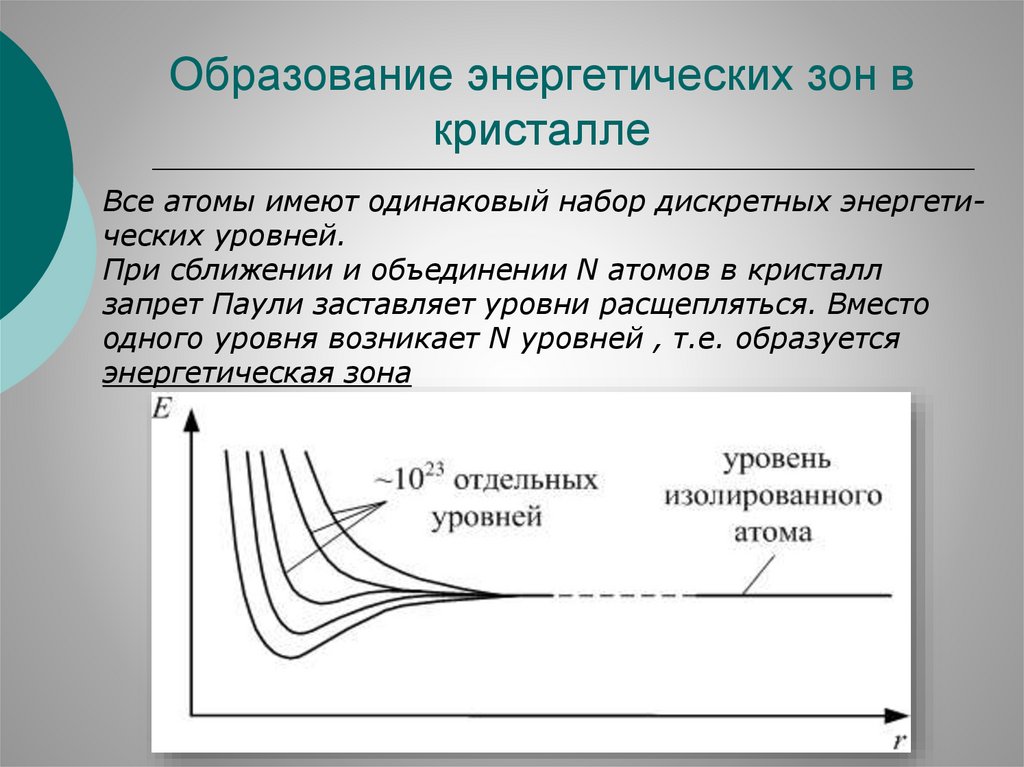
Образование энергетических зон вкристалле
Все атомы имеют одинаковый набор дискретных энергетических уровней.
При сближении и объединении N атомов в кристалл
запрет Паули заставляет уровни расщепляться. Вместо
одного уровня возникает N уровней , т.е. образуется
энергетическая зона
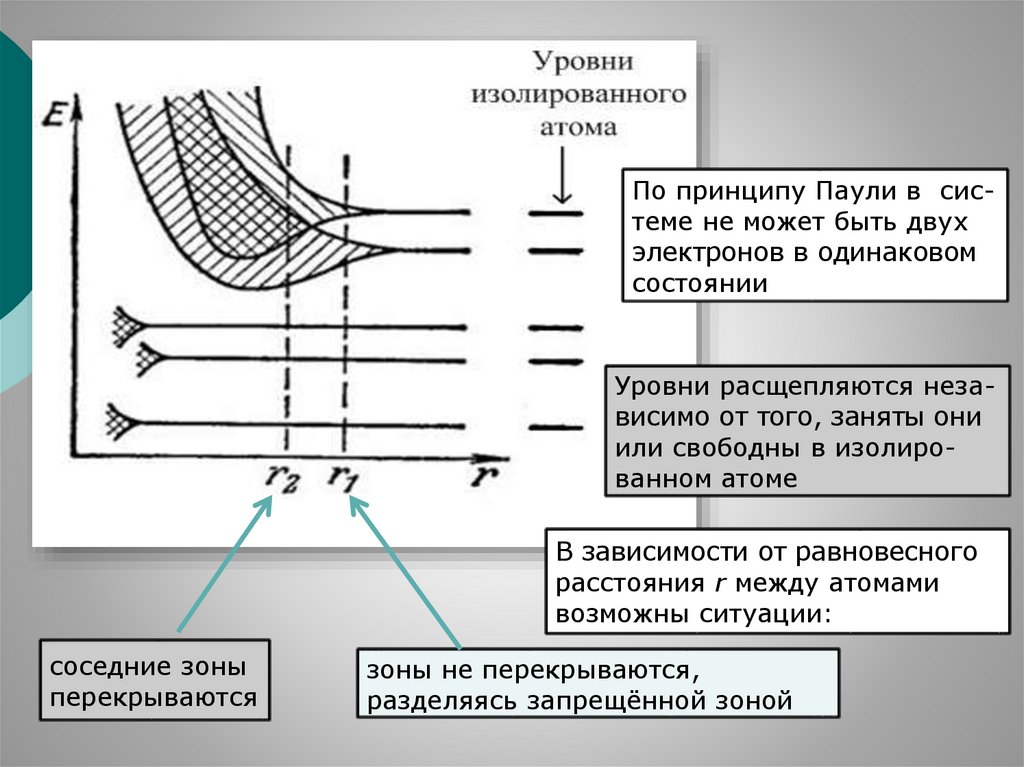
56.
По принципу Паули в системе не может быть двухэлектронов в одинаковом
состоянии
Уровни расщепляются независимо от того, заняты они
или свободны в изолированном атоме
В зависимости от равновесного
расстояния r между атомами
возможны ситуации:
соседние зоны
перекрываются
зоны не перекрываются,
разделяясь запрещённой зоной
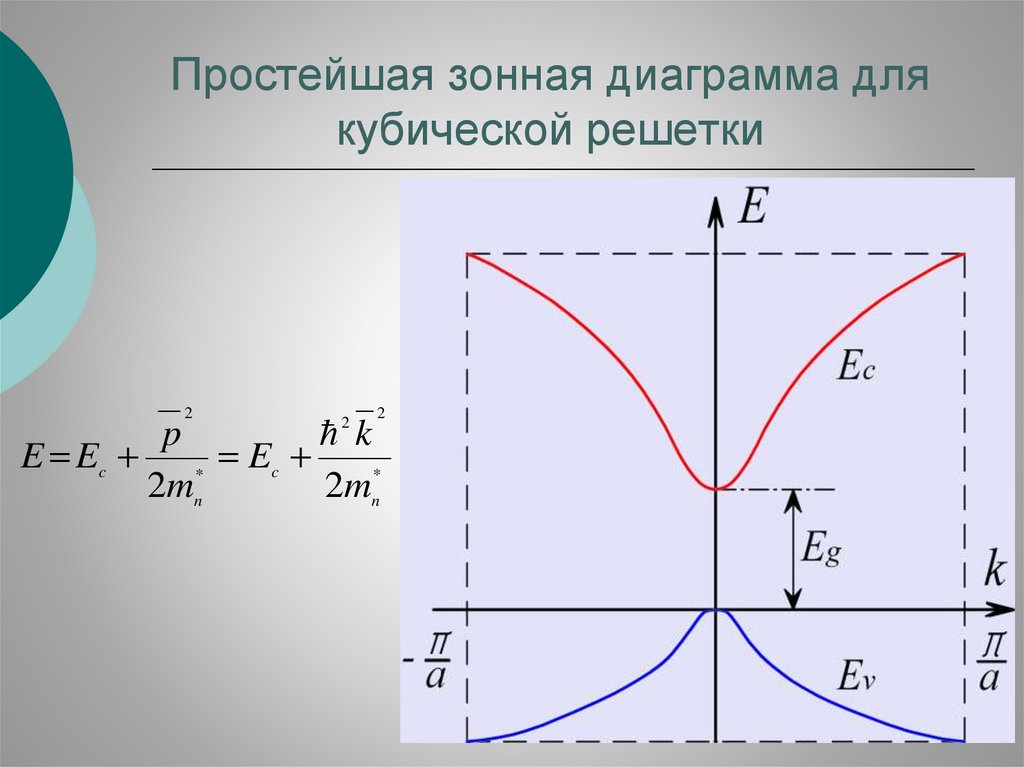
57.
Простейшая зонная диаграмма длякубической решетки
2
2
p
k
E Ec
Ec
*
2 mn
2mn*
2
58.
Классификация веществ по ширинезапрещенной зоны
59.
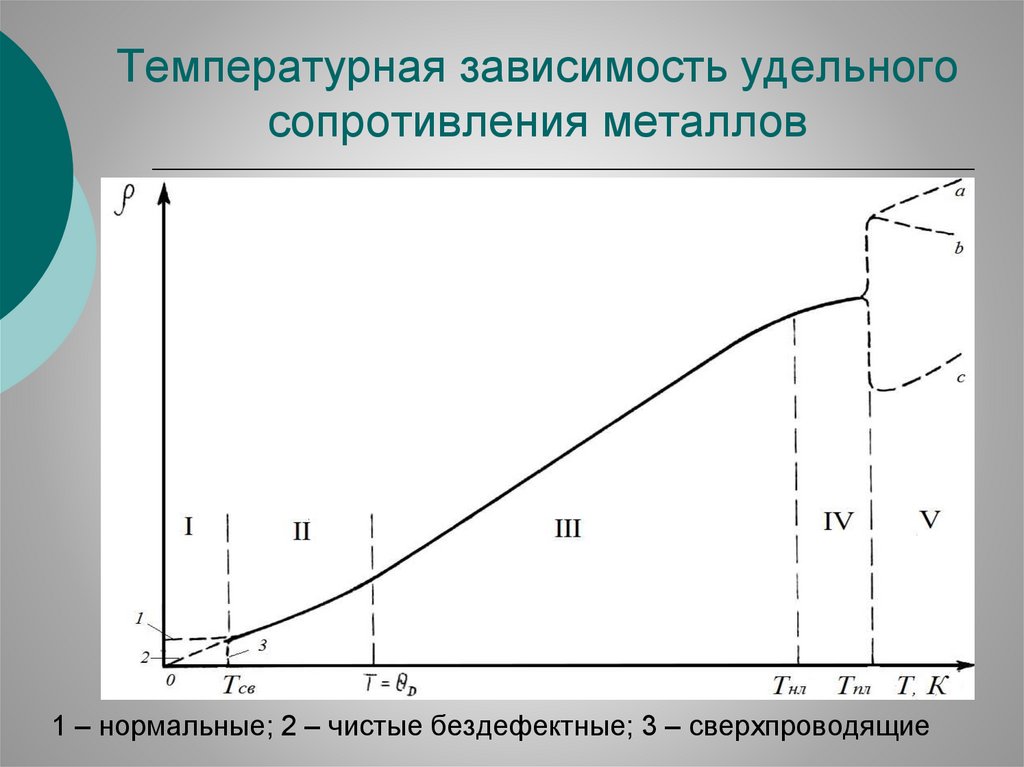
Температурная зависимость удельногосопротивления металлов
1 – нормальные; 2 – чистые бездефектные; 3 – сверхпроводящие
60.
Рассеяние носителей зарядаЭлектрическое сопротивление постоянному току, приводящие к переходу электрической энергии в теплоту,
называют активным или омическим. Для кристаллических материалов оно связано с рассеянием
электронов проводимости и может быть записано:
ρΣ = ρф +ρпр + ρд +ρгр
где ρф – рассеяние на тепловых колебаниях кристаллической решетки (фононах), ρпр, ρд и ρгр - примесных
атомах, дефектах структуры и границах зерен, соответственно. Видно, что электрическое сопротивление
зависит от температуры и только при Т = 0 К, когда
тепловые колебания атомов отсутствуют, оно полностью
определяется составом и кристаллической структурой
материала.
61.
Активное и полное сопротивлениеЭлектрическое сопротивление переменному току называется полным – в его цепи любой проводник, помимо
активного (Rа), обладает емкостным Rс и индуктивным
RL сопротивлениями, которые обусловлены передачей
энергии электрическому и магнитному полям.
С увеличением частоты полное сопротивление возрастает, поскольку растут Rс и RL и ток вытесняется к
поверхности проводника (скин-эффект).
Ток в диэлектриках называют током утечки и различают
IV- протекающий через объём материала и – IS ,
протекающий по поверхности образца. Соответственно
диэлектрики характеризуют объёмным ρv (Ом*м) и
поверхностным ρs (Ом) удельным электрическим
сопротивлением.
62.
Составляющие магнитного моментаатома
Все материалы, помещенные во внешнее магнитное
поле, намагничиваются. Намагничивание связано с
наличием у атомов молекул магнитного момента. Для
единичного атома он равен сумме векторов
орбитальных моментов электронов и спиновых
моментов электронов и ядра.
Характеристикой намагничивания материалов является
намагниченность, равная сумме магнитных моментов
атомов единице объёма: J = ΣMат /V (для
однородного намагниченного материала). Магнитная
восприимчи-вость дает связь намагниченности с
напряженностью внешнего магнитного поля: χ = J/H.
В зависимости от знака и величины χ материалы делятся
на диамагнетики, парамагнетики и ферро-(ферри-)
магнетики.
63.
Ориентация магнитных моментов вслабо- и сильномагнитных материалах
64.
Виды доменных структур65.
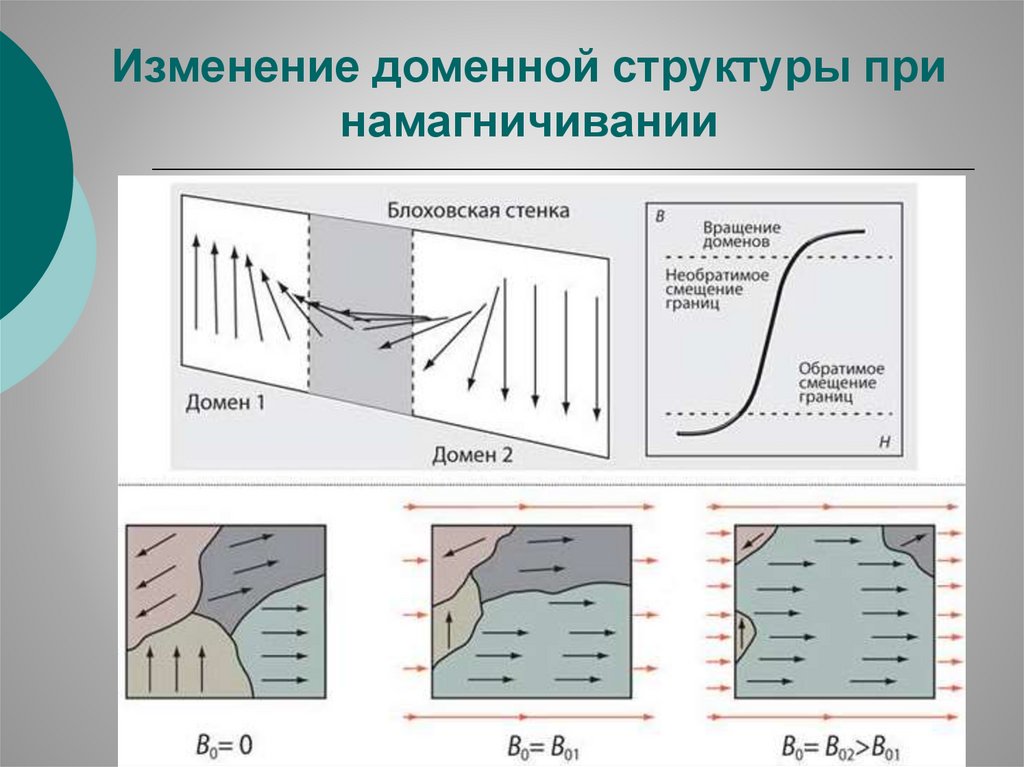
Изменение доменной структуры принамагничивании
66.
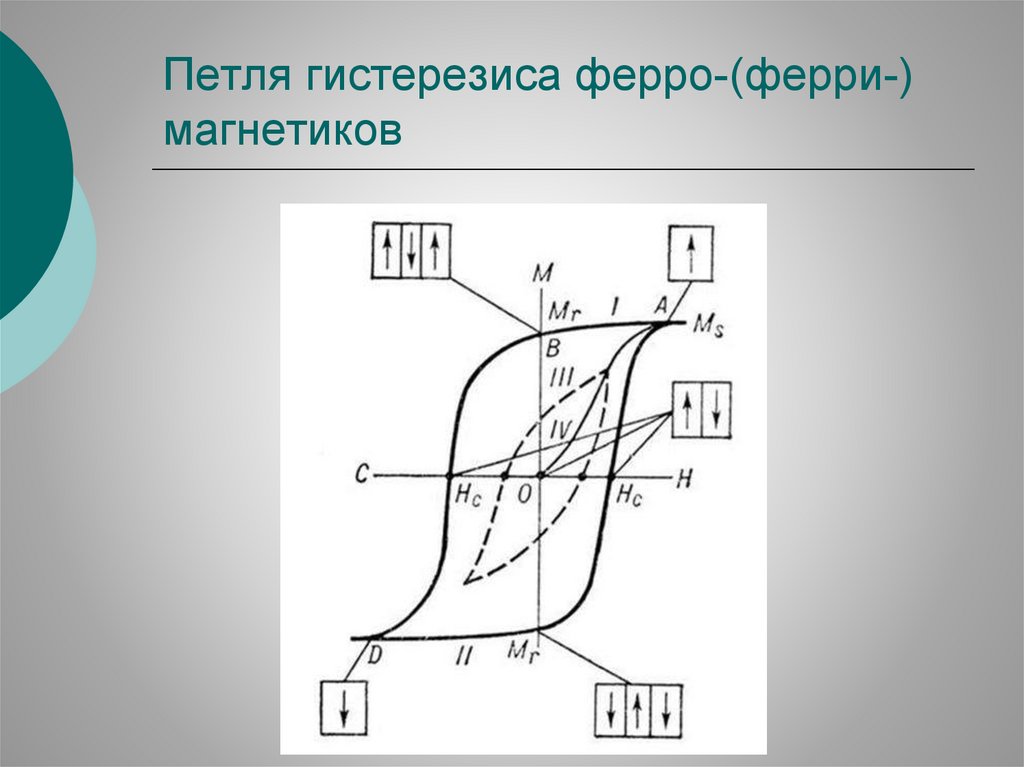
Петля гистерезиса ферро-(ферри-)магнетиков
67.
Технологические свойства материаловТехнологические свойства материалов характеризуют их податливость технологическим воздействиям при переработке в изделия.
Значения этих свойств позволяют обоснованно и рационально проектировать и проводить технологические
процессы изготовления изделий.
Основными технологическими свойствами являются:
обрабатываемость (резанием, давлением, литьём),
свариваемость,
паяемость,
адгезионная способность,
склонность к деформации и короблению при термообработке и др.
68.
Литейные свойстваЖидкотекучесть – способность материала заполнять
форму в жидком состоянии. Жидкотекучесть зависит от
вязкости и удельной теплоты плавления материала, а
также от теплопроводности и начальной температуры
пресс-формы.
Литейная форма для определения жидкотекучести
69.
Литейные свойстваУсадка
– свойство литейных сплавов уменьшать объём при затвердевании и охлаждении. Измеряется в % от исх. размера или объема.
Усадочные процессы протекают с момента заливки расплавленного
металла в форму вплоть до полного охлаждения отливки.
Линейная усадка – уменьшение линейных размеров отливки при её
охлаждении от температуры, при которой образуется прочная корка
расплава, до температуры окружающей среды.
Объёмная усадка – уменьшение объёма расплава при его охлаждении
в литейной форме. Объемная усадка приблизительно равна утроенной
линейной.
Форма для определения линейной усадки по ГОСТ 16817
70.
Литейные свойстваУсадка в отливках проявляется в виде:
усадочных раковин – сравнительно крупных полостей,
расположенных в местах отливки, которые затвердевают
последними;
усадочной пористости - скопление пустот, образовавшихся
в тех местах отливки, которые затвердели последними без
доступа к ним расплавленного металла;
трещин;
короблений - изменение формы и размеров отливки под
влиянием напряжений, возникающих при охлаждении.
Линейная усадка:
для серого чугуна составляет 0,9-1,3%,
для высокопрочного чугуна до 1.7%,
для углеродистых сталей 2-2,4%,
для алюминиевых литейных сплавов - 0,9-1,5%,
для медных литейных сплавов - 1,4-2,3%.
71.
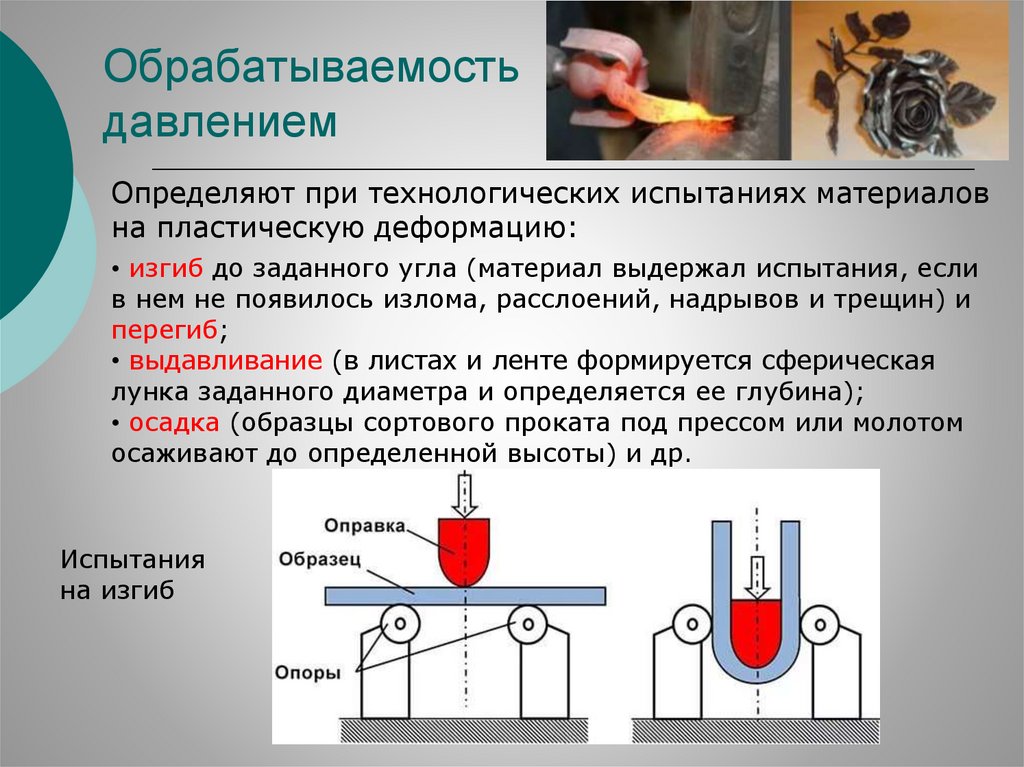
Обрабатываемостьдавлением
Определяют при технологических испытаниях материалов
на пластическую деформацию:
• изгиб до заданного угла (материал выдержал испытания, если
в нем не появилось излома, расслоений, надрывов и трещин) и
перегиб;
• выдавливание (в листах и ленте формируется сферическая
лунка заданного диаметра и определяется ее глубина);
• осадка (образцы сортового проката под прессом или молотом
осаживают до определенной высоты) и др.
Испытания
на изгиб
72.
Обрабатываемостьрезанием
Характеризуют:
качеством обработки (шероховатость обработанной
поверхности и точность размеров и формы и др.);
стойкостью инструмента;
сопротивлением резанию (скорость и сила резания);
видом стружкообразования и др.
Свариваемость и паяемость – свойство материала
образовывать сварное или паяное соединение требуемого
качества.
Сварка и пайка производятся различными методами (электрич. дугой, контактная, плазменная, электронно-лучевая, газовая и др.), но основными
показателями технологичности являются: механические свойства соединений; качество соединений и швов;
их длительная прочность и др.
73.
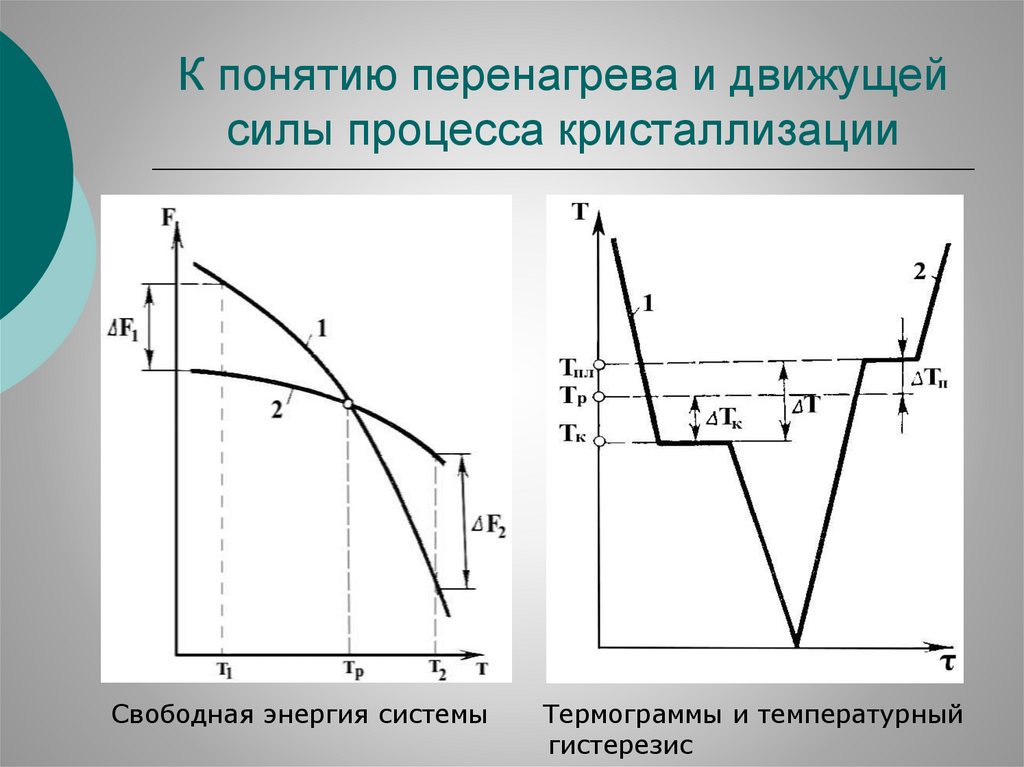
Кристаллизация – фазовый переход веществаиз состояния переохлажденной (перенасыщенной)
маточной среды в твердую кристаллическую фазу
Различают первичную (кристаллы образуются из
жидкости или газа) и вторичную (распад веществ в
твердой фазе) кристаллизацию.
Движущей силой процесса является уменьшение
свободной энергии Гиббса G при фазовом переходе.
Темп-ра Тр, при которой G жидкого и твердого состояния одинаковы называется равновесной темп-рой кристаллизации. При Тр и отсутствии внешн. воздействий тв-дая и
ж-кая фазы могут сосуществовать неограниченное время.
Кристаллизация начинается при переохлаждении системы на ΔТ= Тр - Тк, что вызывает изменение ее свободной
энергии на ΔG. Аналогично для плавления кристаллического тела необходим перенагрев ΔТ относительно Тр.
74.
К понятию перенагрева и движущейсилы процесса кристаллизации
Свободная энергия системы
Термограммы и температурный
гистерезис
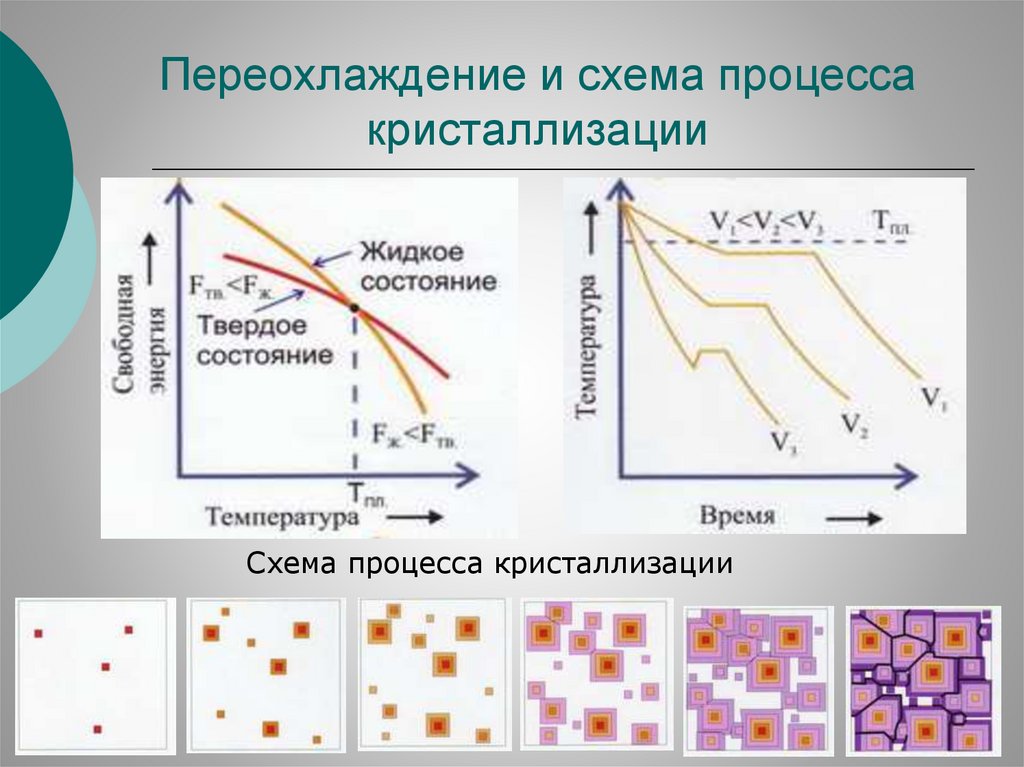
75.
Переохлаждение и схема процессакристаллизации
Схема процесса кристаллизации
76.
Зародышеобразование –образование центров кристаллизации, способных
расти внутри собственного расплава.
Различают два вида возникновения зародышей кристаллической
фазы: гомогенное и гетерогенное.
Гомогенное зародышеобразование характерно для чистых
переохлажденных расплавов. Зародыши твердой фазы это
результат флуктуаций свойств жидкости или локальных
изменений средних значений свойств, вызываемых тепловым
движением частиц.
Т.е. в отдельных микрообъемах расплава возможно случайное
образование динамичных группировок со структурой, напоминающей расположение частиц в кристалле этого вещества.
Вследствие теплового движения частиц эти группировки могут
распадаться или вырасти до определенных размеров, становясь
стабильными центрами кристаллизации или зародышами.
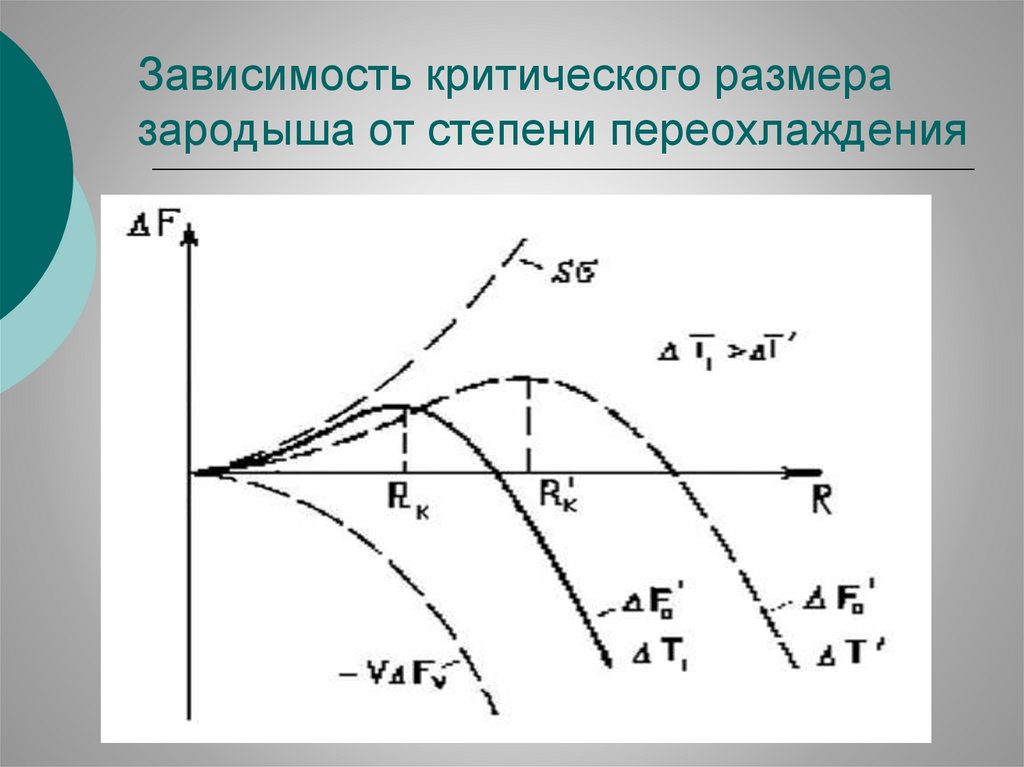
77.
Понятие критического зародышаИзменение свободной энергии Гиббса G (работа зародышеобразования), связанное с возникновением зародыша
при Tк < TР, является разностью между свободной энергией поверхности раздела, необходимой для образования новой границы между твердой и жидкой фазами, и
изменением объемной свободной энергии двух фаз.
Для сферической частицы радиуса r это изменение
имеет вид:
G = 4 r 2 sL – (4/3) r 3 Gv,
где Gv = kds T / Tр,
k Нпл – удельная теплота кристаллизации;
ds – плотность твердой фазы;
sL – поверхностная плотность энергии (поверхностное
натяжение) на границе кристалл – расплав;
Gv – разность объемных плотностей своб. энергии фаз.
78.
Размер критического зародышаРост зародыша возможен, если он будет сопровождается
уменьшением свободной энергии.
Для этого его радиус должен превышать некоторое критическое
значение r*.
Критический размер r* соответствует условию максимума G:
( G / r)|r=r* = 0, r* = 2σsLTe / k dsΔT.
Подставив критический размер в уравнение для G, получим работу
образования критического зародыша:
G* = (16/3) SL3(Te / kdsΔT )2.
79.
Зависимость критического размеразародыша от степени переохлаждения
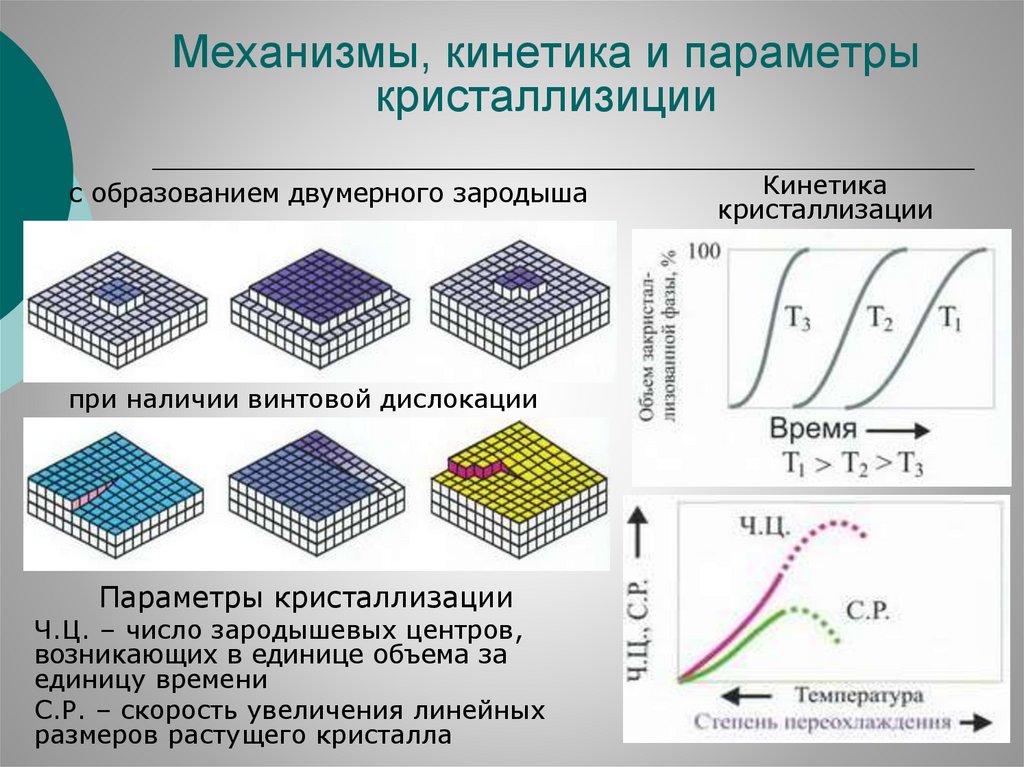
80.
Механизмы, кинетика и параметрыкристаллизиции
с образованием двумерного зародыша
при наличии винтовой дислокации
Параметры кристаллизации
Ч.Ц. – число зародышевых центров,
возникающих в единице объема за
единицу времени
С.Р. – скорость увеличения линейных
размеров растущего кристалла
Кинетика
кристаллизации
81.
Строение закристаллизованногометалла
Дендритный рост
Строение спокойно
закристаллизовавшейся отливки
82.
Внутрикристаллитная и зональнаяликвация
Внутрикристаллитная ликвация (по составу) характерна для сплавов, образующих твердые растворы.
Скорость затвердевания расплава обычно превышает скорость диффузии, которая необходима для выравнивания
химического состава. Как следствие, участки отливки,
закристаллизовавшиеся в разное время, отличаются по
составу.
Зональная ликвация (по плотности) наблюдается в
массивных отливках, которые медленно охлаждаются.
Происходит по двум основным причинам:
расслоение расплава из-за различной плотности компонентов при недостаточном его перемешивании в ходе
плавки и заливки,
выпадение из расплава легких и тяжелых кристаллизующихся фаз.
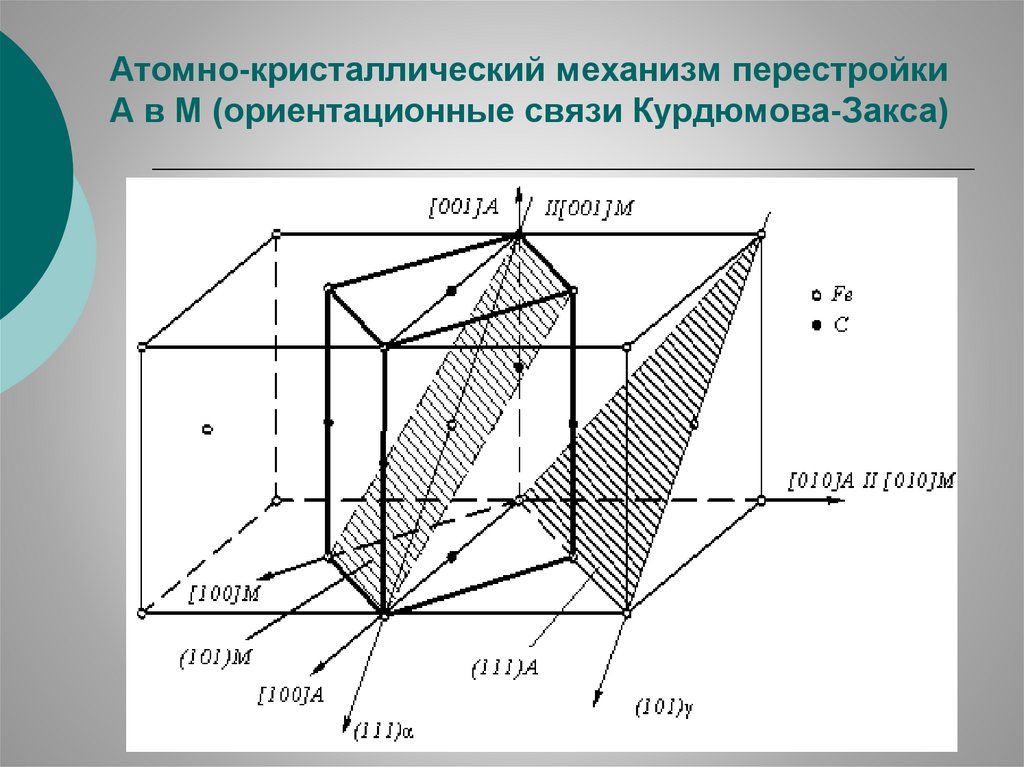
83.
Атомно-кристаллический механизм перестройкиА в М (ориентационные связи Курдюмова-Закса)
84.
Фазы сплавовФаза – гомогенная часть гетерогенной системы имеющая одинаковый состав, одно и то же агрегатное состояние и отделенная от остальных составляющих границей раздела, при переходе через которую свойства меняются скачкообразно.
Сплавы могут быть двойными, тройными и многокомпонентными.
В сплавах компоненты могут вступать во взаимодействие с образованием жидких и твердых растворов, химических соединений, интерметаллидных и промежуточных фаз.
Твердым раствором называют фазу, состоящую из двух и
более компонентов, один из которых, сохраняя кристаллическую решетку, является растворителем, а другие равномерно
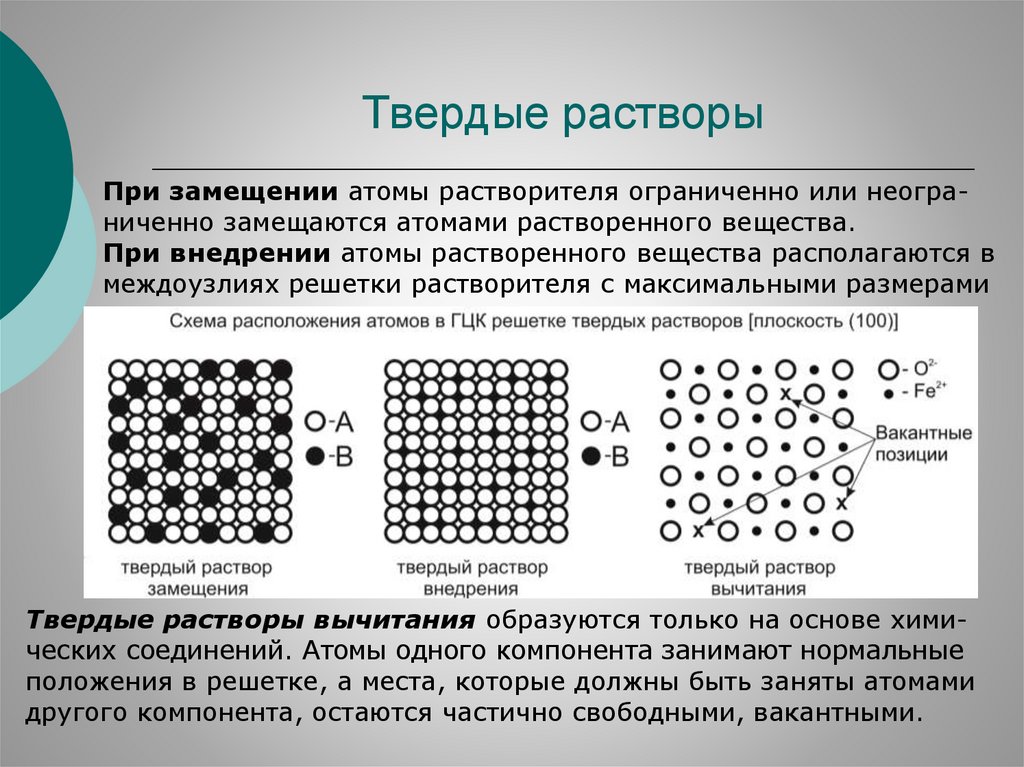
распределяются в решетке растворителя не меняя ее типа.
По характеру распределения компонентов различают твердые
растворы замещения, внедрения и вычитания
85.
Твердые растворыПри замещении атомы растворителя ограниченно или неограниченно замещаются атомами растворенного вещества.
При внедрении атомы растворенного вещества располагаются в
междоузлиях решетки растворителя с максимальными размерами
Твердые растворы вычитания образуются только на основе химических соединений. Атомы одного компонента занимают нормальные
положения в решетке, а места, которые должны быть заняты атомами
другого компонента, остаются частично свободными, вакантными.
86.
Твердые растворыПри образовании любых твердых
растворов
происходят
электрохимические (разная
валентность
и
различия
в
строении внешних электронных
оболочек атомов) и размерные
(различные размеры атомов)
искажения
кристаллической
решетки и изменение свойств
сплавов
по
сравнению
с
исходными
компонентами
(рост В и твердости, и др.,
уменьшение , пластичности,
ТКЛР, вязкости и др.).
87.
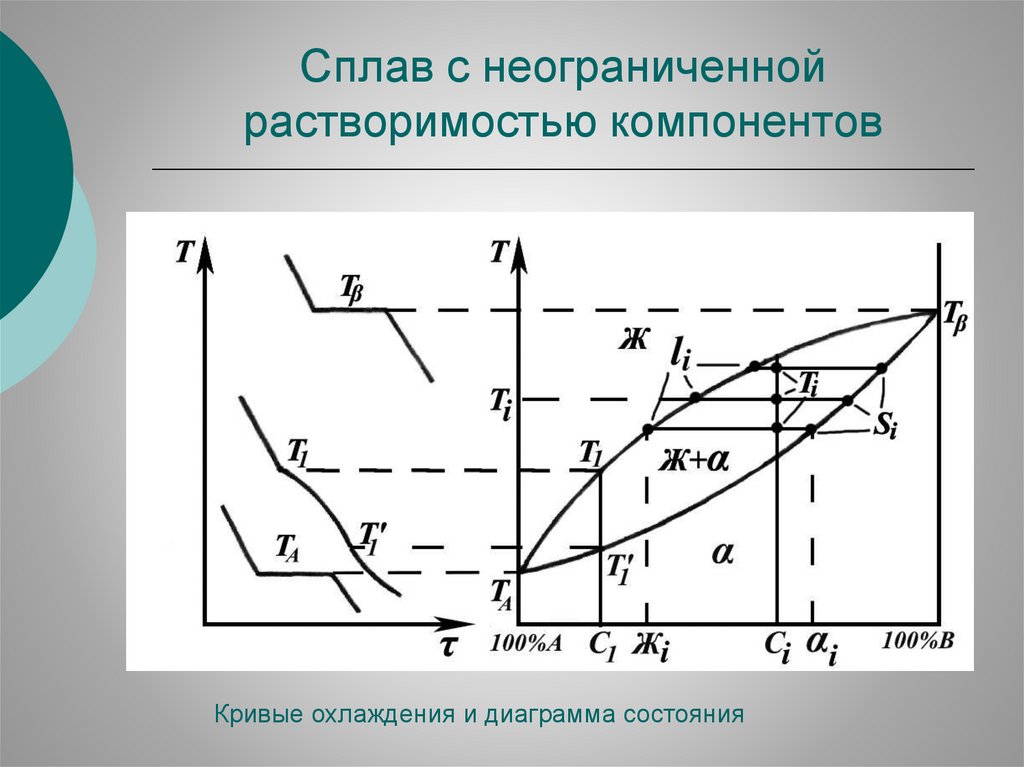
Системы с неограниченной растворимостьюкомпонентов
Неограниченная растворимость возможна только в твердых
растворах замещения при выполнение трех условий:
1. Компоненты должны иметь решетки одинакового типа. Если
компоненты полиморфны, то неограниченная растворимость
может наблюдаться только между изоморфными модификациями.
2. Атомные диаметры могут различается не более, чем на 15%
(правило Юм-Розери). В ином случае при больших концентрациях возникают большие искажения решетки и гомогенный раствор не может существовать.
3. Физико-химические свойства элементов, образующих твердые растворы, должны быть близкими, т.к. при заметном их
различии (большой разнице в электроотрицательностей)
появляется тенденция к образованию химических
соединений. Поэтому непрерывные ряды твердых растворов
образуют элементы из одной группы или из соседних групп
Периодической системы.
88.
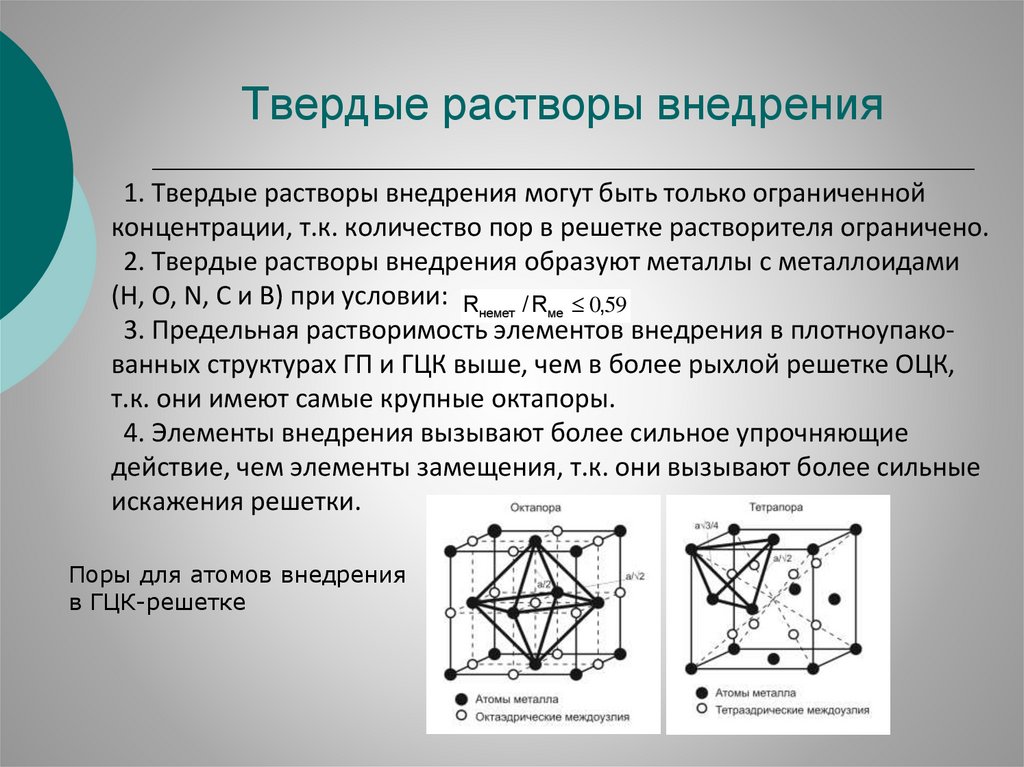
Твердые растворы внедрения1. Твердые растворы внедрения могут быть только ограниченной
концентрации, т.к. количество пор в решетке растворителя ограничено.
2. Твердые растворы внедрения образуют металлы с металлоидами
(H, O, N, C и В) при условии: Rнемет. / Rме 0,59
3. Предельная растворимость элементов внедрения в плотноупакованных структурах ГП и ГЦК выше, чем в более рыхлой решетке ОЦК,
т.к. они имеют самые крупные октапоры.
4. Элементы внедрения вызывают более сильное упрочняющие
действие, чем элементы замещения, т.к. они вызывают более сильные
искажения решетки.
Поры для атомов внедрения
в ГЦК-решетке
89.
Химические соединения имеханические смеси
Химические соединения в сплавах это фазы постоянного состава, соотношение компонентов в которых
подчиняется правилу валентности.
Их характерными особенностями являются:
отличие кристаллических строения от структуры исходных компонентов;
соотношение компонентов кратно целым числам;
отличие свойств от свойств исходных компонентов;
положительный тепловой эффект образования.
Существуют также химические соединения переменного
состава (не соответствуют правилу валентности) или
промежуточные фазы.
Компоненты сплава между собой не взаимодействующие
образуют механические смеси.
90.
Диаграммы состоянияДля определения характера и температур фазовых и
структурных превращений, количества фаз в сплаве и их
состава строят диаграммы фазового равновесия (диаграммы состояния), т.е. графическое изображение фазового состава сплава в состоянии равновесия в зависимости от содержания компонентов и температуры.
Реальные сплавы находятся обычно в неравновесном
(метастабильном) состоянии. Их исследование также
является задачей материаловедения, т.к. они часто
обладают ценными свойствами.
Диаграммы состояния строят, используя правило фаз
Гиббса.
Оно выполняется если: фазы имеют большие размеры,
т.е. можно пренебречь поверхностными явлениями;
каждый компонент системы может переходить через
поверхность раздела фаз.
91.
ПРАВИЛО ФАЗ ГИББСАВариантность (C) (число степеней свободы) – это число внутренних и
внешних факторов (Т, V, концентрация), которые можно изменять без
изменения количества фаз в системе.
Связь между числом компонентов (К), числом фаз (Ф) и вариантностью
системы ( С ) определяется правилом фаз или законом Гиббса:
С = К – Ф + П,
где: С - число степеней свободы системы, К - количество компонентов, Ф
- количество фаз в системе, П - количество независимых переменных.
Внешними независимыми переменными являются Т и V. В твердых телах
и жидкостях давление не оказывает решающего влияния на состояние
системы, поэтому единственной внешней независимой переменной
является температура, при этом П = 1 и С = К − Ф + 1.
Для равновесия системы необходимо, чтобы количество фаз в структуре
не превышало числа компонентов более чем на 1, т.е. чтобы Ф К + 1.
92.
Сплав с неограниченнойрастворимостью компонентов
Кривые охлаждения и диаграмма состояния
93.
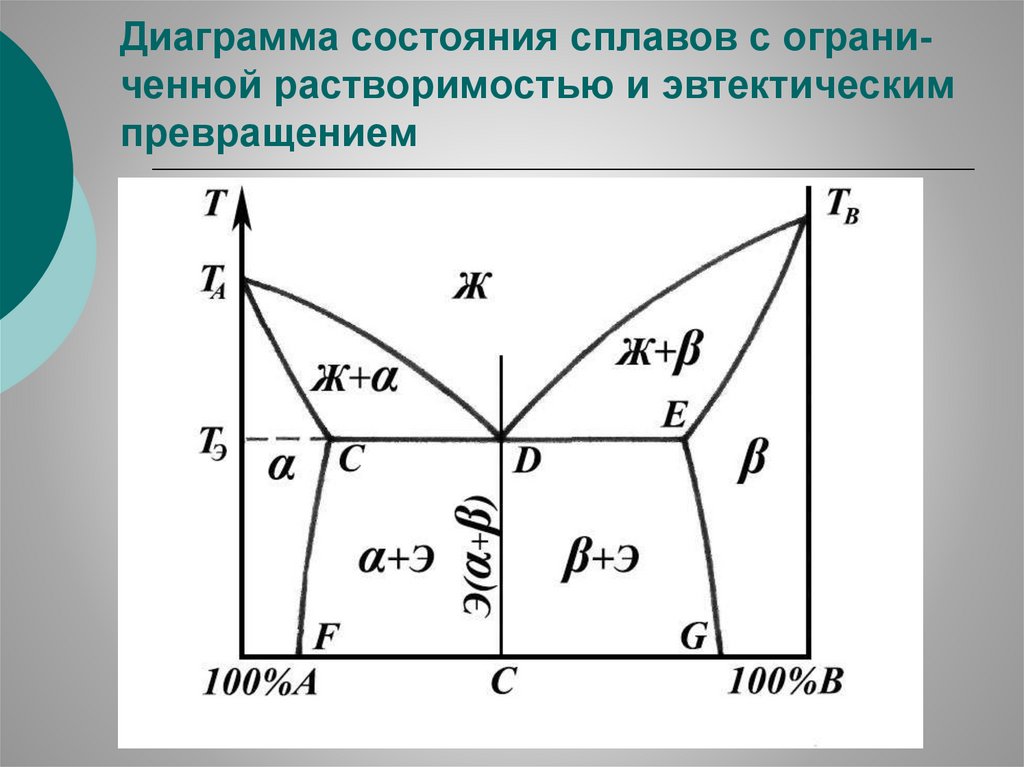
Диаграмма состояния сплавов с ограниченной растворимостью и эвтектическимпревращением
94.
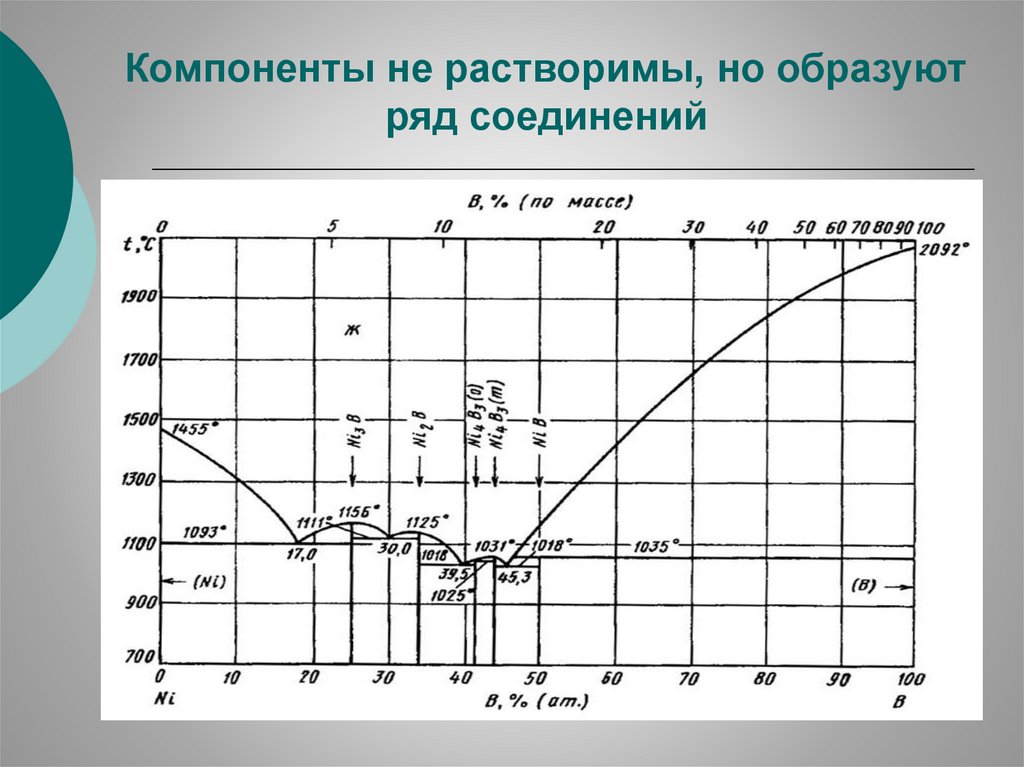
Компоненты не растворимы, но образуютряд соединений
95.
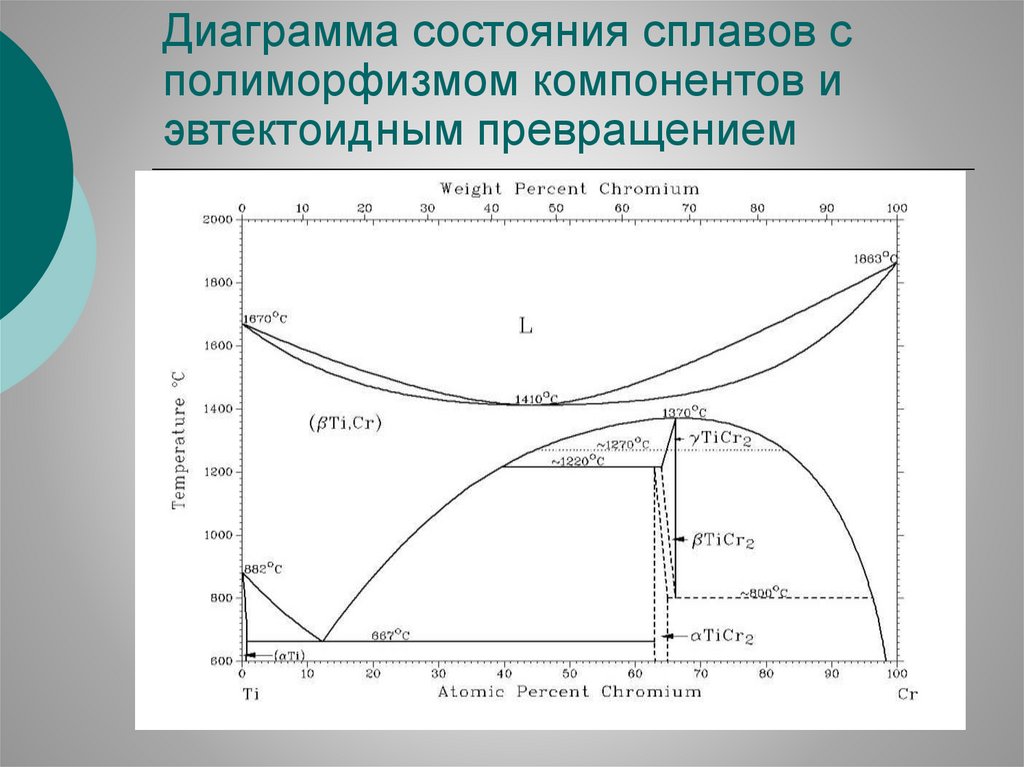
Диаграмма состояния сплавов сполиморфизмом компонентов и
эвтектоидным превращением
96.
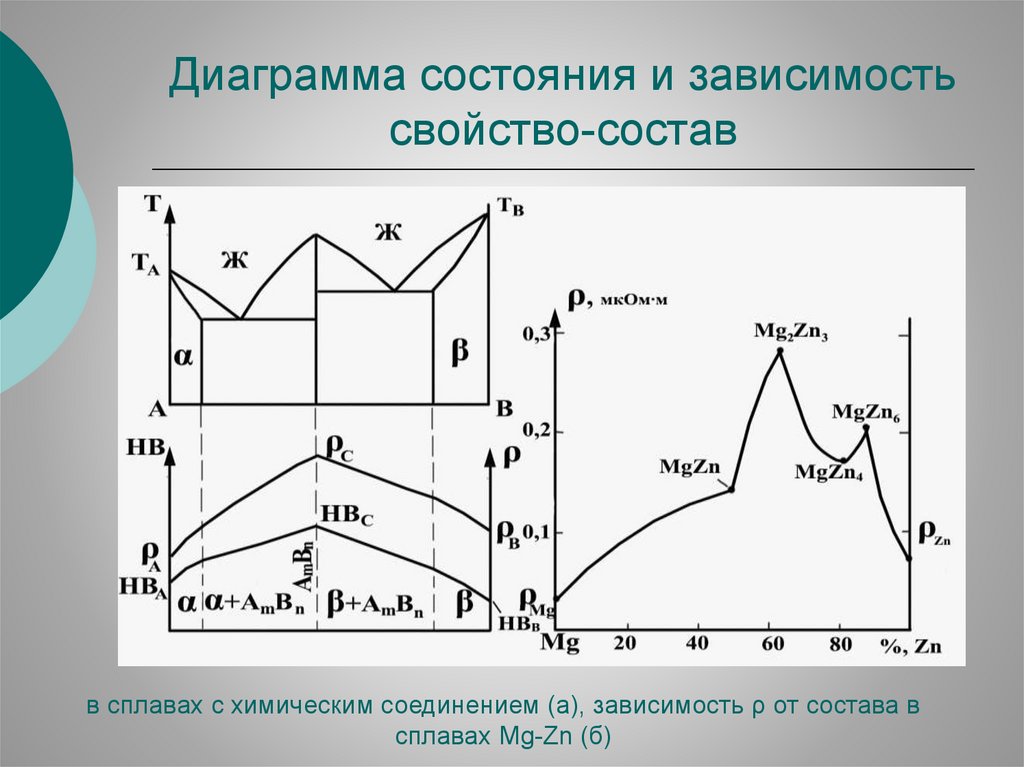
Диаграмма состояния и зависимостьсвойство-состав
в сплавах с химическим соединением (а), зависимость ρ от состава в
сплавах Mg-Zn (б)
97.
Концентрационный треугольник98.
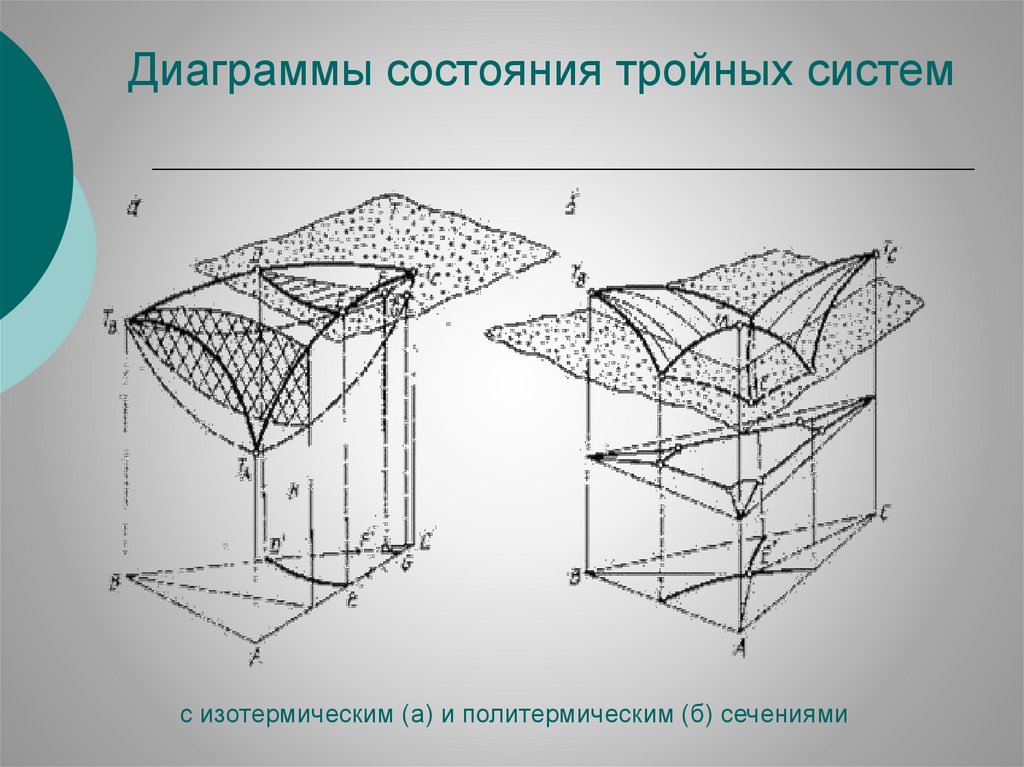
Диаграммы состояния тройных системс изотермическим (а) и политермическим (б) сечениями













































 Физика
Физика Химия
Химия








