Похожие презентации:
Химическая связь
1.
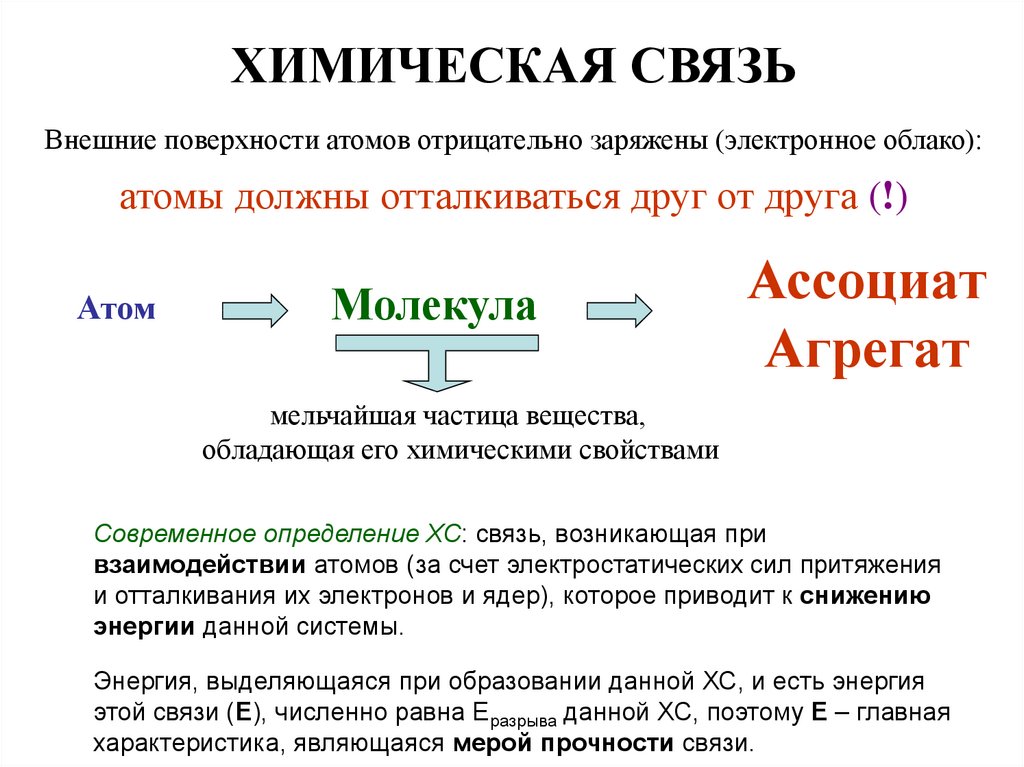
ХИМИЧЕСКАЯ СВЯЗЬВнешние поверхности атомов отрицательно заряжены (электронное облако):
атомы должны отталкиваться друг от друга (!)
Атом
Молекула
Ассоциат
Агрегат
мельчайшая частица вещества,
обладающая его химическими свойствами
Современное определение ХС: связь, возникающая при
взаимодействии атомов (за счет электростатических сил притяжения
и отталкивания их электронов и ядер), которое приводит к снижению
энергии данной системы.
Энергия, выделяющаяся при образовании данной ХС, и есть энергия
этой связи (Е), численно равна Еразрыва данной ХС, поэтому Е – главная
характеристика, являющаяся мерой прочности связи.
2.
Характеристики молекулыкачественный и количественный состав,
пространственное расположение атомов,
энергия взаимодействия атомов,
молекулярная структура (геометрическое расположение атомов в
молекуле)
• электронная структура (распределение электронной плотности между
этими атомами, а также энергетические параметры) и др.
Геометрическое строение молекул - из экспериментальных данных
электронная структура - с привлечением теорий электронного строения.
Число атомов в молекуле не ограничено:
1 атом (молекулы газов - вещество Ar),
2 атома (O2),
небольшое число атомов (S8),
много атомов (молекула вещества “найлон” содержит до 10000 атомов)
очень большое количество атомов (алмаз - практически молекула-кристалл).
Объединение атомов в молекулу происходит за счет образования
химических связей (понижение энергии системы – выделение в виде теплоты)
3.
квантовая химия:Типы ХС - разные (ковалентная, ионная, металлическая и др.)
причина - одна
Химическая связь образуется, если электроны взаимодействующих атомов
получают возможность двигаться одновременно вблизи положительных зарядов
нескольких ядер
(!)
даже качественно правильные решения уравнения Шредингера
получаются не всегда
приближенные теории
Метод валентных связей
(МВС)
Метод молекулярных орбиталей
(ММО)
ХС обеспечивается парой
электронов, движущихся в
поле двух ядер
(двухэлектронные
локализованные связи)
ХС обеспечивается электронами всех
атомов, движущимися в поле их ядер.
Используют приближение МО ЛКАО (МО
как Линейная Комбинация АО)
4.
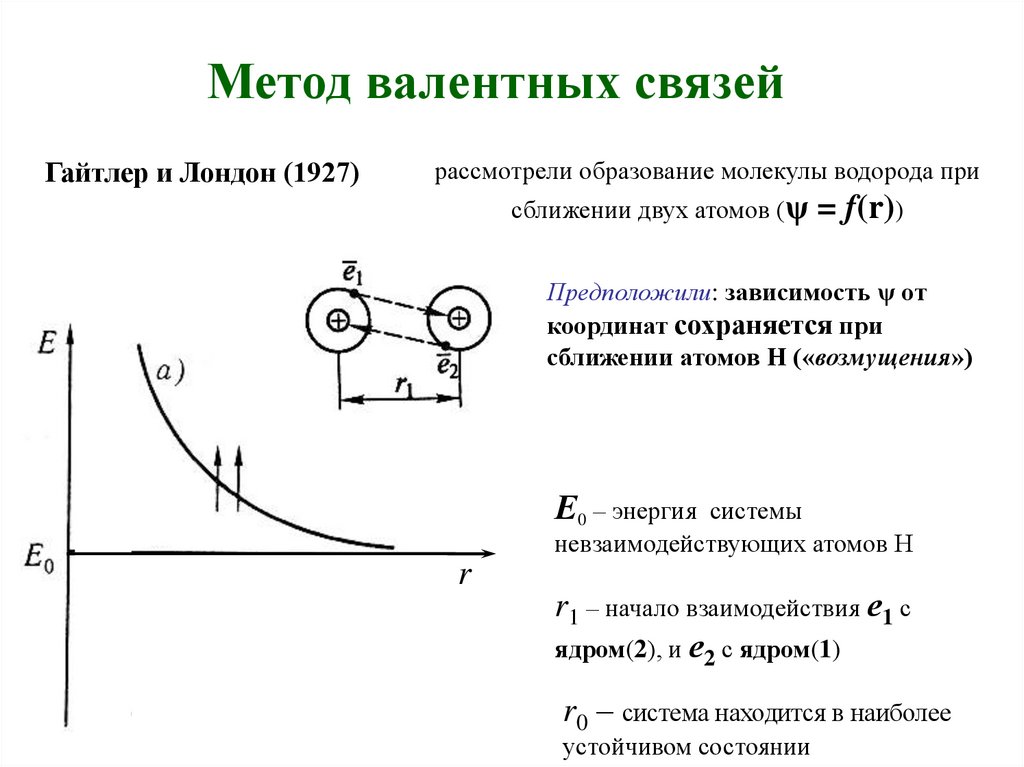
Метод валентных связейрассмотрели образование молекулы водорода при
Гайтлер и Лондон (1927)
сближении двух атомов (ψ
= f(r))
Предположили: зависимость ψ от
координат сохраняется при
сближении атомов Н («возмущения»)
Е0 – энергия
системы
невзаимодействующих атомов Н
1
r
r1 – начало взаимодействия е1 с
ядром(2), и е2 с ядром(1)
r0 – система находится в наиболее
устойчивом состоянии
5.
МВС:Ковалентная ХС образуется двумя электронами с
противоположно направленными спинами.
Эта пара электронов принадлежат обоим ядрам.
Ковалентная связь тем прочнее, чем в большей степени
перекрываются взаимодействующие электронные облака.
Схемы различных
случаев
перекрывания АО:
положит.
положит. отрицат.
нулевое
6.
Восьмиэлектронная внешняя оболочка(структуры Льюиса)
Пара электронов соответствует одной
черточке в структурных формулах
Число таких общих электронных пар (число
ковалентных связей данного атома) называется его
ковалентностью (или спинвалентностью – по числу
неспаренных е-, предоставляемых для образования пар)
МВС объясняет образование определенного числа связей, ее
направленность, удовлетворительно описывает структуру и свойства молекул.
Недостатки: МВС не объясняет существования молекулярного иона Н2+
(Есвязи 256 кДж/моль), парамагнетизм молекулы кислорода О2 и т.д.
Плюсы:
7.
ММО:Вся молекула рассматривается как единое целое,
состоящее из ядер (от бывших атомов) и электронов
(ранее принадлежавших атомам).
Все электроны являются общими для всех ядер, т.е. ХС
становятся многоцентровыми (двухцентровая в МВС –
частный случай!).
Состояние е- в молекуле описывается решением
уравнения Шредингера для молекулярной системы
Решение одного уравнения с большим числом переменных невозможно –
одноэлектронное приближение
(одноэлектронные волновые функции – МО)
Распределение электронов по МО в рамках одноэлектронного
приближения основано на тех же принципах, что и в теории
строения атома - распределение е- по атомным орбиталям
(принцип минимума энергии, принцип Паули, правило Хунда)
8.
Вблизи ядра атома МО похожа на одну из АО этого атомаМО ЛКАО:
i ci1 1 ci 2 2
1, 2
сi1,2 -
(для молекулы водорода)
- s-АО электрона вблизи первого (второго) ядер
численные коэффициенты, находятся решением ур. Шредингера
k
Для любой системы из k АО справедливо:
i ci
1
Количество МО равно суммарному количеству АО
Для молекулы Н2, ионов Н2+ и Н2- могут быть по 2 МО:
Ψ1 = с11 · ψ1 + с12 · ψ2 ,
Ψ1 = с1(ψ1 + ψ2),
Ψ2 = с21 · ψ1 + с22 · ψ2.
Ψ2 = с2(ψ1 - ψ2).
9.
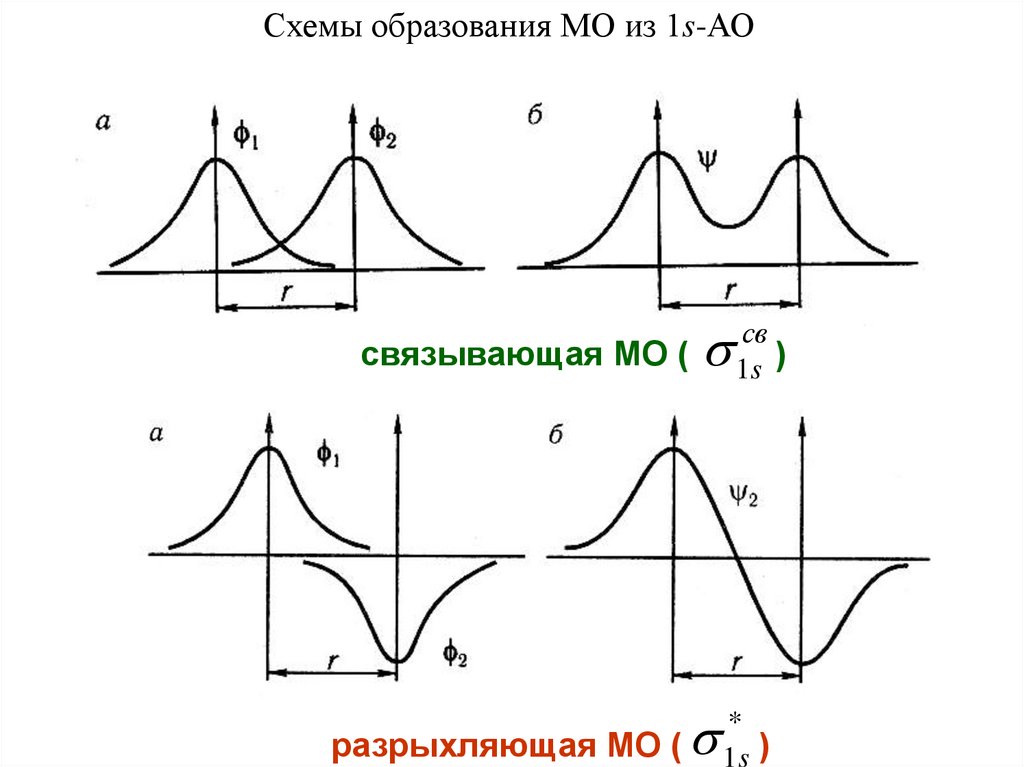
Схемы образования МО из 1s-АОсвязывающая МО (
разрыхляющая МО (
св
1s )
*
1s )
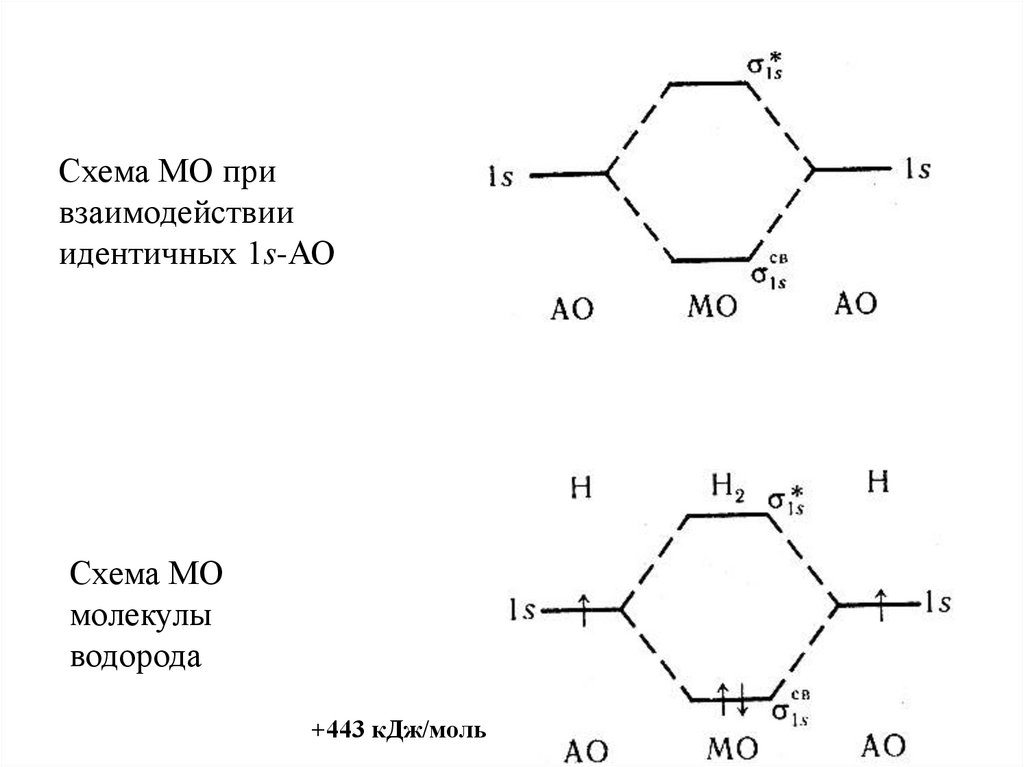
10.
Схема МО привзаимодействии
идентичных 1s-АО
Схема МО
молекулы
водорода
+443 кДж/моль
11.
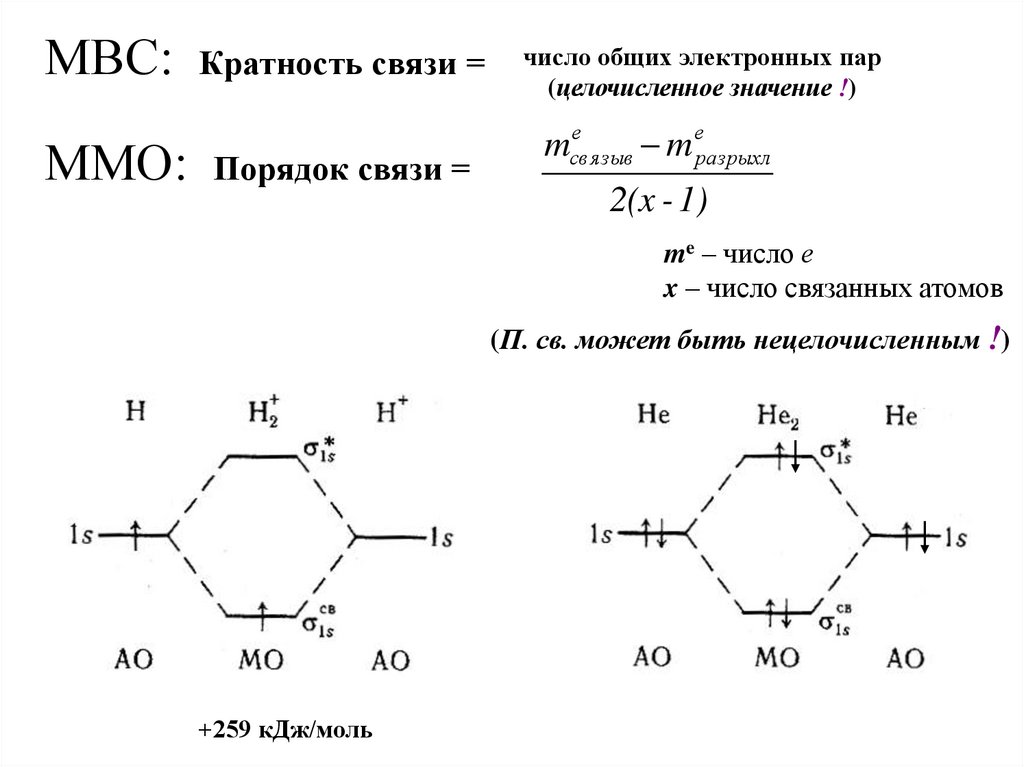
МВС:ММО:
Кратность связи =
Порядок связи =
число общих электронных пар
(целочисленное значение !)
е
mсвязыв
m еразрыхл
2(x - 1)
me – число е
x – число связанных атомов
(П. св. может быть нецелочисленным !)
+259 кДж/моль
+293 кДж/моль
12.
Виды МО:разрыхляющая
несвязывающая
связывающая
ЕМО > ЕАО
ЕМО = ЕАО
ЕМО < ЕАО
13.
H1s
св
1s
H
1s
14.
H1s
1s
H
*
1s
15.
1s1s
H
H
H2
16.
Химикам важно знать энергии и состав не всех МО,а только наиболее «чувствительных» к внешним
воздействиям – МО, на которых расположены
электроны внешних слоев (самых высоких энергий)
НВМО – низшая вакантная молекулярная орбиталь
ВЗМО – высшая занятая молекулярная орбиталь
17.
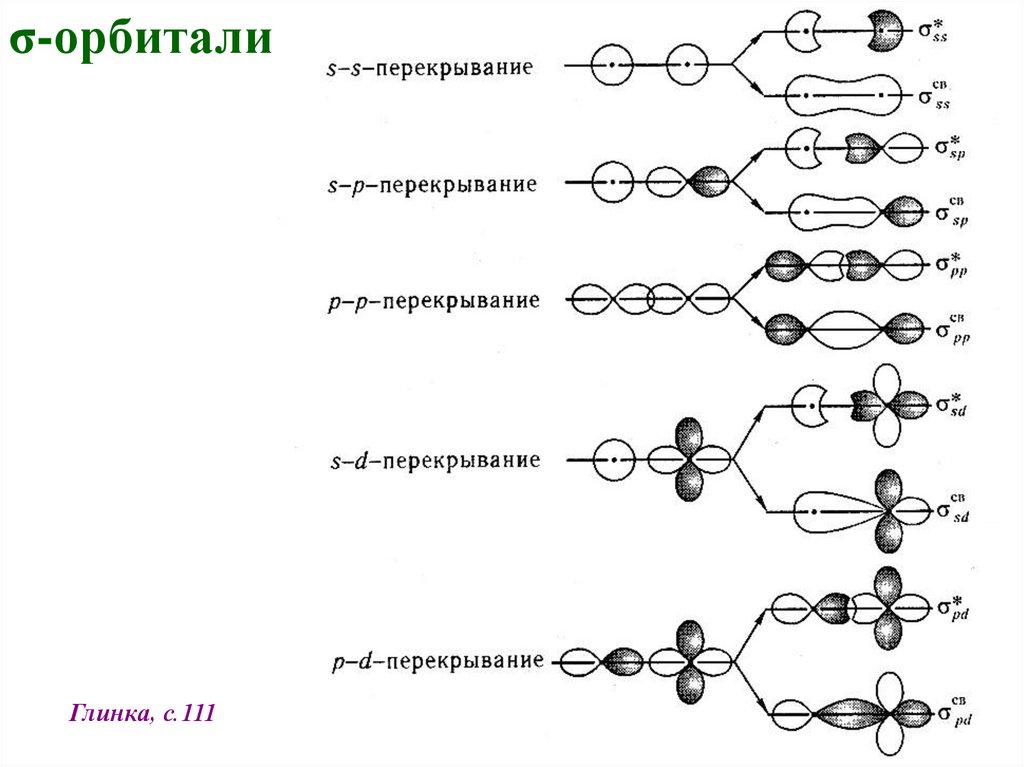
σ-орбиталиГлинка, с.111
18.
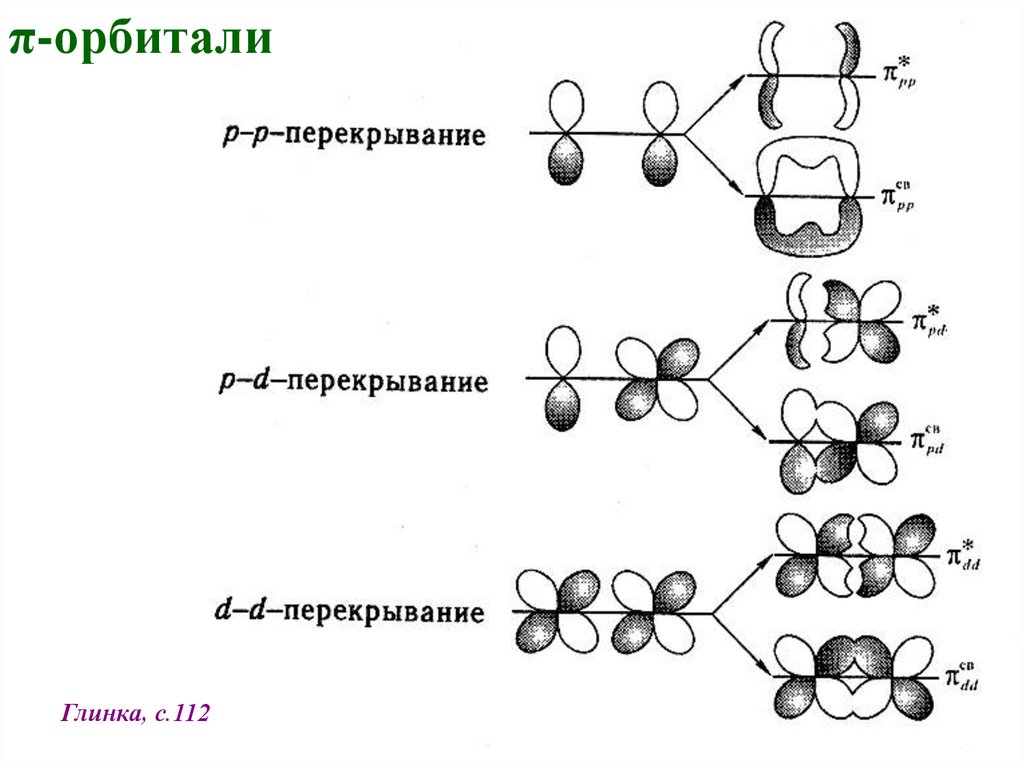
π-орбиталиГлинка, с.112
19.
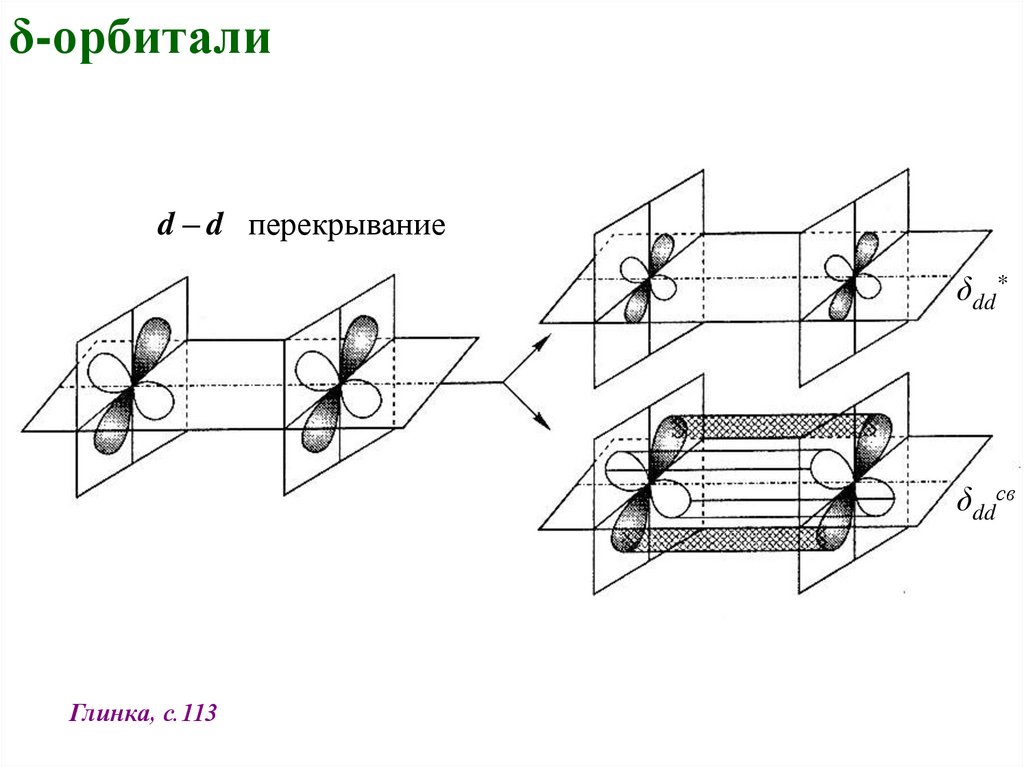
δ-орбиталиd – d перекрывание
δdd*
δddсв
Глинка, с.113
20.
Расщепление энергетических уровней (Δ)при образовании МО из АО
Δ
Δ
Δ
Δ тем больше, чем ближе энергии исходных АО, и
чем больше величина перекрывания орбиталей
21.
Виды ХСпо степени перераспределения эл. плотности между атомами:
неполярная, полярная, сильно полярная
по степени обобществления эл. плотности между атомами:
локализованная, делокализованная
по количеству связей, образуемых между атомами:
насыщаемая, ненасыщаемая
по направленности связей между атомами:
направленная, ненаправленная
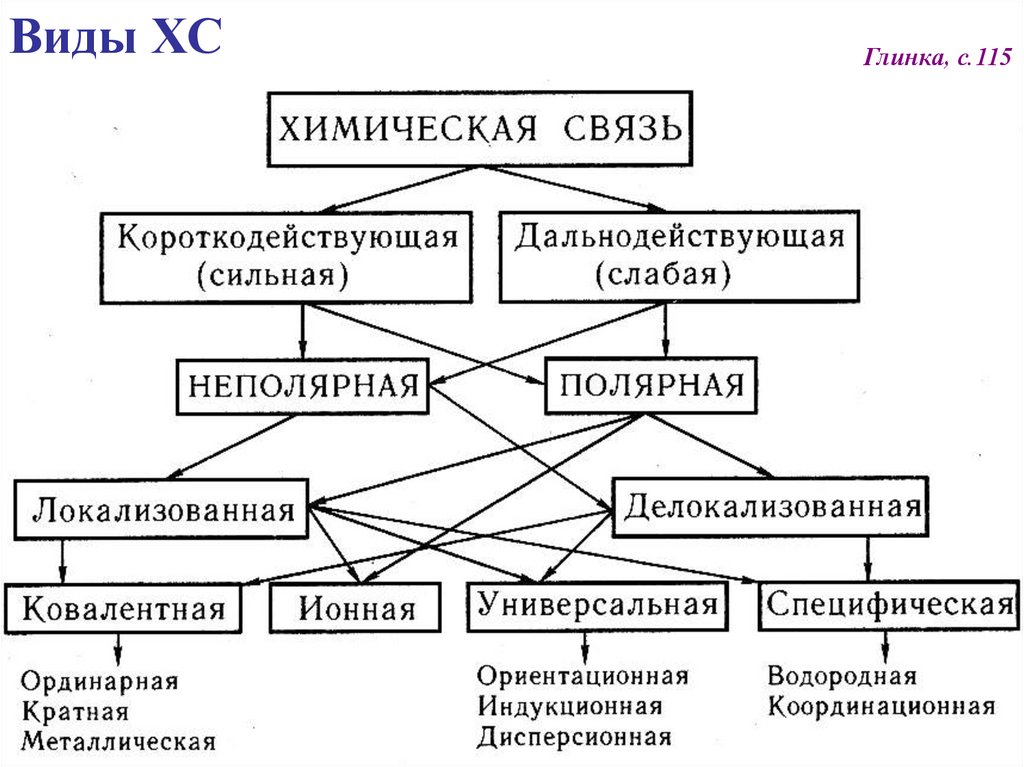
22.
Виды ХСГлинка, с.115
23.
Соединений с неполярной связью сравнительно немного.Абсолютное большинство соединений образованы сочетанием
разнородных атомов, соединенных полярной связью.
Способность атома данного элемента оттягивать к себе
общую электронную плотность =
Электроотрицательность, χ (хи)
Полинг:
(термохимический
подход)
A B
A B A B 0.102 A B
DA A DB B
D A B
2
χLi = 1.0,
χН = 2.2,
χF = 4.0
DA B
DA A
DB B
энергии
диссоциации
молекул А-В,
А-А, В-В
24.
Электроотрицательность по ПолингуГлинка, с.116
25.
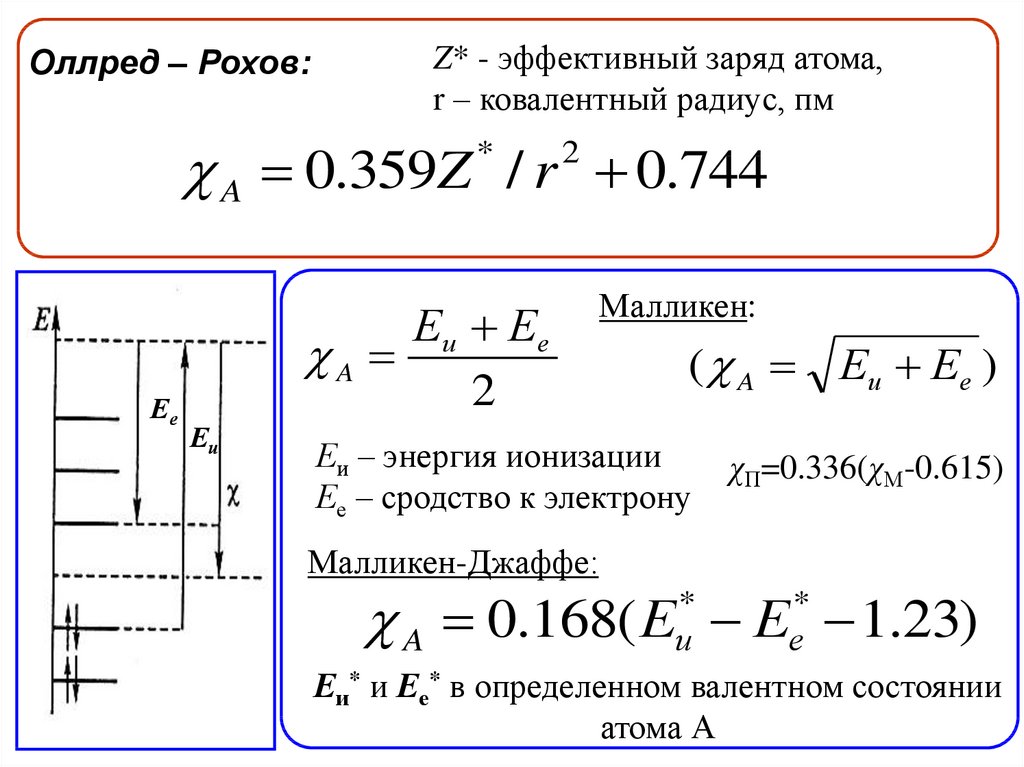
Оллред – Рохов:Z* - эффективный заряд атома,
r – ковалентный радиус, пм
A 0.359Z / r 0.744
*
Ее
2
Еи Ее
A
2
Еи
Малликен:
( A Еи Ее )
Еи – энергия ионизации
Ее – сродство к электрону
χП=0.336(χМ-0.615)
Малликен-Джаффе:
A 0.168( Е Е 1.23)
*
и
*
е
Еи* и Ее* в определенном валентном состоянии
атома А
26.
Выравнивание электроотрицательностейПринцип выравнивания электроотрицательностей при образовании
устойчивых связей постулирован Сандерсоном (1960)
Если два атома с разными Э.о. соединяются, то в
молекуле их электроотрицательности выравниваются
промежуточное значение Э.о.:
A B
Движущая сила – выравнивание энергий связывающих орбиталей атомов:
А + е- - χА должна уменьшаться
А - е- - χА должна увеличиваться
Примеры:
атом Ве – низкая Э.о., ион Ве2+ - сильно притягивает электрон
атом О – высокая Э.о., ион О2- - низкое сродство к электрону
27.
Понятие Э.о. оказалось полезным для понимания,объяснения и даже предсказания многих свойств,
касающихся энергии и распределения заряда в
химических связях (ионность и полярность связи,
энергия диссоциации и др.)
Известно более 20 различных шкал электроотрицательности
Различия:
• расчеты основаны на совершенно различных подходах
• абсолютные значения Э.о., полученные разными
методами, значительно различаются между собой
Общее:
• общая тенденция совпадает: наибольшей
электроотрицательностью обладает фтор,
наименьшей – тяжелые щелочные металлы
• величины Э.о. в разных шкалах связаны между
собой простыми соотношениями
28.
Параметрами, характеризующими химическую связь (кромеэнергии), являются ее длина, полярность и поляризуемость
Длина связи
lH-H (0.074 нм) < 2rH (0.106 нм) - среднее расстояние между ядрами атомов
lH-H
rH
чем меньше длина связи (т.е. меньше атомные радиусы)
и больше заряды ядер, тем прочнее должна быть связь
29.
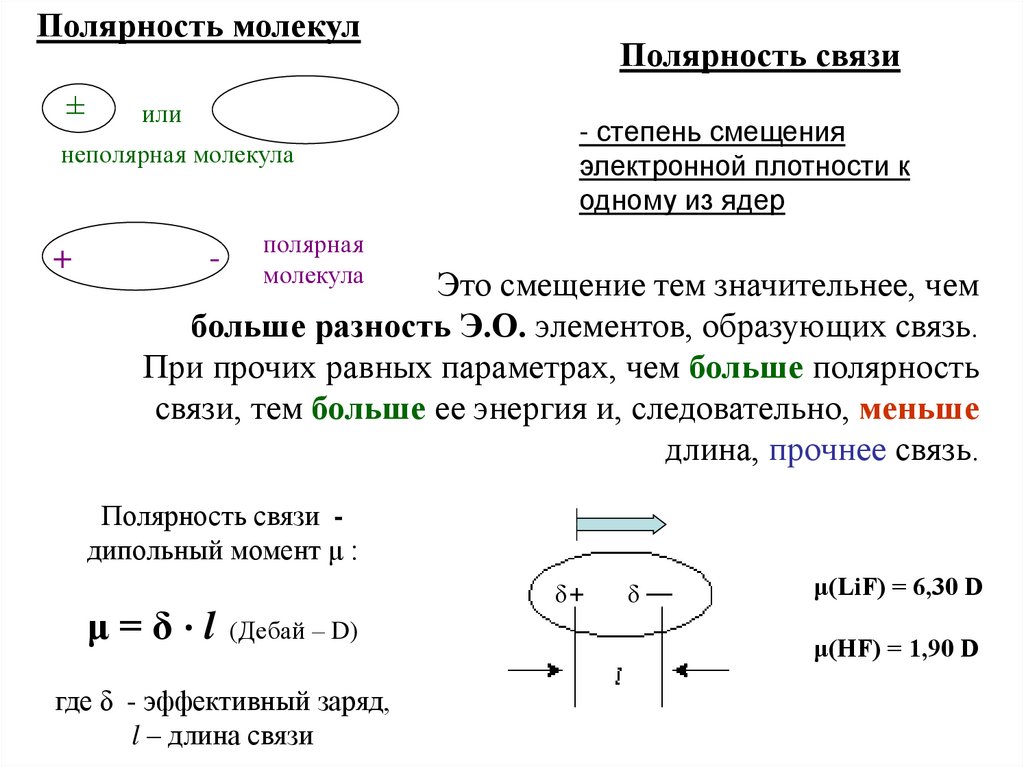
Полярность молекул±
Полярность связи
или
- степень смещения
электронной плотности к
одному из ядер
неполярная молекула
+
-
полярная
молекула
Это смещение тем значительнее, чем
больше разность Э.О. элементов, образующих связь.
При прочих равных параметрах, чем больше полярность
связи, тем больше ее энергия и, следовательно, меньше
длина, прочнее связь.
Полярность связи дипольный момент μ :
μ=δ⋅l
δ
(Дебай – D)
где δ - эффективный заряд,
l – длина связи
δ
μ(LiF) = 6,30 D
μ(HF) = 1,90 D
30.
При образовании полярной ковалентной связи возникаетсмещение электронной плотности
эффективные заряды атомов в молекуле
характеризуют степень ионности связи ( i )
i = f(Δχ)2
В кристаллах солей
RbCl
KCl
NaCl
NaF
i, %
99
98
90
97
Δχ – разность Э.О.
связанных атомов
31.
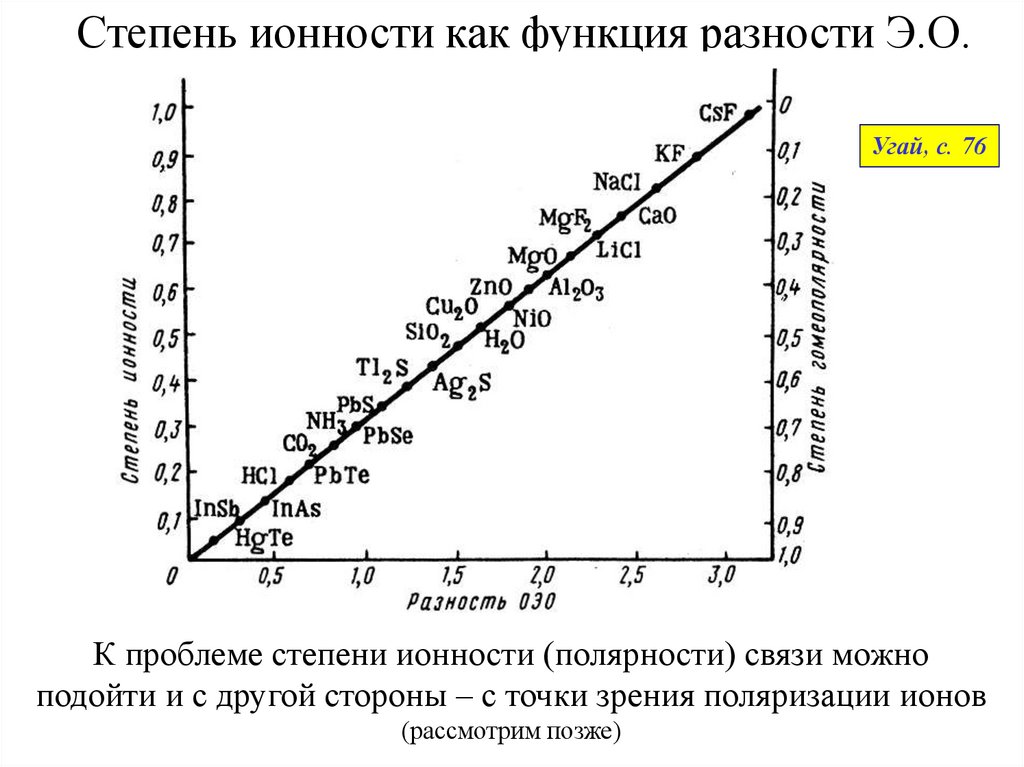
Степень ионности как функция разности Э.О.Угай, с. 76
К проблеме степени ионности (полярности) связи можно
подойти и с другой стороны – с точки зрения поляризации ионов
(рассмотрим позже)
32.
Поляризуемость связи- способность становиться более полярной
под действием внешнего электростатического поля
Например:
μ(HCl) = 0,96 D
μ(HF) = 1,90 D
Диполи воды поляризуют Х.С. в HCl до полного распада на
ионы.
HF диссоциирует в воде лишь частично (гораздо большая
жесткость, т.е. слабая поляризуемость связи из-за малого
радиуса фтора).
33.
КОВАЛЕНТНАЯ СВЯЗЬдля отдельных молекул – оба метода (ВС и МО)
для молекул и кристаллов с делокализованными связями – лучше МО
Валентность
Менделеев – переменная В.
Ранее: В. – число атомов водорода, с которыми может
соединиться атом данного элемента
В. элемента – мера способности его атомов соединяться с
другими атомами в определенных соотношениях
определение В. как числа ковалентных связей не объясняет существование и
свойства некоторых молекул (О3, СО)
в настоящее время: В.
– это сумма ковалентности и электровалентности
порядок связи
характеристика участия атома в
ковалентных химических связях
вклад, определяемый величиной
эффективного заряда атома
34.
способы образования связи:1 – неспаренный е2 - НЭП
0 – вакантная АО
1+1
1+0
2+0
2+1
- ординарная (одинарная) Н2
Н2+ (порядок связи 0.5)
- донорно-акцепторная (NH4+)
- д.-а. (порядок связи 0.5) He2+
наиболее прочная связь – (1+1),
остальные – слабее (до 3 раз)
Ковалентности атомов некоторых элементов
Li
ковалентность
1
Li Li
1(1+1)
Cl
2
1(1+1) + 1(2+0)
2p
2s1
Li
4
1(1+1) + 3(2+0)
Li
Li
Cl
Li(NH3)3Br
35.
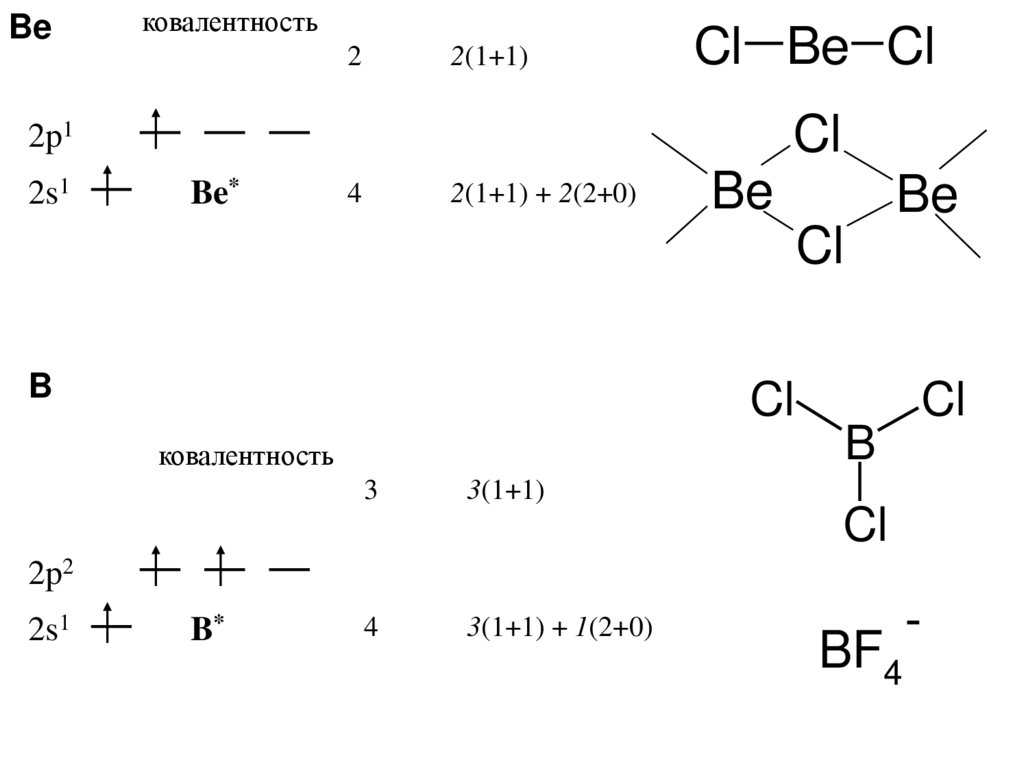
Beковалентность
2
2(1+1)
Cl Be Cl
Cl
2p1
2s1
Be*
4
2(1+1) + 2(2+0)
Be
Be
Cl
B
Cl
Cl
B
ковалентность
3
3(1+1)
Cl
2p2
2s1
B*
4
3(1+1) + 1(2+0)
BF4
-
36.
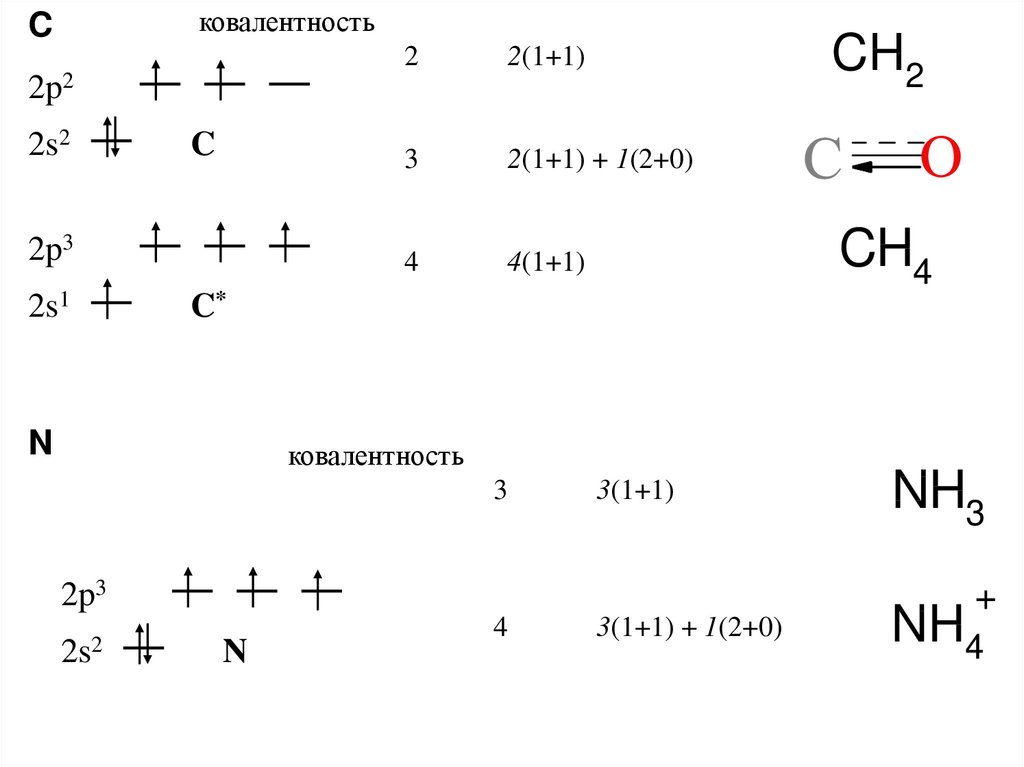
ковалентностьC
CH2
2
2(1+1)
3
2(1+1) + 1(2+0)
4
4(1+1)
2p2
2s2
C
2p3
2s1
CH4
C*
N
ковалентность
3
3(1+1)
2p3
2s2
N
4
3(1+1) + 1(2+0)
NH3
+
NH4
37.
ковалентностьO
2
2(1+1)
3
2(1+1) + 1(2+0)
2p4
2s2
O
H2O
2p2
2s2
C
Глинка, с.123
38.
Sковалентность:
6
4
2
39.
Валентные возможности атомовКоординационное число (К.ч.)
– число σ-связей, образуемых центральным атомом
Связывающие π-электроны в основном не оказывают
влияния на стереохимическое строение
Атомы элементов II периода имеют 4 орбитали (1s+3p) –
максимальная ковалентность равна 4
К.ч. = 4 (стерические препятствия, ограниченность набора
орбиталей)
Атомы элементов III и послед. периодов имеют 9 орбиталей
(1s+3p+5d) – ковалентность не превышает 9
К.ч. = до 6 (стерические препятствия, симметрия)
Бόльшие К.ч. – встречаются у атомов переходных рядов V и
последующих периодов
40.
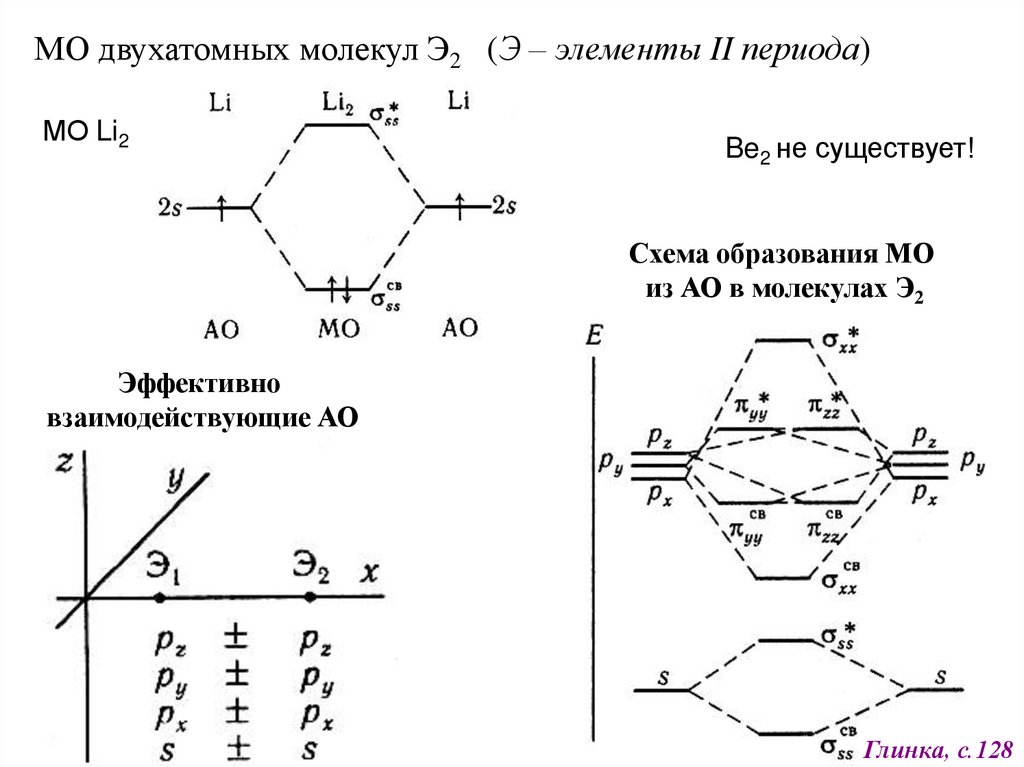
МО двухатомных молекул Э2 (Э – элементы II периода)МО Li2
Be2 не существует!
Схема образования МО
из АО в молекулах Э2
Эффективно
взаимодействующие АО
Глинка, с.128
41.
Энергетические диаграммы МОгомоядерных двухатомных молекул
б - молекула N2
а - молекула F2
Третьяков, с.161
в - фотоэлектронный
спектр молекулы N2
42.
МОдвухатомных
молекул Э2 (Э
– элементы II
периода)
у легких атомов (до
N включительно)
Еs-АО и Еp-АО близки
(сильное взаимодействие собственных s- и pz-АО при
образовании σМО):
1σ<2σ<1π<3σ<2π<4σ
у тяжелых атомов sи pz-АО слабо
взаимодействуют:
1σ<2σ<3σ<1π<2π<4σ
Третьяков, с.162
парамагнетик
43.
N22s
св яз
s
*
s
44.
N2св яз
x
2 px
*
x
45.
*s
св яз
s
*
x
св яз
x
46.
π-Дативная связьспособность взаимодействующих атомов одновременно
выступать донорами и акцепторами электронной плотности
Энергия связи молекул Э2:
EF2 ECl 2 EBr2 EI 2
Благодаря наличию d-орбиталей, атомы хлора способны к повышению порядка
связи в молекуле – кроме (1+1), появляются дополнительные (2+0) взаимодействия
Глинка, с.479
47.
Энергетические диаграммы МОгетероядерных двухатомных молекул
LiH
HF
-
-
Третьяков, с.163
-
2σсвяз МО ближе к 2p АОF –
эл. плотность ближе к F (δ-)
1σсвяз МО ближе к 1s АОН –
эл. плотность ближе к Н (δ-)
48.
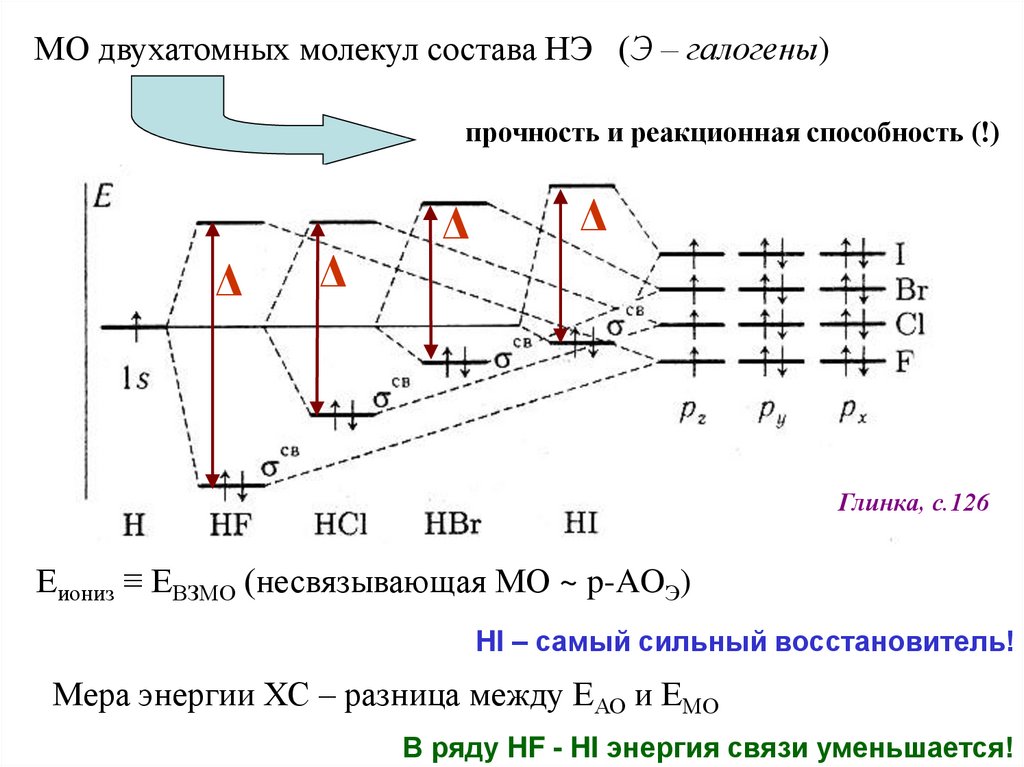
МО двухатомных молекул состава НЭ (Э – галогены)прочность и реакционная способность (!)
Δ
Δ
Δ
Δ
Глинка, с.126
Еиониз ≡ ЕВЗМО (несвязывающая МО ~ p-AOЭ)
HI – самый сильный восстановитель!
Мера энергии ХС – разница между ЕАО и ЕМО
В ряду HF - HI энергия связи уменьшается!
49.
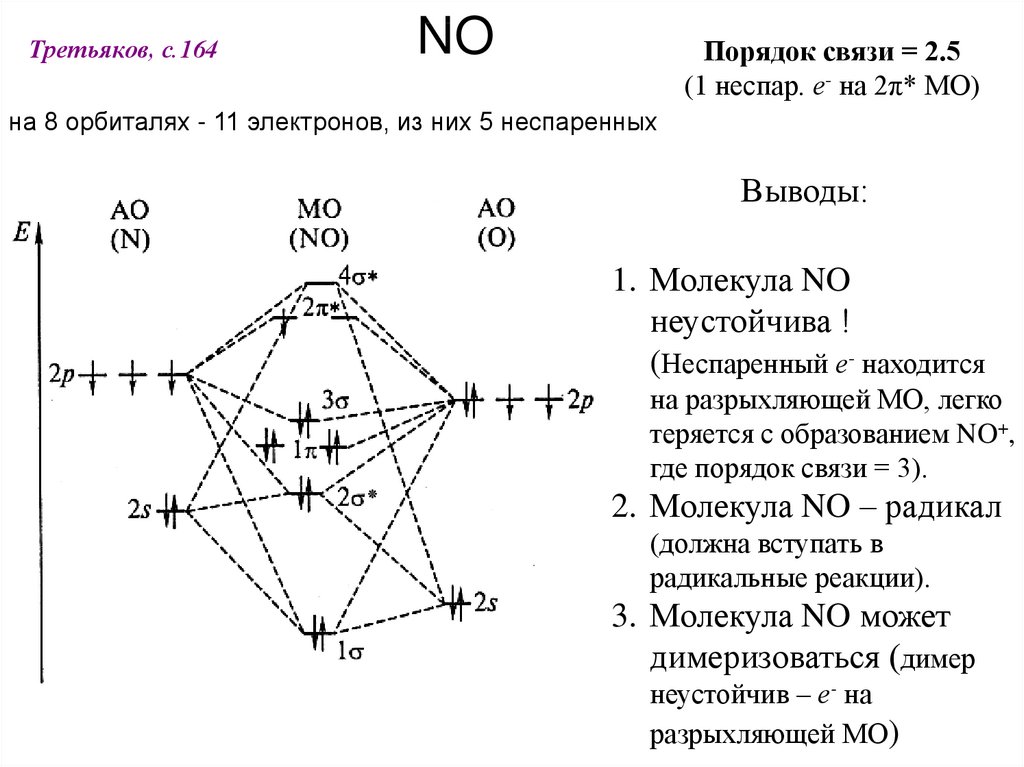
NOТретьяков, с.164
Порядок связи = 2.5
(1 неспар. е- на 2π* МО)
на 8 орбиталях - 11 электронов, из них 5 неспаренных
Выводы:
1. Молекула NO
неустойчива !
(Неспаренный е- находится
на разрыхляющей МО, легко
теряется с образованием NO+,
где порядок связи = 3).
٭
2. Молекула NO – радикал
(должна вступать в
радикальные реакции).
3. Молекула NO может
димеризоваться (димер
неустойчив – е- на
разрыхляющей МО)
50.
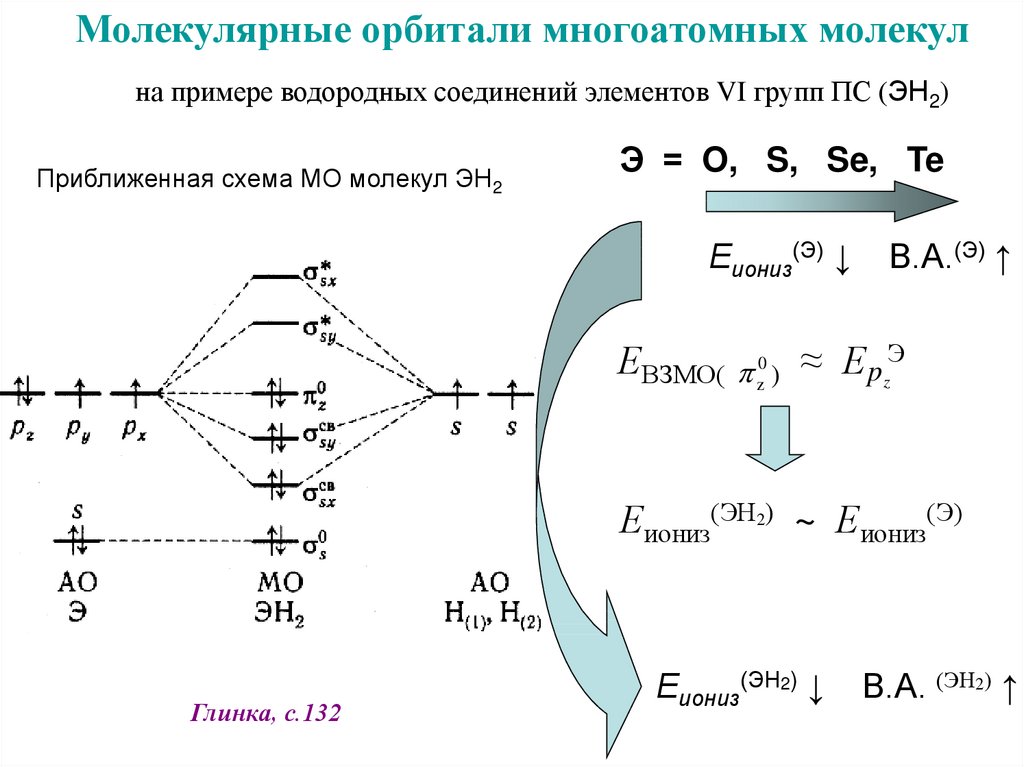
Молекулярные орбитали многоатомных молекулна примере водородных соединений элементов VI групп ПС (ЭН2)
Приближенная схема МО молекул ЭН2
Э = O, S, Se, Te
Еиониз(Э) ↓
В.А.(Э) ↑
ЕВЗМО( z0 ) ≈ Е pzЭ
Еиониз(ЭН2) ~ Еиониз(Э)
Глинка, с.132
Еиониз(ЭН2) ↓
В.А. (ЭН2) ↑
51.
Молекулярные орбиталимногоатомных молекул
Используется метод групповых орбиталей лигандов
- взаимодействие ц.а. с АО остальных атомов,
а не АО всех атомов друг с другом
52.
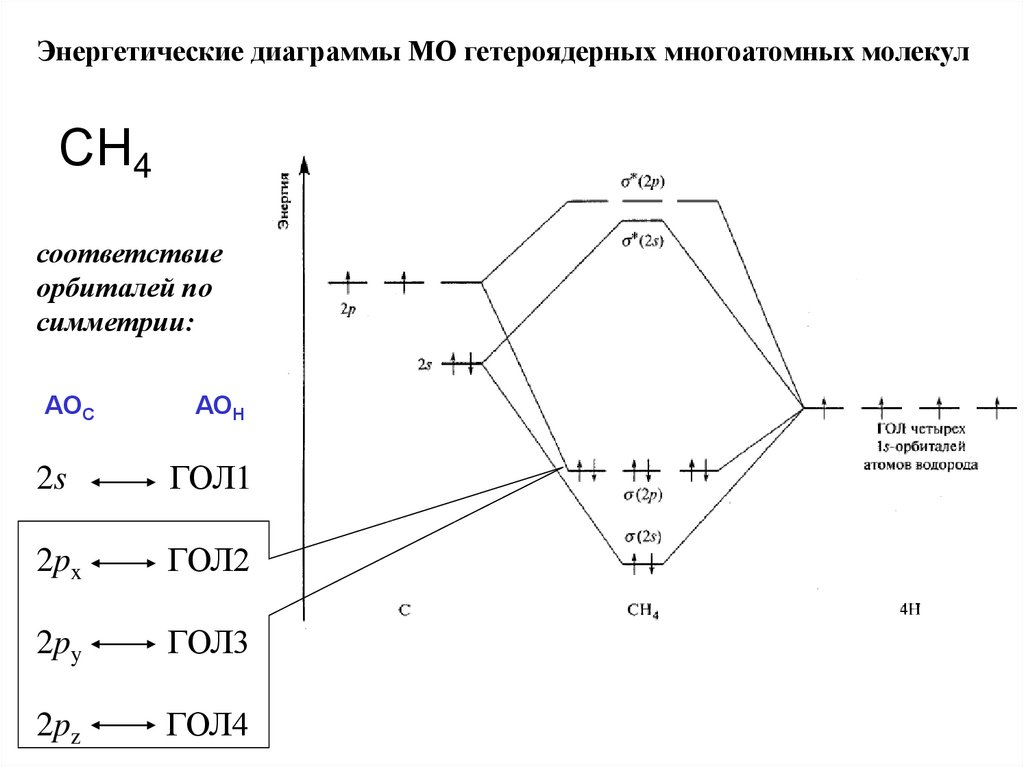
Энергетические диаграммы МО гетероядерных многоатомных молекулСН4
соответствие
орбиталей по
симметрии:
АОС
АОН
2s
ГОЛ1
2px
ГОЛ2
2py
ГОЛ3
2pz
ГОЛ4
53.
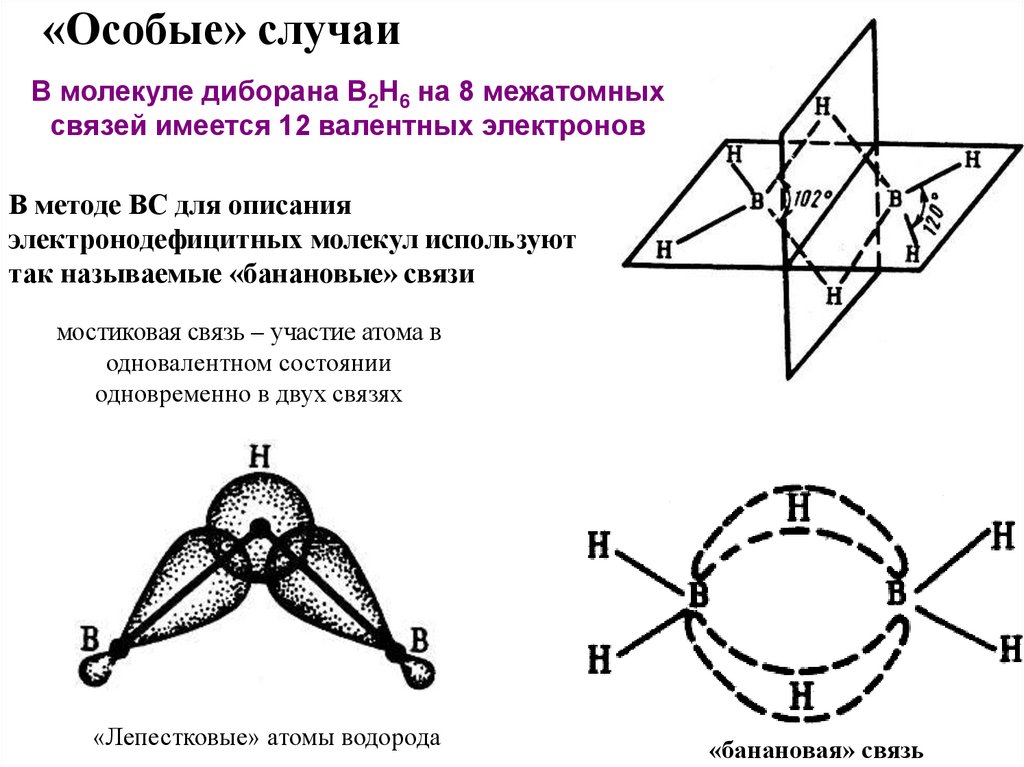
«Особые» случаиВ молекуле диборана В2Н6 на 8 межатомных
связей имеется 12 валентных электронов
В методе ВС для описания
электронодефицитных молекул используют
так называемые «банановые» связи
мостиковая связь – участие атома в
одновалентном состоянии
одновременно в двух связях
«Лепестковые» атомы водорода
«банановая» связь
54.
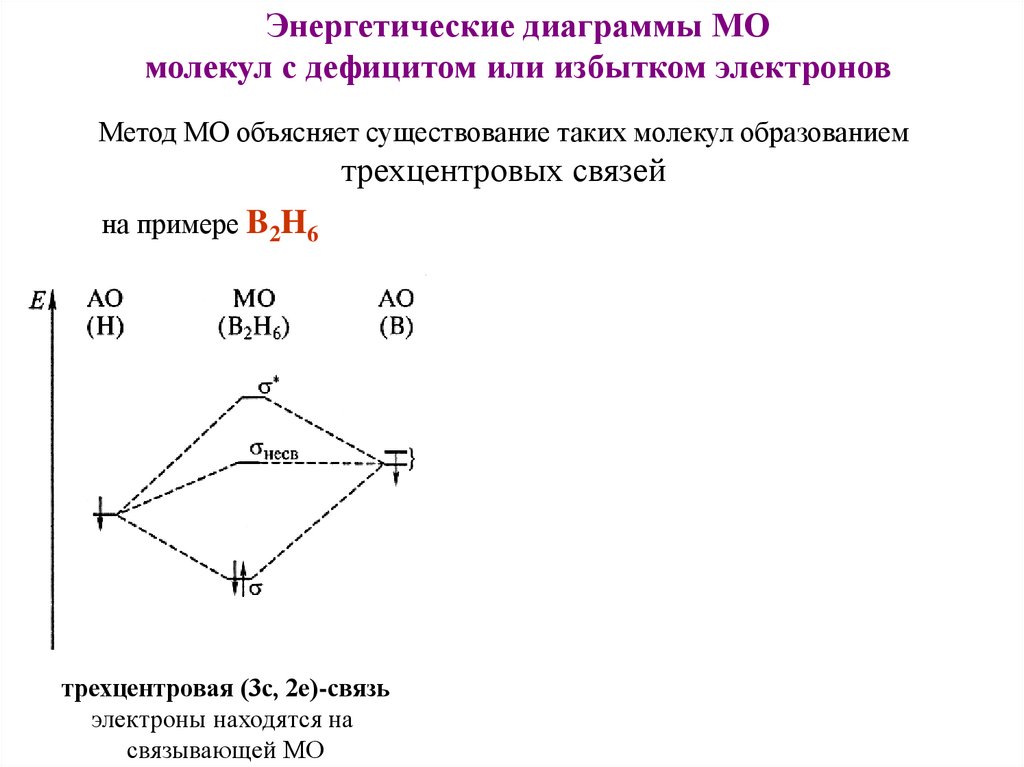
Энергетические диаграммы МОмолекул с дефицитом или избытком электронов
Метод МО объясняет существование таких молекул образованием
трехцентровых связей
на примере B2H6
трехцентровая (3с, 2е)-связь
электроны находятся на
связывающей МО
и
XeF2
трехцентровая (3с, 4е)-связь
электроны находятся на
связывающей и несвязывающей МО
55.
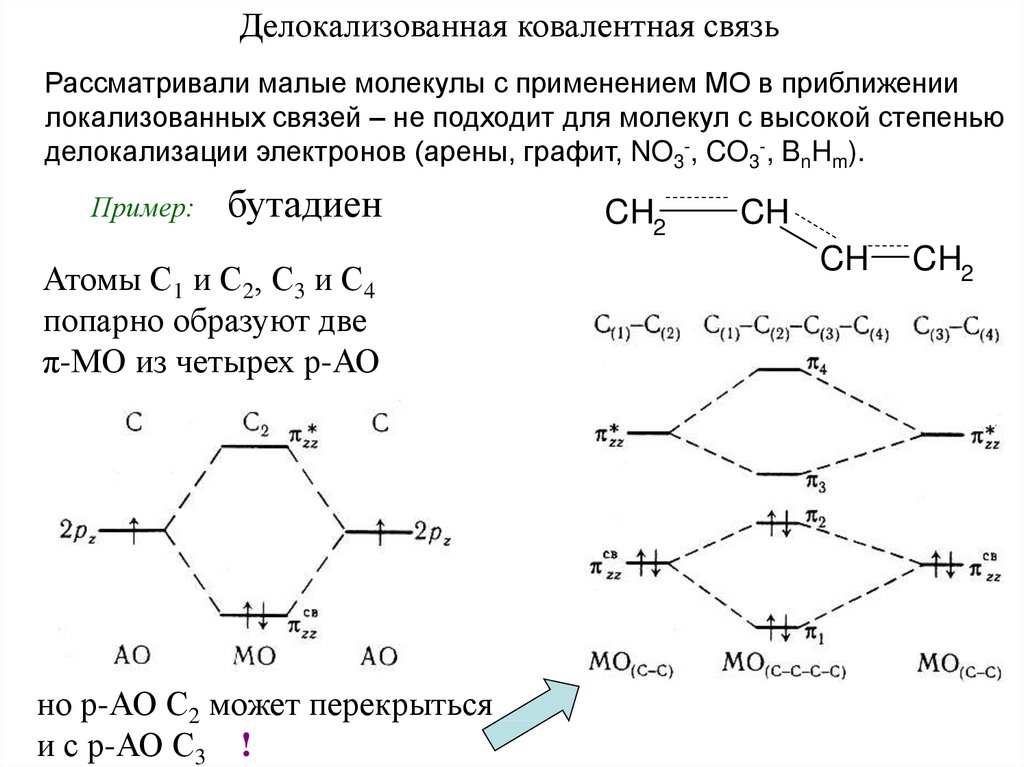
Делокализованная ковалентная связьРассматривали малые молекулы с применением МО в приближении
локализованных связей – не подходит для молекул с высокой степенью
делокализации электронов (арены, графит, NO3-, CO3-, BnHm).
Пример:
бутадиен
Атомы С1 и С2, С3 и С4
попарно образуют две
π-МО из четырех р-АО
но р-АО С2 может перекрыться
и с р-АО С3 !
CH2
CH
CH
CH2
56.
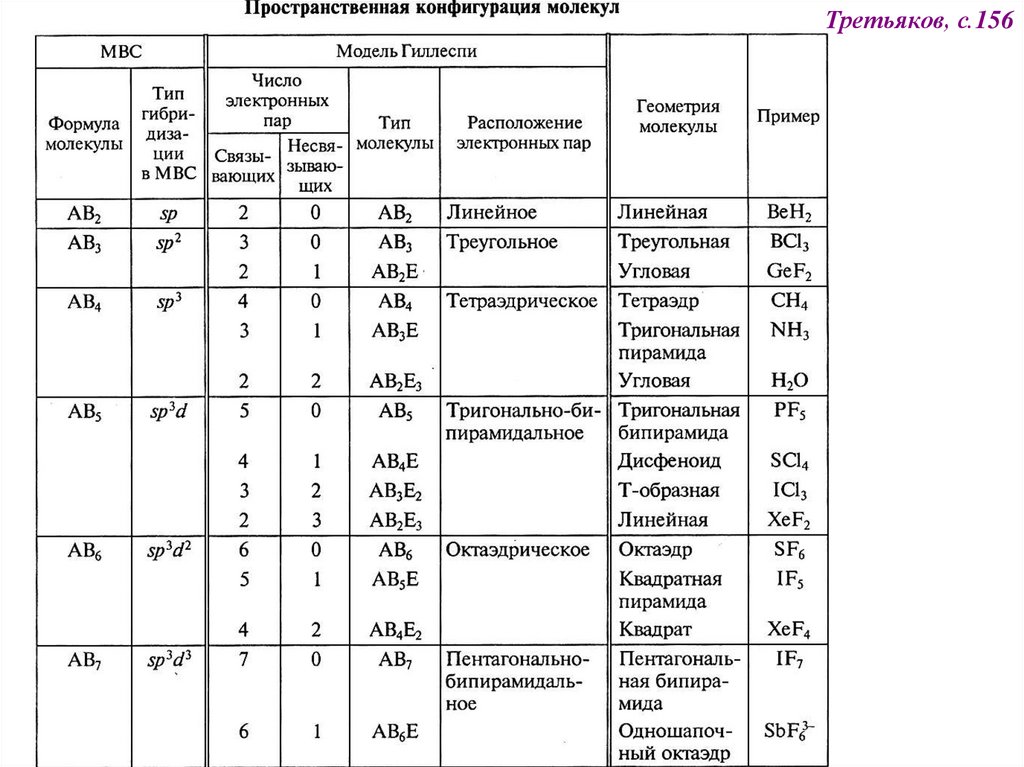
Молекулярная структура многоатомных молекулКак делать это без расчетов МО?
Модель отталкивания электронных пар (Гиллеспи):
• во многих соединениях связь между атомами может считаться (2с, 2е)
• внешняя оболочка каждого атома состоит из нескольких ЭП: НЭП (только
этого атома) и ПЭП (обобществленная)
• расположение пар можно изобразить в виде вершин многогранника (при
соединении всех ЭП прямыми линиями)
• ЭП стараются максимально удалиться друг от друга
• отталкивание ослабевает в ряду НЭП-НЭП,
НЭП-ПЭП,
ПЭП-ПЭП
• ПЭП связи с концевым атомом имеет наименьший объем
для наиболее электроотрицательного атома
57.
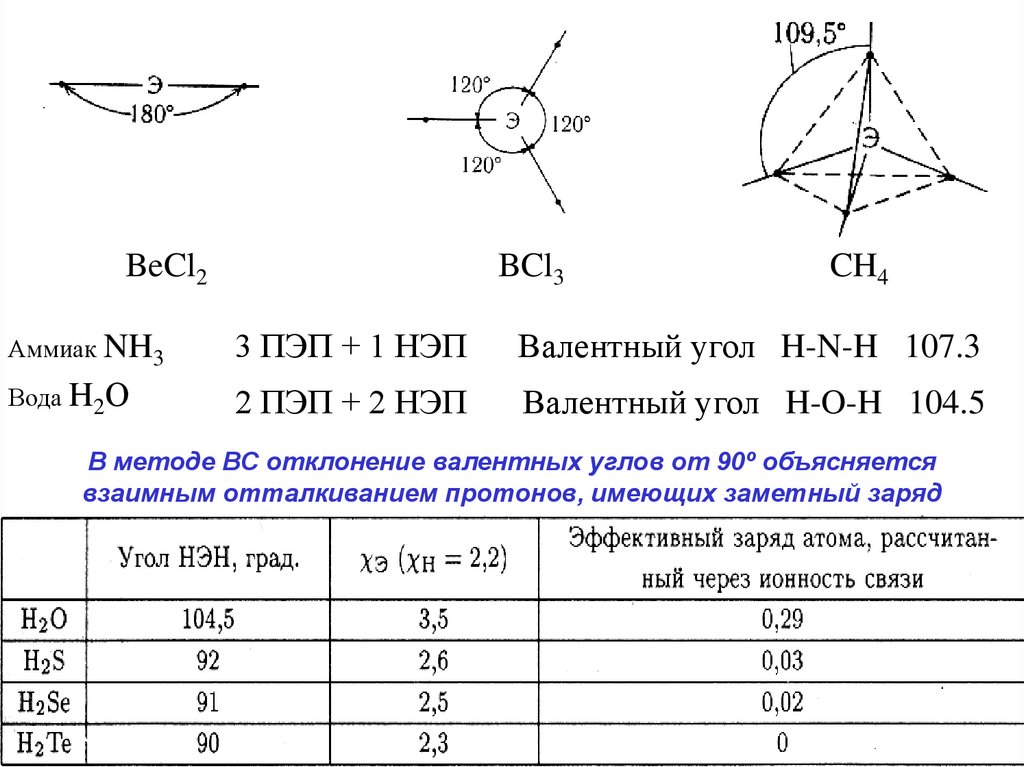
BeCl2BCl3
CH4
Аммиак NH3
3 ПЭП + 1 НЭП
Валентный угол H-N-H 107.3
Вода H2О
2 ПЭП + 2 НЭП
Валентный угол H-O-H 104.5
В методе ВС отклонение валентных углов от 90º объясняется
взаимным отталкиванием протонов, имеющих заметный заряд
58.
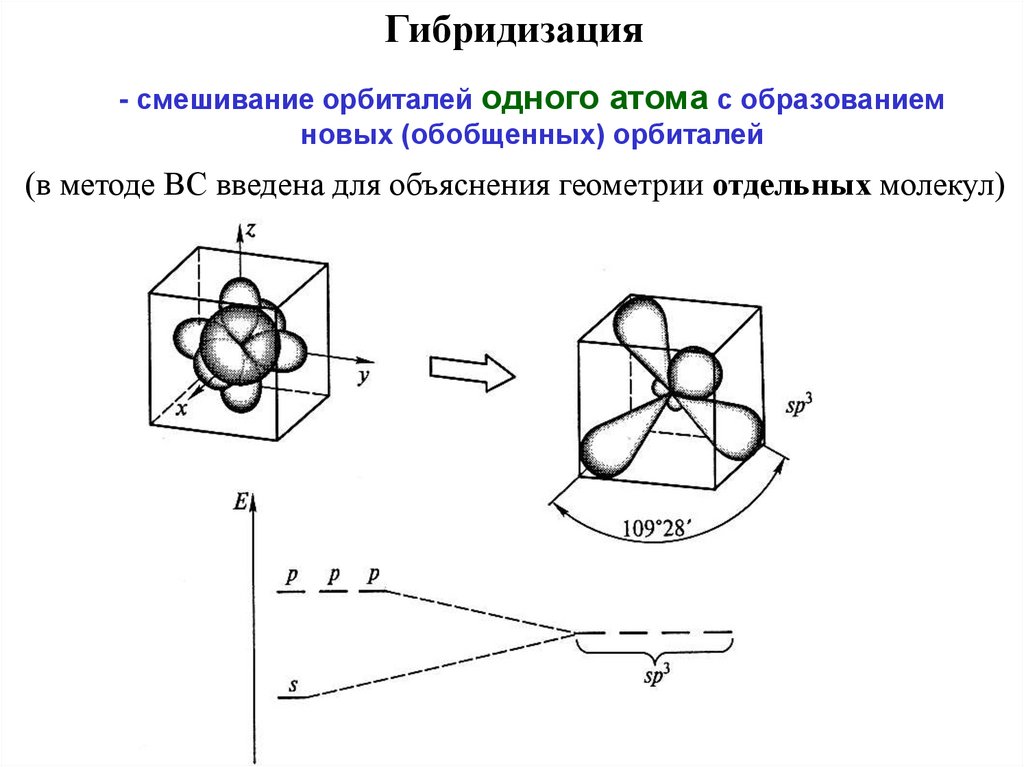
Гибридизация- смешивание орбиталей одного атома с образованием
новых (обобщенных) орбиталей
(в методе ВС введена для объяснения геометрии отдельных молекул)
59.
Третьяков, с.15660.
61.
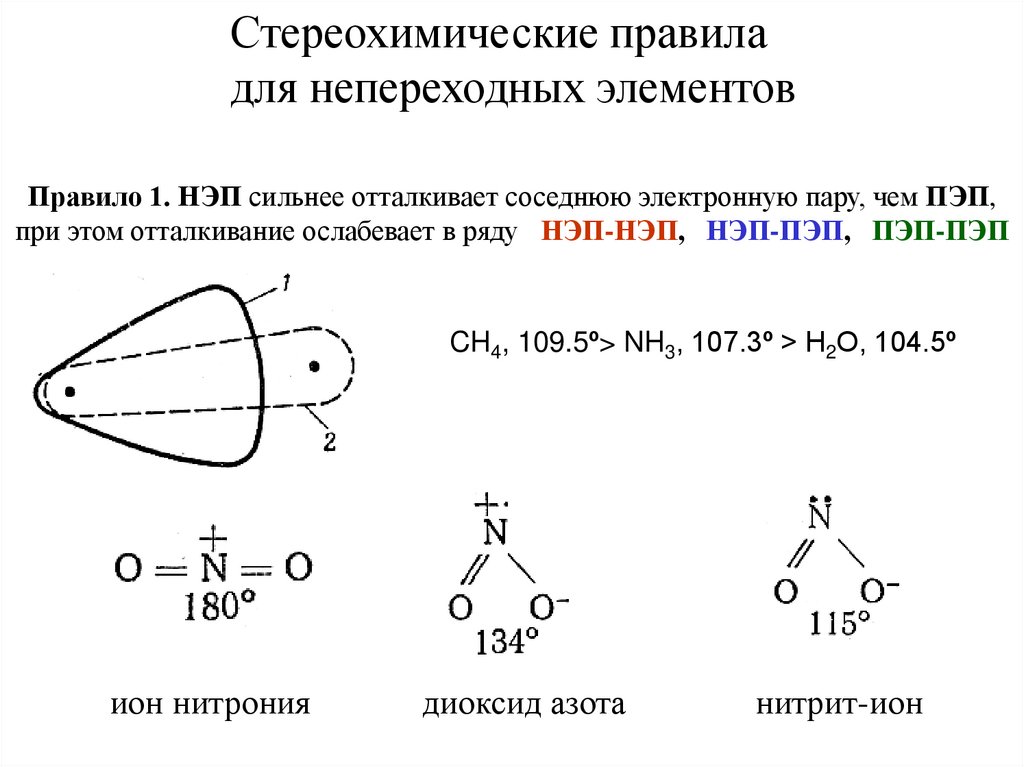
Стереохимические правиладля непереходных элементов
Правило 1. НЭП сильнее отталкивает соседнюю электронную пару, чем ПЭП,
при этом отталкивание ослабевает в ряду НЭП-НЭП, НЭП-ПЭП, ПЭП-ПЭП
CH4, 109.5º> NH3, 107.3º > H2O, 104.5º
ион нитрония
диоксид азота
нитрит-ион
62.
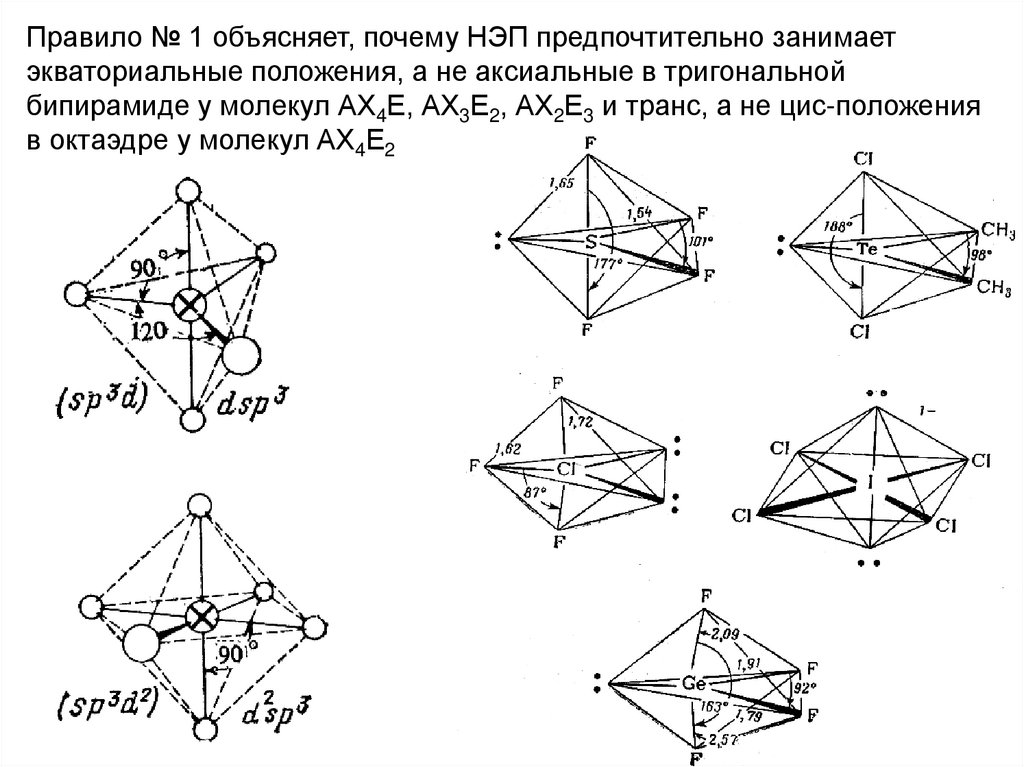
Правило № 1 объясняет, почему НЭП предпочтительно занимаетэкваториальные положения, а не аксиальные в тригональной
бипирамиде у молекул АХ4Е, АХ3Е2, АХ2Е3 и транс, а не цис-положения
в октаэдре у молекул АХ4Е2
63.
Правило 2. Отталкивание, вызываемое ПЭП, уменьшается при увеличенииэлектроотрицательности связанного атома
Чем более электроотрицателен связанный атом, тем сильнее
смещается в его сторону электронная плотность σ-связи
Примеры:
OH2, 104.5º > OF2, 103º
NH3, 107.3º > NF3, 102º
PI3, 102º > PBr3, 101.5º > PCl3, 100º
AsI3, 101º > AsBr3, 100.5º > AsCl3, 98.4º
64.
Правило 3. Кратные связи фактически не влияют на стереохимию молекулы.Ее геометрическую форму в первую очередь определяют
число σ-связывающих электронов и число НЭП
π-связь имеет то же направление, что и сочетающаяся с ней σ-связь,
тогда как ПЭП σ-связи и НЭП занимают различные стереохимические
места у центрального атома
(!)
Однако, наличие кратной связи может
изменять валентные углы в молекуле
65.
Правило 4. Отталкивание между ЭП заполненного уровня больше, чем междуэлектронами незаполненного уровня
Во II периоде возможны 4 ЭП, поэтому угол между связями близок к 109.5º.
В следующих периодах валентные уровни не заполнены максимальным
числом ЭП (напр., 9 в IV периоде), что вызывает сдавливание ПЭП со
стороны НЭП
Примеры:
OH2, 104.5º ≥ SH2, 92.2º > SeH2, 91.0º > TeH2, 89.5º
NH3, 107.3º ≥ PH3, 93.3º > AsH3, 91.8º > SbH3, 91.3º
Примечание:
В методе ВС обсуждаемое изменение углов НХН объясняется тем, что гибридные
орбитали связи имеют преимущественно «р-характер», а орбиталь НЭП – главным
образом «s-характер». Однако: энергии орбиталей 3s и 3p более близки, чем энергии
2s и 2p, и закономерность должна была бы иметь обратный порядок !
66.
Можно предсказывать геометрию не только молекул, но и ионовПример:
ион
ICl2-
Центральный атом иода имеет 10 электронов:
7 - «своих»
2 – от каждого из атомов хлора
1 – заряд иона
Тип молекулы: АВ2Е3
А – центральный атом
В – ПЭП
Е – НЭП
НЭП занимают больший объем,
отталкиваются сильнее ( 120º)
ион – линейный
угол Cl-I-Cl 180º
67.
Карбонат-ион CO32- - имеет треугольное строение (sp2 –гибр.)2-
-O
3 σ-связи, 1 π-связь
-O
C
O
Из эксперимента – все связи равноценны !
-O
-O
2-
2C
O
O
-O
C
O
-
2-
-O
C
O
-
O
для отображение этого предполагают делокализацию π-связи (и «-») на все атомы О
2-
O
C
O
O
Аналогичная делокализация π-связи
предполагается для иона NO3-
68.
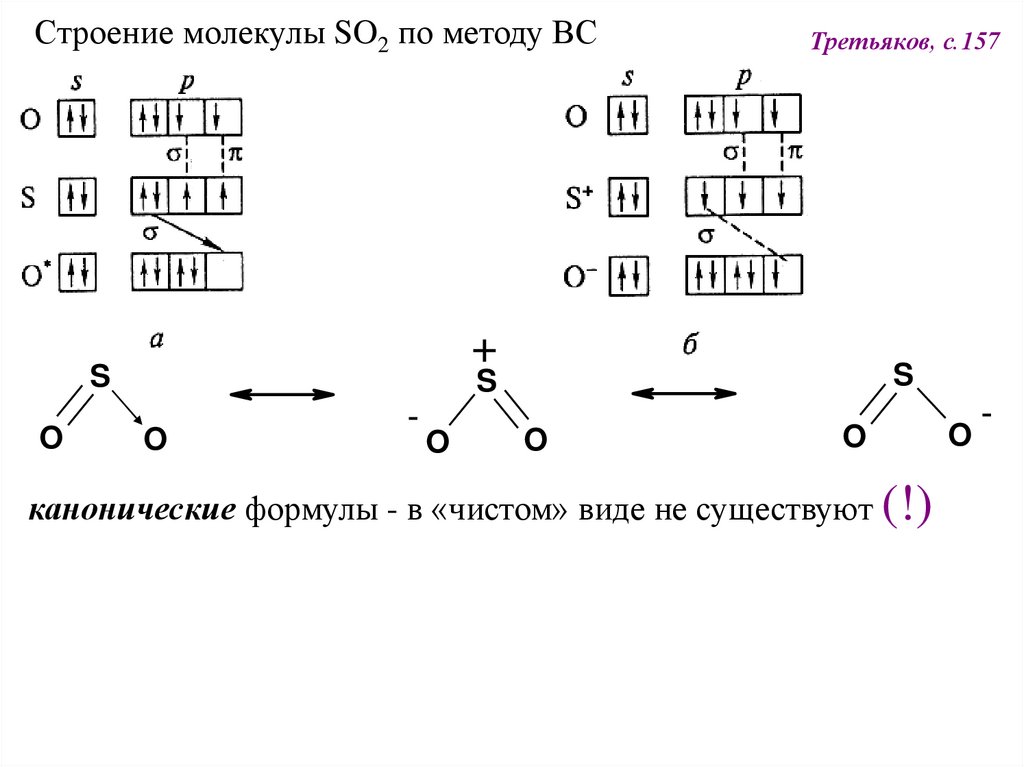
Строение молекулы SO2 по методу ВС+
S
O
Третьяков, с.157
S
S
O
-
O
O
O
канонические формулы - в «чистом» виде не существуют (!)
π-орбиталь делокализована между всеми тремя атомами
..S
sp2-гибридизация
угол O-S-O 119.5º
O
O
O
-
69.
Сравнение методов ВС и МООба – квантово-механические методы
Общие черты в подходе к описанию химических связей:
1. оба метода являются приближенными
2. для данной молекулы они приводят к сходному
результирующему распределению электронов
3. в обоих методах наиболее существенны обобществление
электронной плотности связывающих электронов между
ядрами и концентрирование плотности электронного облака
между ними
4. σ- и π-связи отличаются друг от друга как по характеру
перекрывания электронных облаков, так и по свойствам
симметрии
Эта общность – для двухцентровых связей (МВС – только такие).
Оба метода имеют «+» и «-». ММО – более общий и универсальный.
Они дополняют друг друга, и оба развивают теорию х.с. Бутлерова.
70.
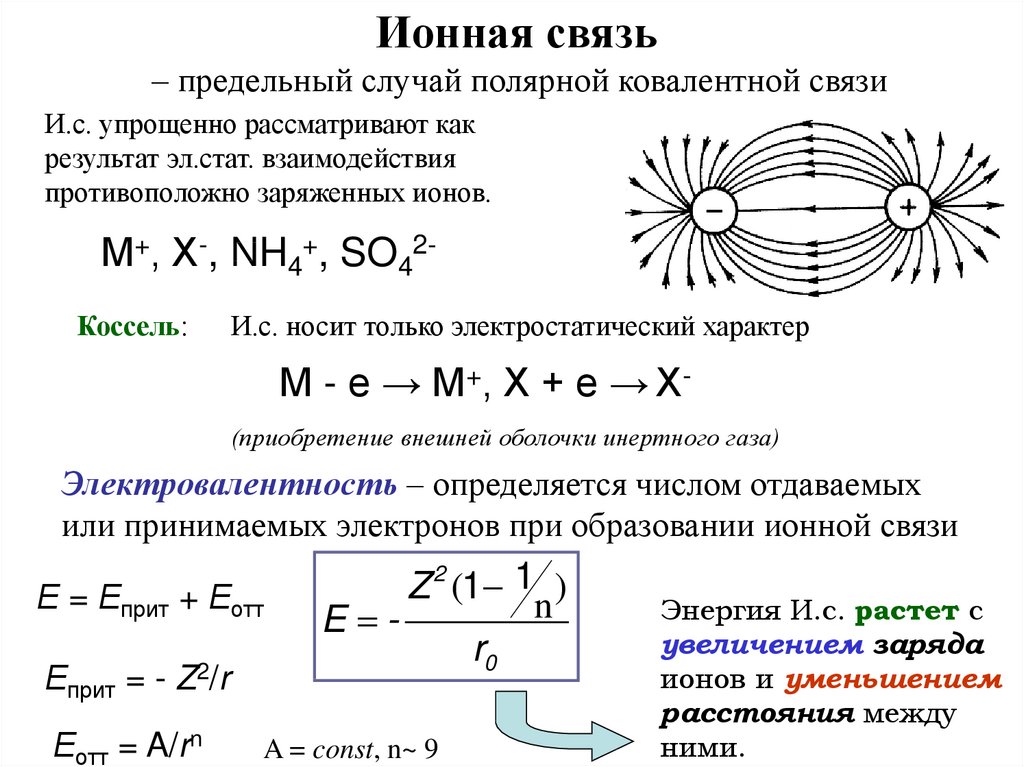
Ионная связь– предельный случай полярной ковалентной связи
И.с. упрощенно рассматривают как
результат эл.стат. взаимодействия
противоположно заряженных ионов.
М+, Х-, NH4+, SO42Коссель:
И.с. носит только электростатический характер
М - е → М+, Х + е → Х(приобретение внешней оболочки инертного газа)
Электровалентность – определяется числом отдаваемых
или принимаемых электронов при образовании ионной связи
Е = Еприт + Еотт
Еприт = - Z2/r
Еотт = A/rn
Z 2 (1 1 )
n
E r0
A = const, n~ 9
Энергия И.с. растет с
увеличением заряда
ионов и уменьшением
расстояния между
ними.
71.
Ионная связь:не обладает направленностью
не обладает насыщаемостью
высокие
К.ч. атомов!
Соединения с ионной связью склонны к ассоциации
частично ковалентный характер И.с.
Даже в галогенидах
щелочных металлов не
происходит полного
разделения зарядов
(!)
RbCl
KCl
NaCl
NaF
i, %
99
98
90
97
В твердых соединениях типа BaO, ZnS, AlN
ионы типа О2-, S2-, N3- не существуют
72.
Неполное разделение зарядов в ионных соединенияхможно объяснить взаимной поляризацией ионов – таким
взаимодействием, которое приводит к деформации
электронных оболочек ионов
Причина поляризации – наличие электрического поля
Ионы поляризуются путем взаимодействия с
электрическими полями друг друга
Деформируется внешняя валентная оболочка !
Чем слабее связаны внешние
электроны с ядром, тем легче
поляризуется ион, тем сильнее
он деформируется в
электрическом поле
73.
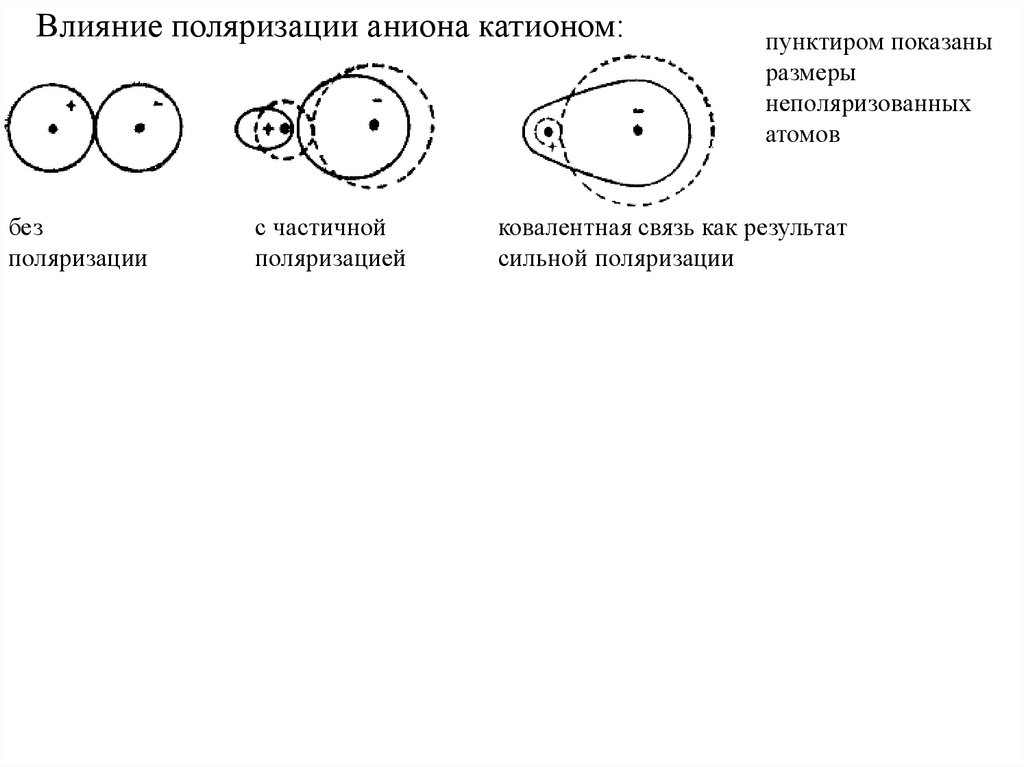
Влияние поляризации аниона катионом:без
поляризации
с частичной
поляризацией
пунктиром показаны
размеры
неполяризованных
атомов
ковалентная связь как результат
сильной поляризации
Правила Фаянса
1. Поляризующая способность катиона тем выше, чем больше его заряд и
меньше размеры; количественно она характеризуется
ионным потенциалом катиона Φ = Z+/r.
Li+
17
Be2+
B3+
150
Na+
10
Mg2+ 31
Al3+
60
K+
8
Ca2+
Ga3+
48
64
20
Чем выше Φ, тем больше склонность к образованию
ковалентных связей с сильно поляризуемыми анионами
74.
2. Поляризующая способность катиона тем выше, чем больше заряд иразмеры аниона.
Пример:
Анионы типа I-, Se2-, As3- и т.п. особенно легко поляризуются и
образуют связи с большой степенью ковалентности.
3. Поляризующая способность катиона будет выше, если он не имеет
конфигурацию ближайшего благородного газа (заполненная оболочка
эффективно экранирует заряд ядра и препятствует поляризации аниона).
Пример:
Катионы Hg2+ и Ca2+ имеют одинаковый заряд и близкий размер
(0.116 и 0.114 нм), но разную электронную конфигурацию
(……………………………… и ……………………………………..),
поэтому катион Hg2+ образует связи с высокой степенью
ковалентности, а Са2+ - ионные кристаллы.
75.
Как правило, у анионов большой размер, низкий заряд, иони имеют конфигурацию инертного газа, поэтому
поляризующее действие аниона на катион невелико
(пренебрегают), т.е. считают, что поляризация имеет
односторонний характер .
Однако! Если катион легко деформируется, возникший в
нем диполь усиливает его поляризующее действие на анион, а
тот усиливает свое действие на катион и т.д.
Это приводит к дополнительному поляризационному
эффекту (особенно велик для 18-электронных катионов Zn2+, Cd2+, Hg2+).
Влияние поляризации:
сокращая межатомные расстояния, превращает
ионную связь в полярную ковалентную
Тплавления (CaCl2 и HgCl2), (CaCl2 и ВеCl2), LiX, MBrx
растворимость солей (AgX по сравнению с NaX)
энергия гидратации
гидролиз (!)
(!)
Особо высокое
поляризующее
действие ионов Н+
76.
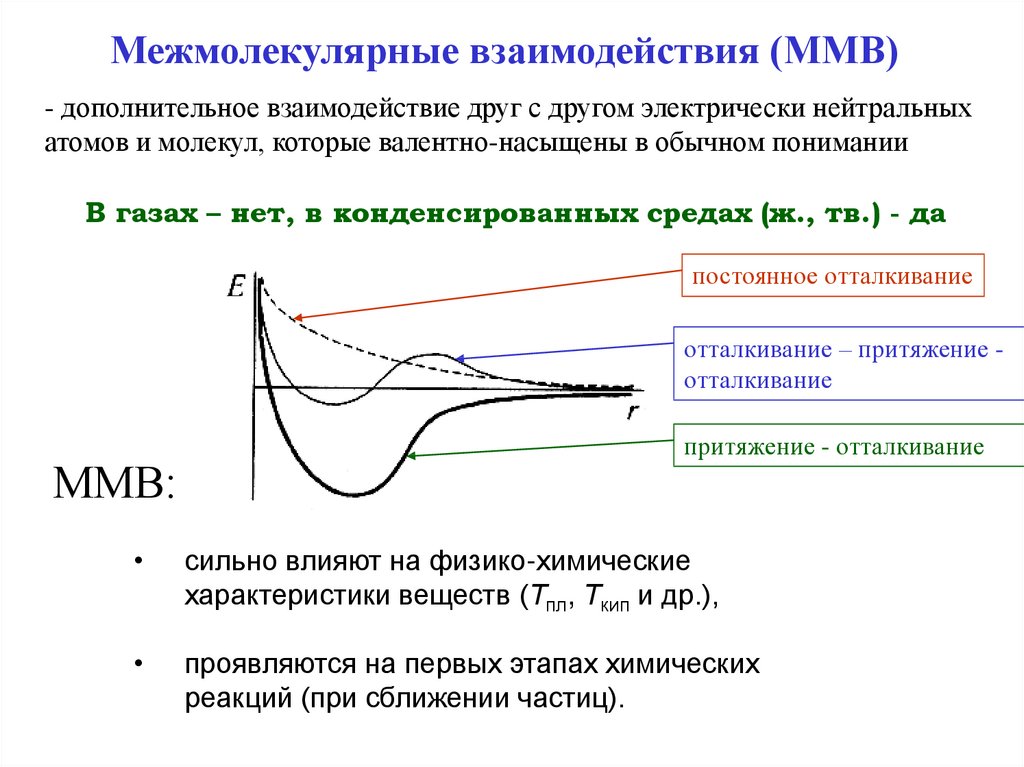
Межмолекулярные взаимодействия (ММВ)- дополнительное взаимодействие друг с другом электрически нейтральных
атомов и молекул, которые валентно-насыщены в обычном понимании
В газах – нет, в конденсированных средах (ж., тв.) - да
постоянное отталкивание
отталкивание – притяжение отталкивание
ММВ:
притяжение - отталкивание
сильно влияют на физико-химические
характеристики веществ (Тпл, Ткип и др.),
проявляются на первых этапах химических
реакций (при сближении частиц).
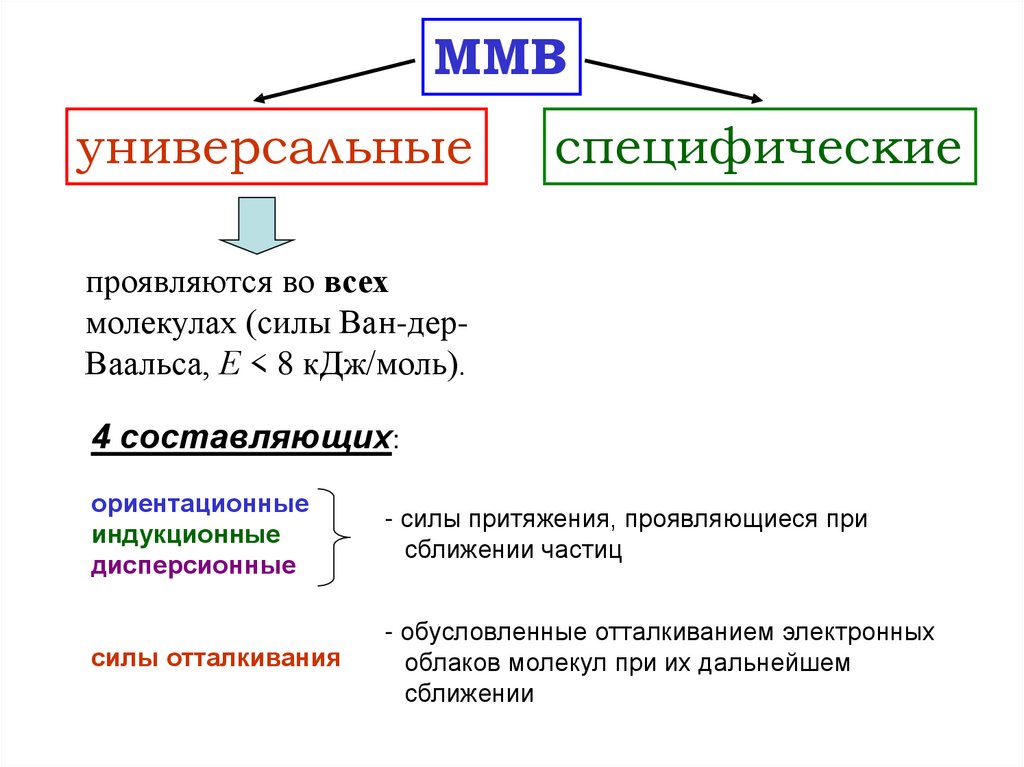
77.
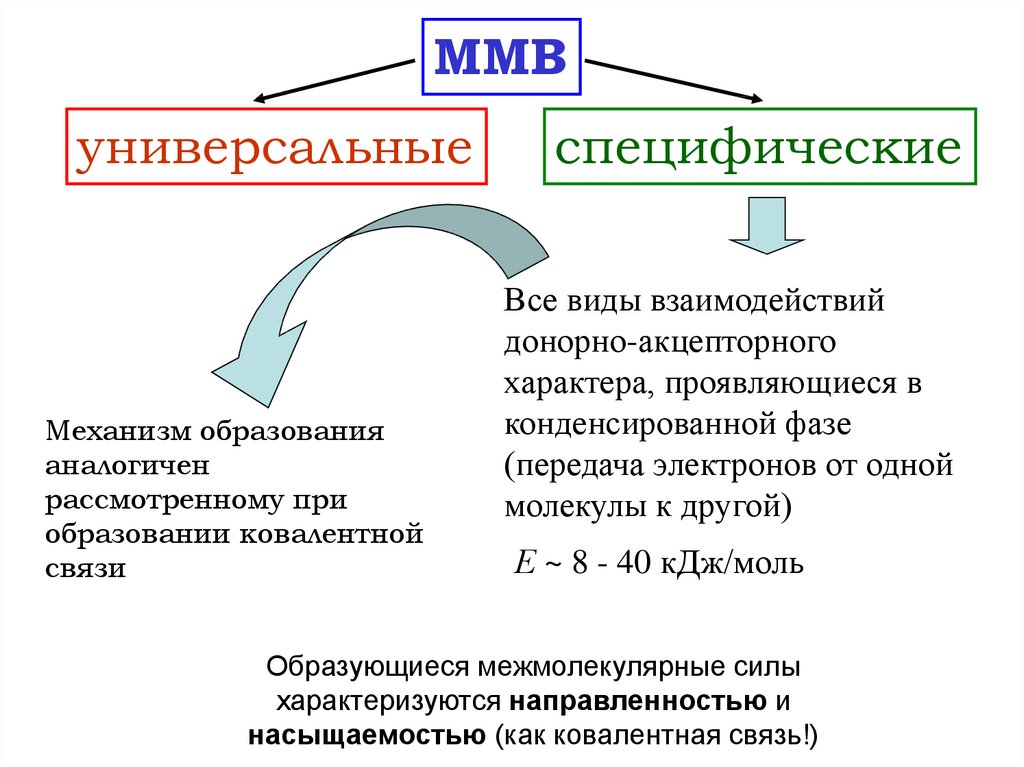
ММВуниверсальные
специфические
проявляются во всех
молекулах (силы Ван-дерВаальса, Е < 8 кДж/моль).
4 составляющих:
ориентационные
индукционные
дисперсионные
- силы притяжения, проявляющиеся при
сближении частиц
силы отталкивания
- обусловленные отталкиванием электронных
облаков молекул при их дальнейшем
сближении
78.
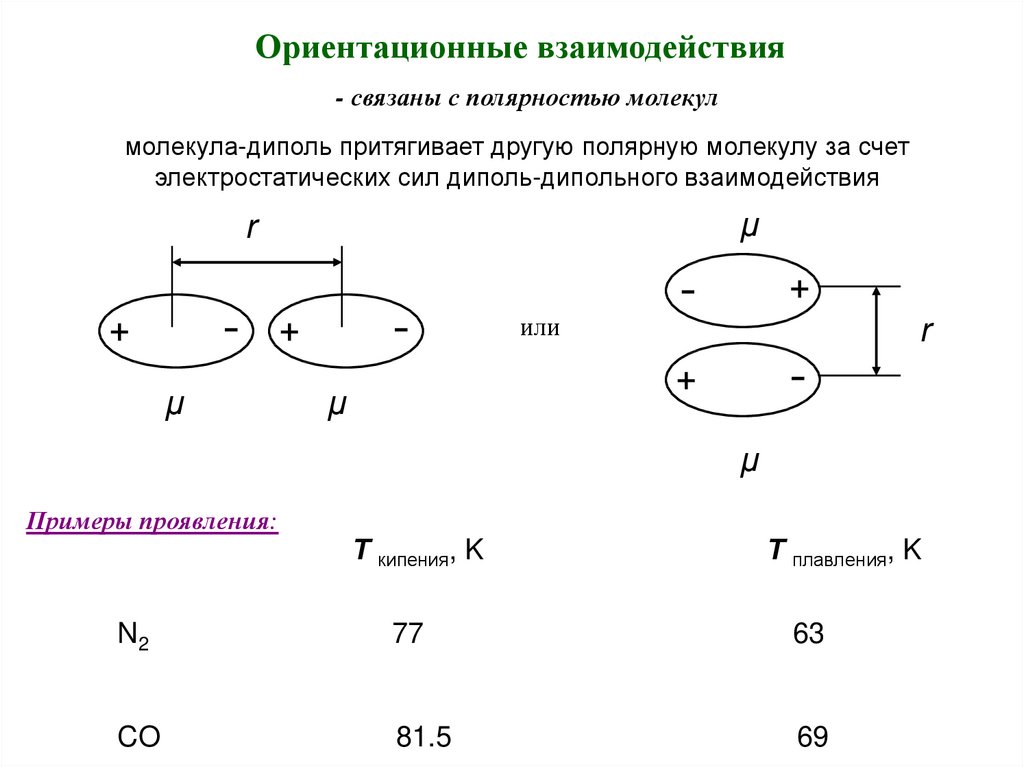
Ориентационные взаимодействия- связаны с полярностью молекул
молекула-диполь притягивает другую полярную молекулу за счет
электростатических сил диполь-дипольного взаимодействия
μ
r
или
-
μ
-
+
+
-
+
r
-
+
μ
μ
Примеры проявления:
Т кипения, K
Т плавления, K
N2
77
63
CO
81.5
69
79.
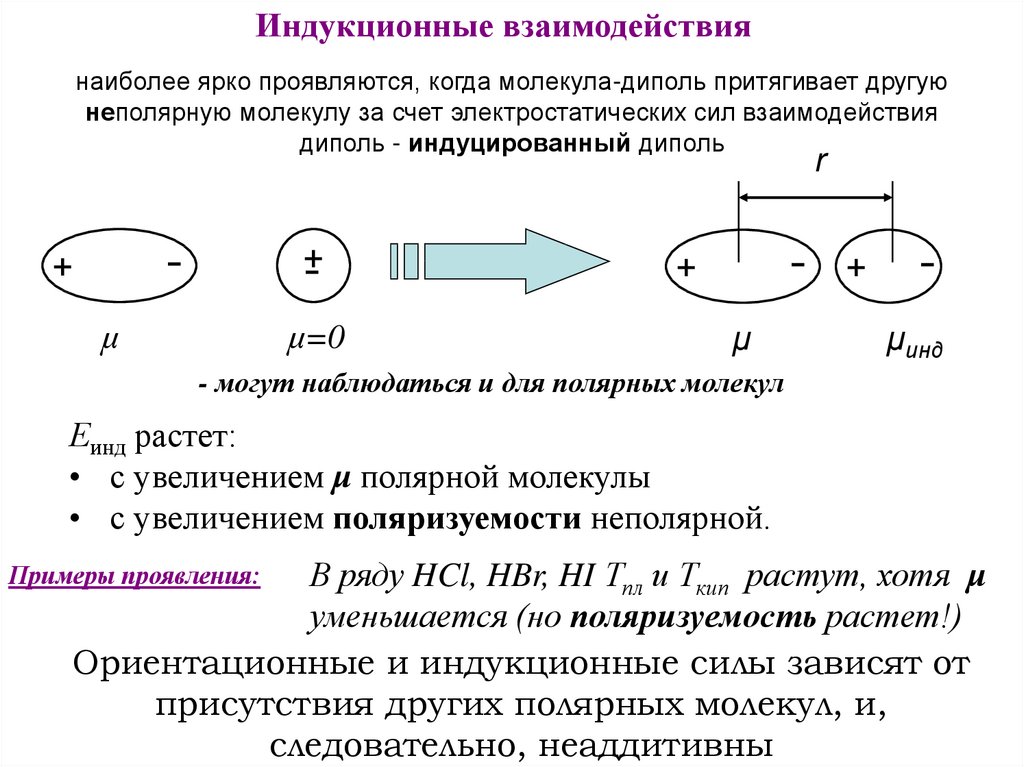
Индукционные взаимодействиянаиболее ярко проявляются, когда молекула-диполь притягивает другую
неполярную молекулу за счет электростатических сил взаимодействия
диполь - индуцированный диполь
r
-
+
+
-
μ
μ=0
-
+
μ
+
μинд
- могут наблюдаться и для полярных молекул
Еинд растет:
• с увеличением μ полярной молекулы
• с увеличением поляризуемости неполярной.
В ряду HCl, HBr, HI Тпл и Ткип растут, хотя μ
уменьшается (но поляризуемость растет!)
Ориентационные и индукционные силы зависят от
присутствия других полярных молекул, и,
следовательно, неаддитивны
Примеры проявления:
80.
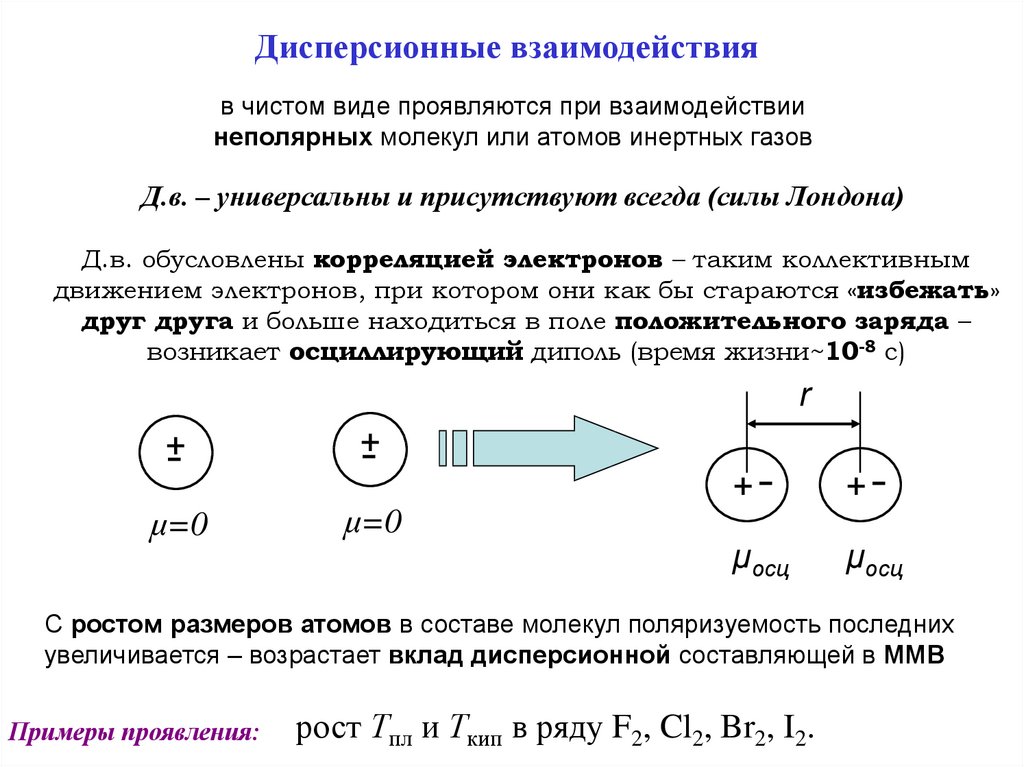
Дисперсионные взаимодействияв чистом виде проявляются при взаимодействии
неполярных молекул или атомов инертных газов
Д.в. – универсальны и присутствуют всегда (силы Лондона)
Д.в. обусловлены корреляцией электронов – таким коллективным
движением электронов, при котором они как бы стараются «избежать»
друг друга и больше находиться в поле положительного заряда –
возникает осциллирующий диполь (время жизни~10-8 c)
r
+
-
+
-
μ=0
μ=0
+-
+-
μосц
μосц
С ростом размеров атомов в составе молекул поляризуемость последних
увеличивается – возрастает вклад дисперсионной составляющей в ММВ
Примеры проявления:
рост Тпл и Ткип в ряду F2, Cl2, Br2, I2.
81.
Зависимость силы притяжения частиц при ММВот расстояния между ними:
A
Eпр 6
r
A f ( i2 , i , Eи , Т 1 )
αi – поляризуемость молекул
Силы отталкивания (4-ая составляющая) – обусловлены
отталкиванием электронных оболочек атомов
Eотт
В
n
r
Потенциал Леннард-Джонса
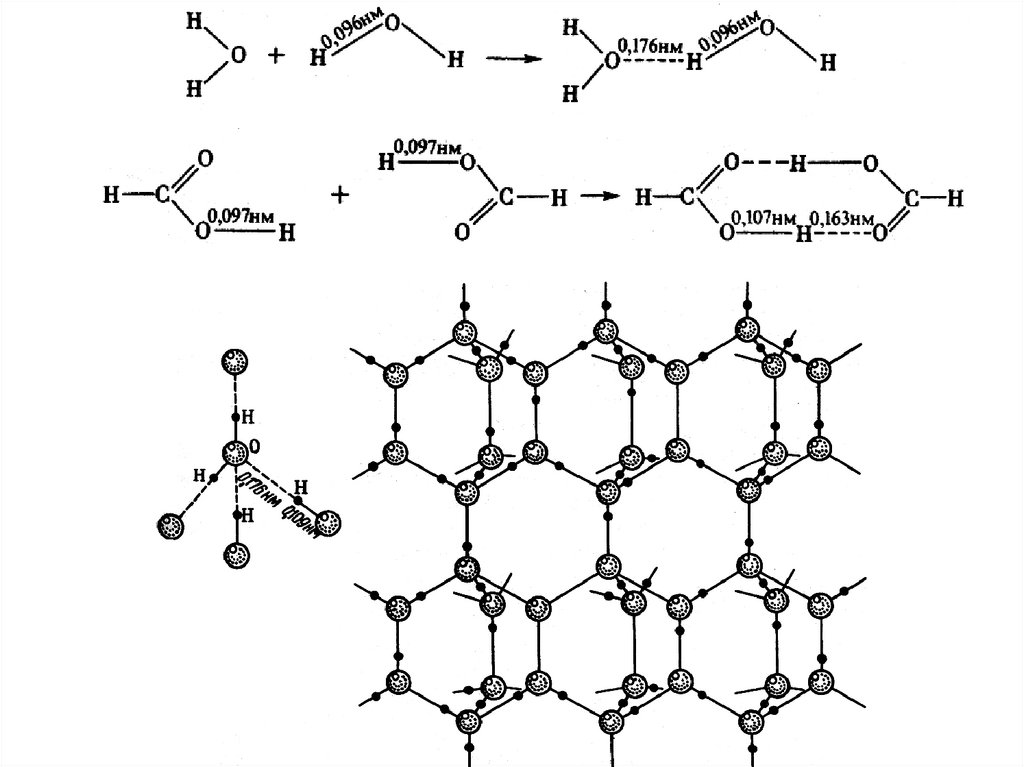
В – const
n = 9 (12, 15)
EМВ
А В
6 n
r
r
Обычно ЕММВ не превышает 16 кДж/моль, однако
в больших молекулах (напр., полимерах),
суммарная энергия ММВ достаточно велика.
82.
ММВуниверсальные
Механизм образования
аналогичен
рассмотренному при
образовании ковалентной
связи
специфические
Все виды взаимодействий
донорно-акцепторного
характера, проявляющиеся в
конденсированной фазе
(передача электронов от одной
молекулы к другой)
Е ~ 8 - 40 кДж/моль
Образующиеся межмолекулярные силы
характеризуются направленностью и
насыщаемостью (как ковалентная связь!)
83.
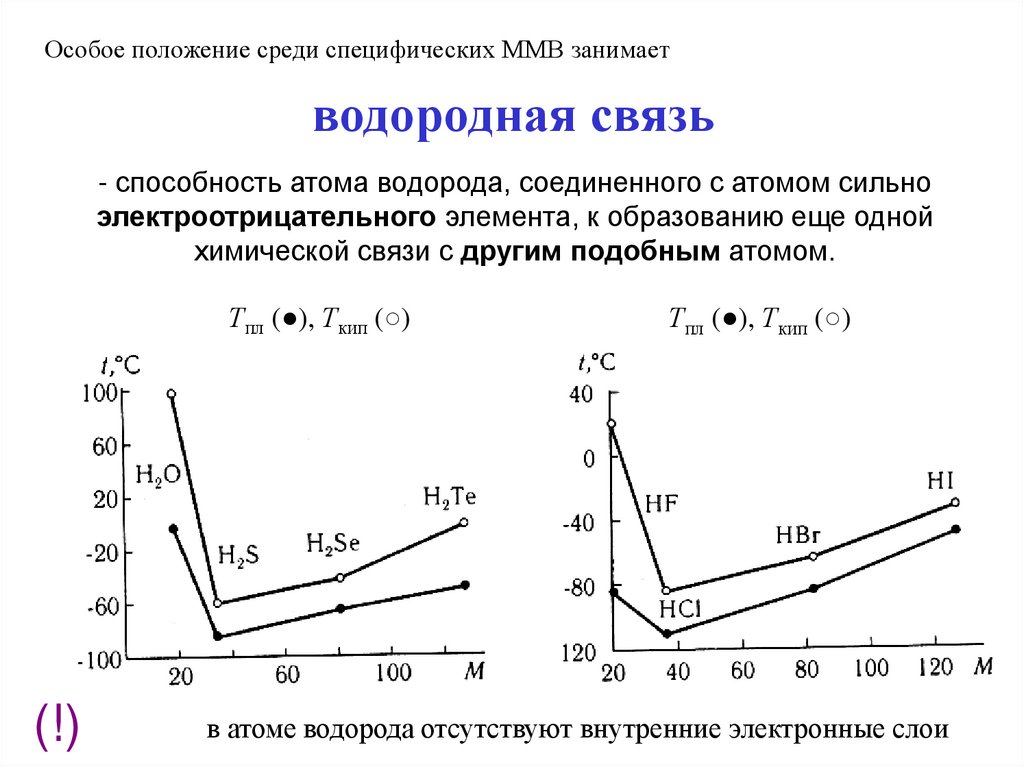
Особое положение среди специфических ММВ занимаетводородная связь
- способность атома водорода, соединенного с атомом сильно
электроотрицательного элемента, к образованию еще одной
химической связи с другим подобным атомом.
Тпл (●), Ткип (○)
(!)
Тпл (●), Ткип (○)
в атоме водорода отсутствуют внутренние электронные слои
84.
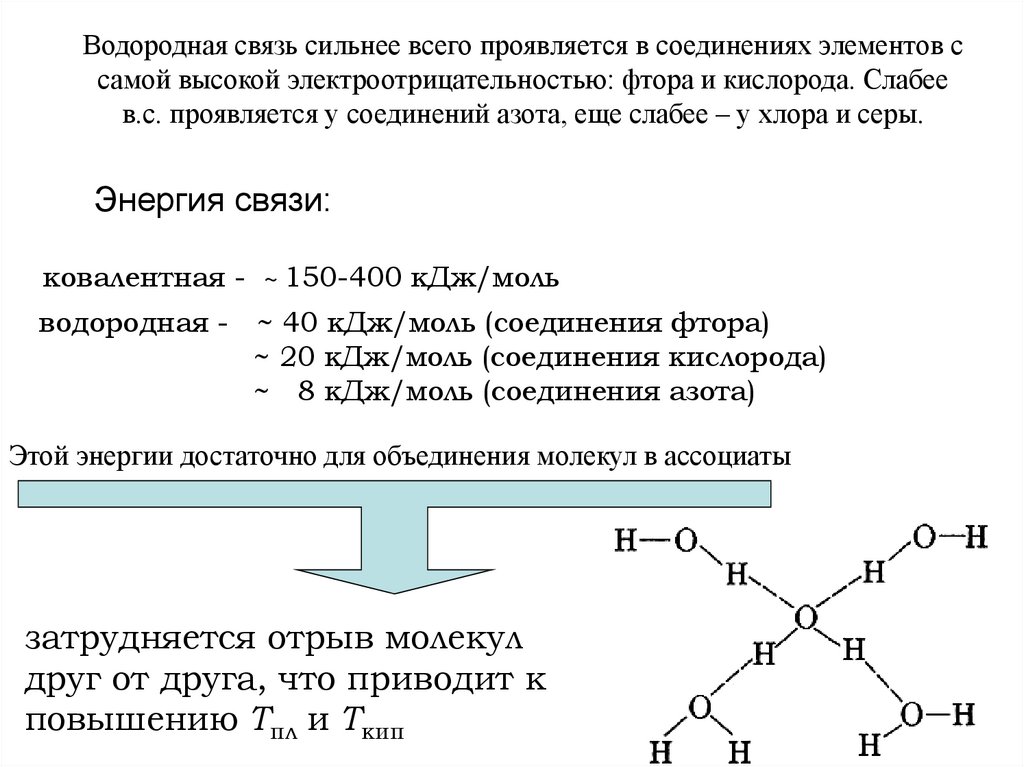
Водородная связь сильнее всего проявляется в соединениях элементов ссамой высокой электроотрицательностью: фтора и кислорода. Слабее
в.с. проявляется у соединений азота, еще слабее – у хлора и серы.
Энергия связи:
ковалентная - ~ 150-400 кДж/моль
водородная - ~ 40 кДж/моль (соединения фтора)
~ 20 кДж/моль (соединения кислорода)
~ 8 кДж/моль (соединения азота)
Этой энергии достаточно для объединения молекул в ассоциаты
затрудняется отрыв молекул
друг от друга, что приводит к
повышению Тпл и Ткип
85.
86.
Агрегатные состояния веществаАтомы и молекулы являются частью более высокой организации вещества –
т.н. агрегатного
состояния (газ, жидкость, твердое состояние)
газовое состояние
ЕММВ < Екин - это приводит к:
• малой плотности газа,
• стремлению к безграничному расширению,
• способности оказывать давление на стенки сосуда
Состояние газа характеризуют: температурой - T, давлением - р и объемом - V
При малых давлениях и высоких температурах для всех типичных газов справедливо
уравнение Менделеева-Клапейрона:
pV nRT
Силы межмолекулярного взаимодействия проявляются, когда молекулы подходят
друг к другу на достаточно близкое расстояние (высокие р, обычные или низкие Т.
Применяют уравнение
Ван-дер-Ваальса:
где a и b - постоянные члены,
учитывающие наличие сил притяжения
между молекулами и собственный объем
молекул, соответственно
an 2
( p 2 )(V bn) nRT
V
87.
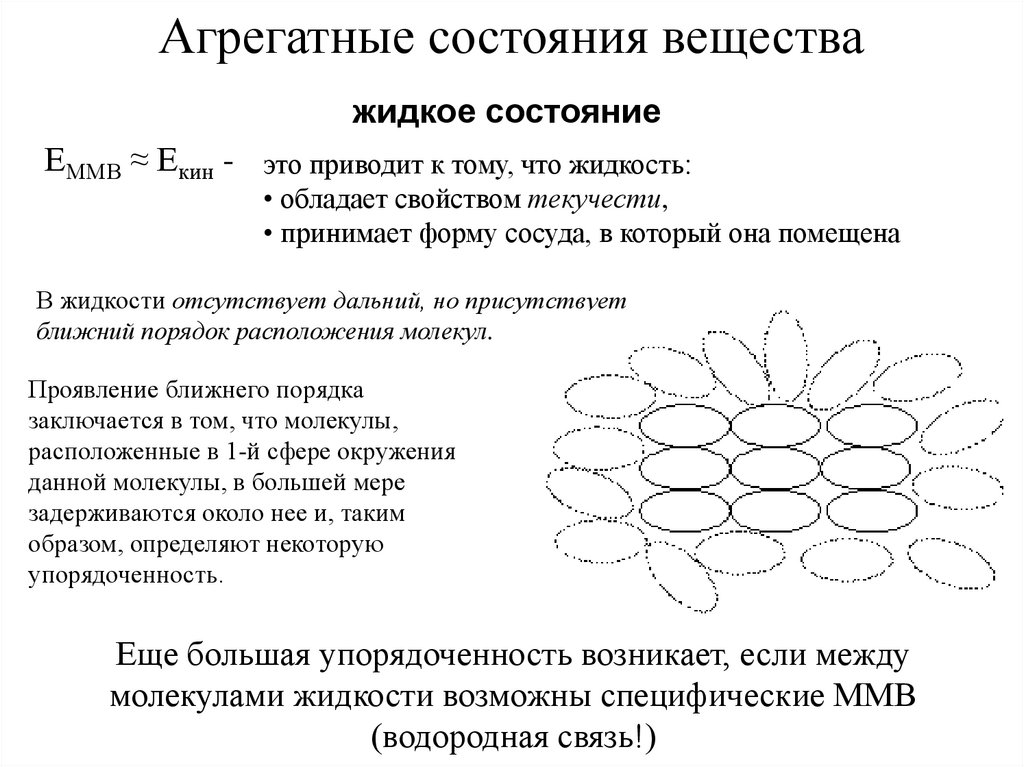
Агрегатные состояния веществажидкое состояние
ЕММВ ≈ Екин - это приводит к тому, что жидкость:
• обладает свойством текучести,
• принимает форму сосуда, в который она помещена
В жидкости отсутствует дальний, но присутствует
ближний порядок расположения молекул.
Проявление ближнего порядка
заключается в том, что молекулы,
расположенные в 1-й сфере окружения
данной молекулы, в большей мере
задерживаются около нее и, таким
образом, определяют некоторую
упорядоченность.
Еще большая упорядоченность возникает, если между
молекулами жидкости возможны специфические ММВ
(водородная связь!)
88.
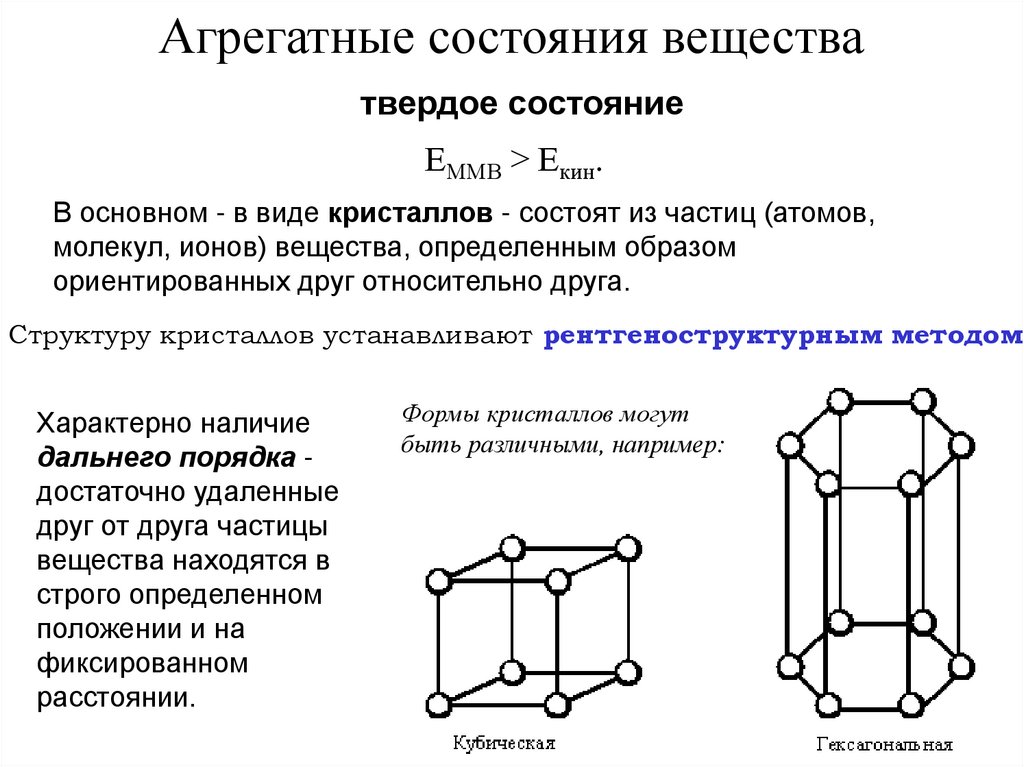
Агрегатные состояния веществатвердое состояние
ЕММВ > Екин.
В основном - в виде кристаллов - состоят из частиц (атомов,
молекул, ионов) вещества, определенным образом
ориентированных друг относительно друга.
Структуру кристаллов устанавливают рентгеноструктурным методом
Характерно наличие
дальнего порядка достаточно удаленные
друг от друга частицы
вещества находятся в
строго определенном
положении и на
фиксированном
расстоянии.
Формы кристаллов могут
быть различными, например:
89.
Кристаллическая решетка - система строго упорядоченных частиц - можетбыть получена определенным перемещением (трансляцией) в пространстве
некоторой наименьшей группировки частиц - элементарной ячейки.
В зависимости от того, какие частицы лежат
в узлах кристаллической решетки, различают
ионные, атомные, молекулярные и металлические решетки.
Ионная решетка
состоит из ионов противоположного знака, чередующихся в узлах.
При этом ионы могут быть простыми (Na+, Cl- ..) и сложными (NH4+, NO3-...).
В связи с тем, что ионная связь - ненасыщенна и ненаправленна,
ионная решетка характеризуется высокими к.ч. = 6, 8.
Из-за высокой прочности ионной связи ионные кристаллические
решетки прочны, а их кристаллы имеют высокие Тплавления.
Примеры соединений с ионными кристаллическими решетками:
NaCl, NH4NO3 и др.
90.
Атомная решеткасостоит из атомов, связанных ковалентными связями, например, в алмазе,
кремнии, графите.
К.ч. определяются количеством σ-связей центрального атома с
окружающими его атомами и не достигают больших значений (часто ~4).
Вследствие высокой прочности ковалентной связи такие решетки очень прочные,
а вещества характеризуются высокими температурами плавления.
(алмаз - самое твердое естественное вещество, не проводит эл. ток)
(в графите – делокализованные π-связи – хорошая электропроводность)
Молекулярная решетка
содержит в узлах молекулы, которые связаны между собой за счет ММВ.
Молекулярные решетки - малопрочные, а вещества с такими решетками
(твердые H2, O2, N2, CO2, H2O) имеют обычно низкие температуры плавления.
Металлическая решетка
содержит в узлах атомы металлов
(упрощенно – ионы металлов и двигающиеся между ними электроны,
вследствие дефицита электронов к.ч. достигает ~ 8-12)
91.
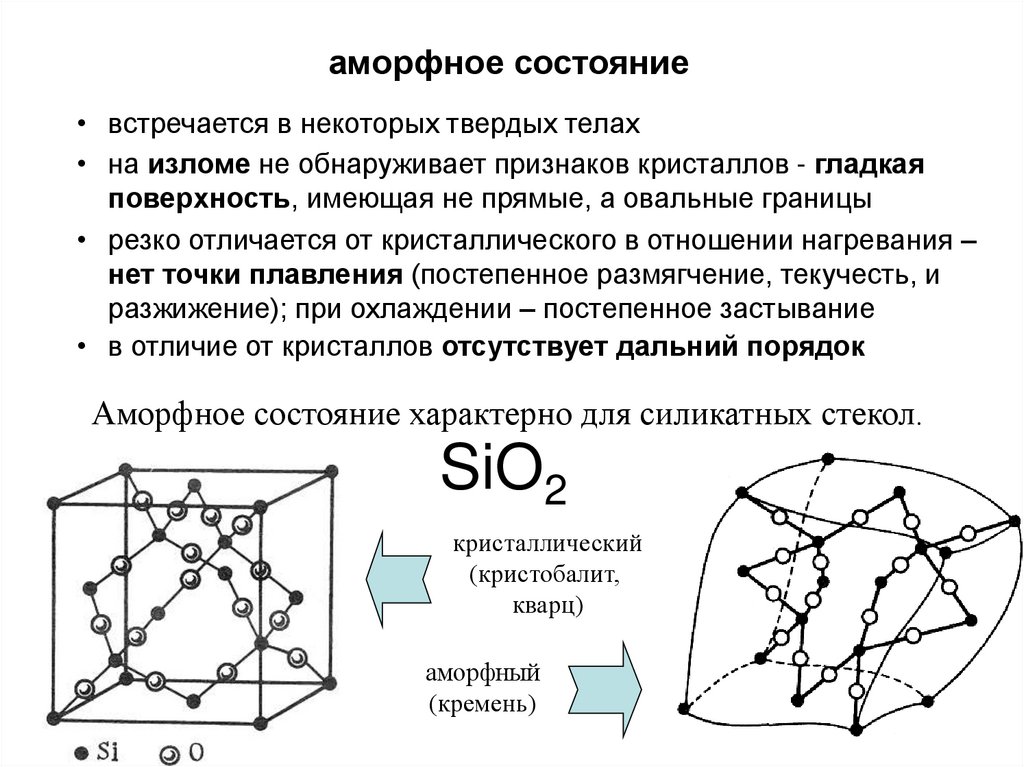
аморфное состояние• встречается в некоторых твердых телах
• на изломе не обнаруживает признаков кристаллов - гладкая
поверхность, имеющая не прямые, а овальные границы
• резко отличается от кристаллического в отношении нагревания –
нет точки плавления (постепенное размягчение, текучесть, и
разжижение); при охлаждении – постепенное застывание
• в отличие от кристаллов отсутствует дальний порядок
Аморфное состояние характерно для силикатных стекол.
SiO2
кристаллический
(кристобалит,
кварц)
аморфный
(кремень)
92.
Агрегатные состояния веществаплазменное состояние
При нагревании до высоких температур
Екин > Еи
- ионизированный газ
В плазме происходят процессы ионизации и рекомбинации:
Х → Х+ + е -
Х+ + е - → Х
плазма
низкотемпературная
высокотемпературная
возникает при температурах 104-105 К
возникает при температурах более 105 К
степень ионизации (α) невысока (ок. 1%)
степень ионизации высокая (ок. 100%)
получается продувкой газа через дугу
(плазмотрон)
существует на Солнце, в УТС
применяется в промышленных процессах
перспективна для применения в УТС
при получении электрической энергии
93.
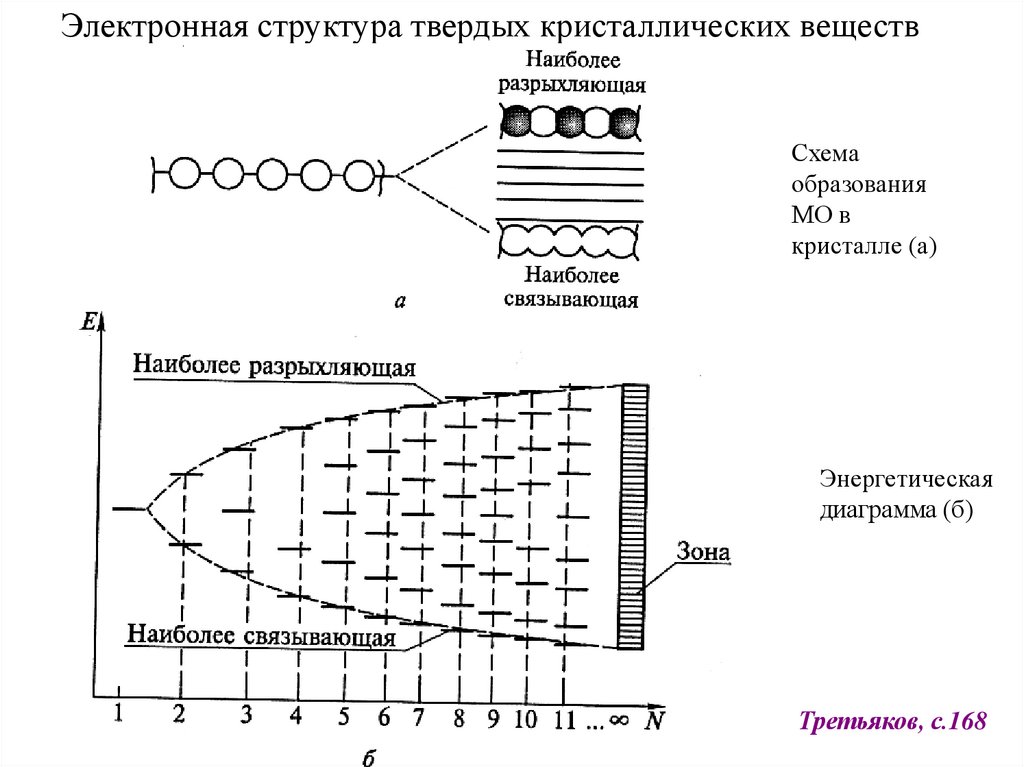
Электронная структура твердых кристаллических веществСхема
образования
МО в
кристалле (а)
Энергетическая
диаграмма (б)
Третьяков, с.168
94.
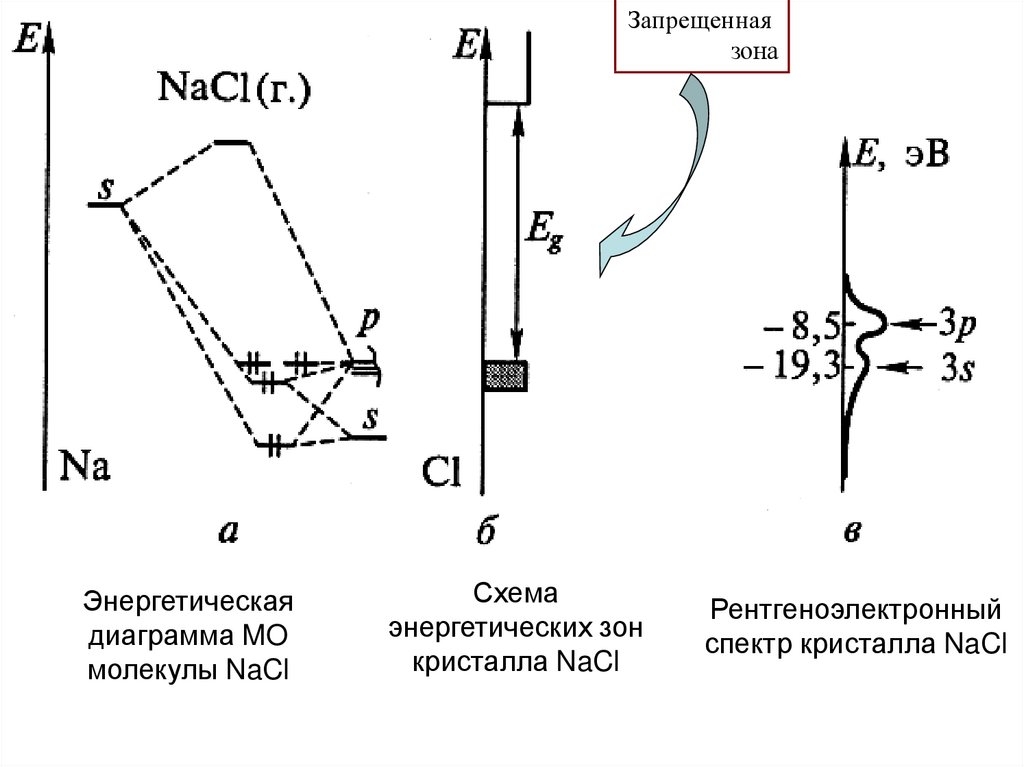
Запрещеннаязона
Энергетическая
диаграмма MO
молекулы NaCl
Схема
энергетических зон
кристалла NaCl
Рентгеноэлектронный
спектр кристалла NaCl
95.
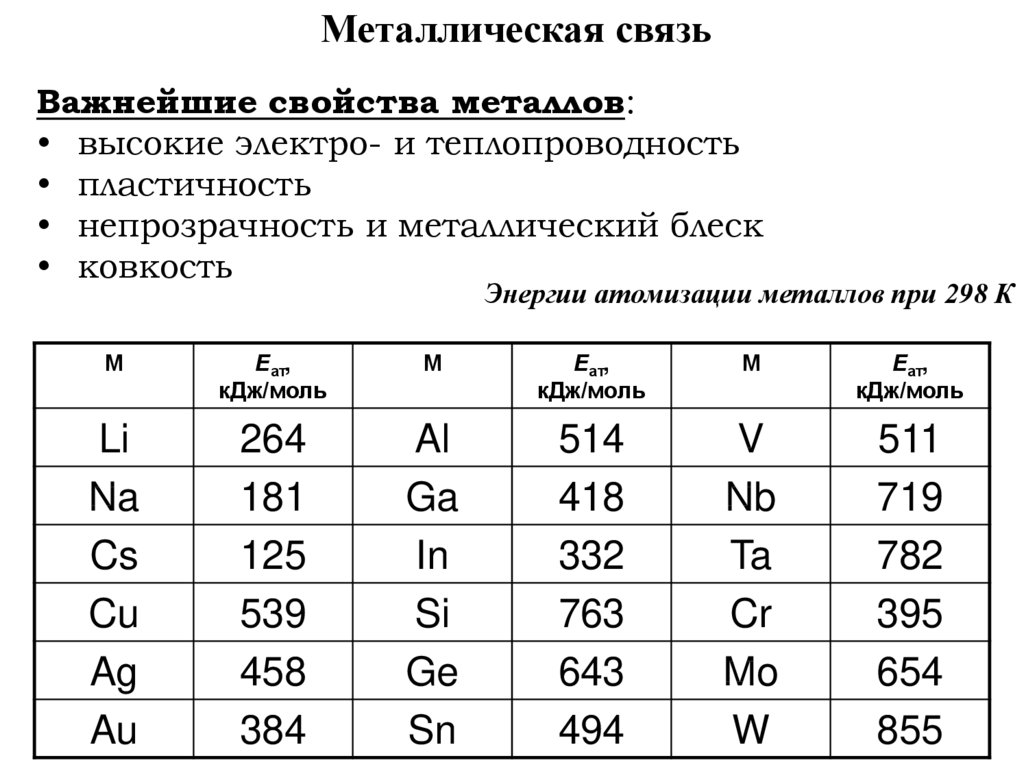
Металлическая связьВажнейшие свойства металлов:
• высокие электро- и теплопроводность
• пластичность
• непрозрачность и металлический блеск
• ковкость
Энергии атомизации металлов при 298 К
М
Еат,
кДж/моль
М
Еат,
кДж/моль
М
Еат,
кДж/моль
Li
Na
Cs
Cu
Ag
Au
264
181
125
539
458
384
Al
Ga
In
Si
Ge
Sn
514
418
332
763
643
494
V
Nb
Ta
Cr
Mo
W
511
719
782
395
654
855
96.
(!) Еат для переходных металлов соизмеримы с энергией ковалентных связейМ.с. – многоцентровая химическая связь с дефицитом
электронов в твердом или жидком веществе, основанная на
обобществлении внешних электронов атомов
М.с. возможна только в конденсированном состоянии.
В паро- и газообразном состоянии –
ковалентносвязанные или свободные атомы
Сходство и различия металлической и ковалентной связей:
К.с. - валентные электроны обобществлены между ограниченным числом атомов
М.с. - валентные электроны обобществлены между атомами всего кристалла
Металлическая связь ненасыщенна
К.с. – распределение электронной плотности между атомами строго направлено
М.с. – равномерное распределение электронной плотности между атомами
Металлическая связь ненаправленна
МВС не может объяснить образование М.с.
С точки зрения ММО М.с. – электрон-дефицитная, с дробным порядком связи.
97.
Металлическая связь в чистом виде – только в ЩМ и ЩЗМЩМ
ЩЗМ
а – валентная зона
б – зона проводимости
Переходные металлы: высокие Тпл, Ткип, Еат, твердость
Имеется вклад ковалентности !
Экспериментально установлено: в переходных металлах малая доля
валентных электронов обобществлена (~ 1 электрон/атом).
Остальные е образуют ковалентные связи с соседними атомами
(перекрывание d-орбиталей) – особенно в элементах середины декад.


















































 Химия
Химия








