Похожие презентации:
Строение, изомерия, физические и химические свойства алканов. Способы получения алканов. Применение
1. СТРОЕНИЕ,ИЗОМЕРИЯ, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.ПРИМЕНЕНИЕ.
Подготовила преподавательорганической химии
Попова А.С.
2.
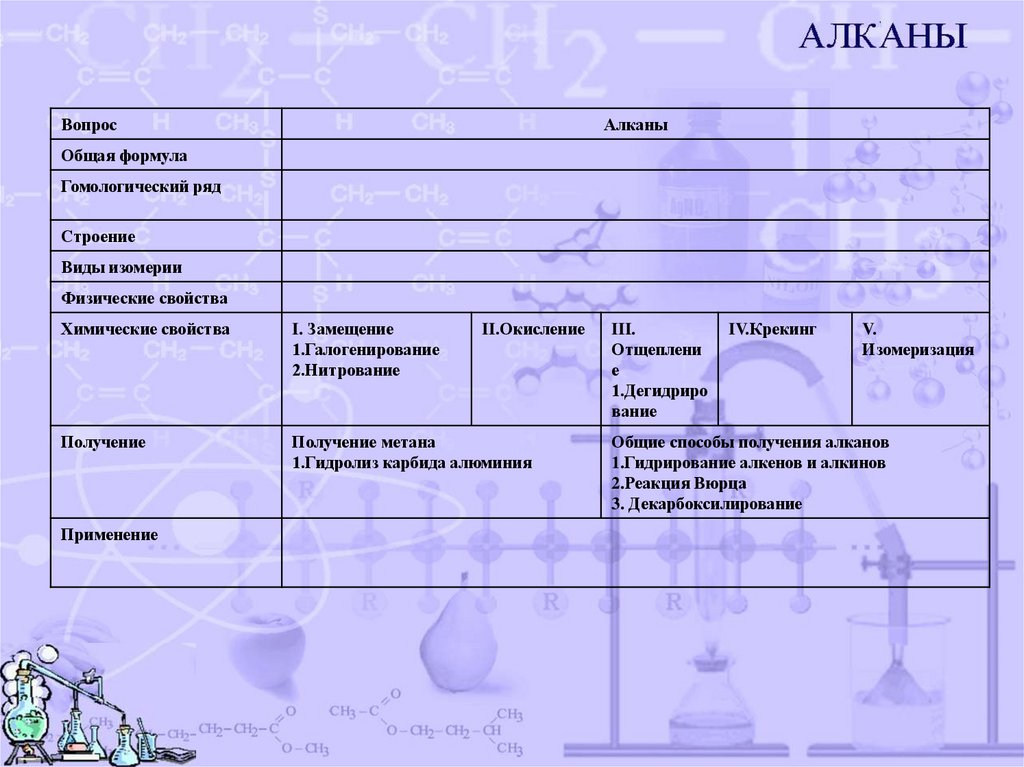
ВопросАлканы
Общая формула
Гомологический ряд
Строение
Виды изомерии
Физические свойства
Химические свойства
I. Замещение
1.Галогенирование
2.Нитрование
Получение
Получение метана
1.Гидролиз карбида алюминия
Применение
II.Окисление
III.
Отщеплени
е
1.Дегидриро
вание
IV.Крекинг
V.
Изомеризация
Общие способы получения алканов
1.Гидрирование алкенов и алкинов
2.Реакция Вюрца
3. Декарбоксилирование
3. Гомологический ряд алканов
CnH2n+24. Строение алканов
• Простейшим представителем алканов являетсяметан. Рассмотрим строение его молекулы.
• CH4- ковалентная полярная связь.
H
H
..
C
..
..
..
H
H
H
C
H
H
H
H
С
109°28’
• 109° 28’ – угол между
связями
• Длина связи C-H 0.109 нм
C-C 0.154 нм
L=0.109 нм
109°28’
H
H
H
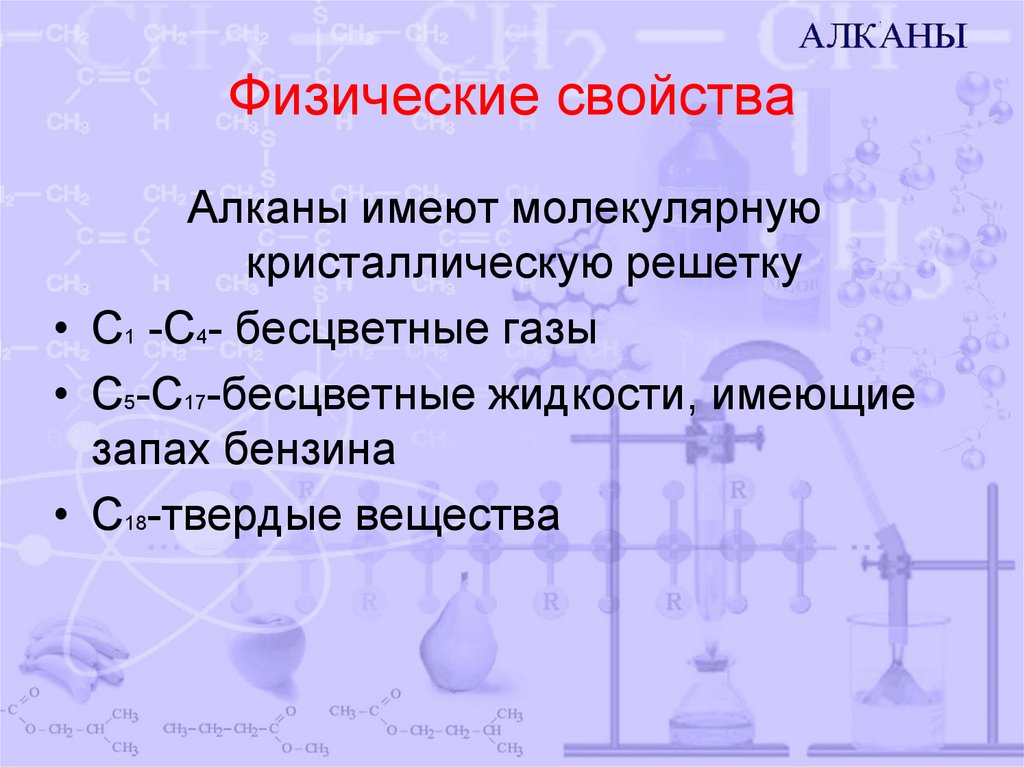
5. Физические свойства
Алканы имеют молекулярнуюкристаллическую решетку
• С1 -С4- бесцветные газы
• С5-С17-бесцветные жидкости, имеющие
запах бензина
• С18-твердые вещества
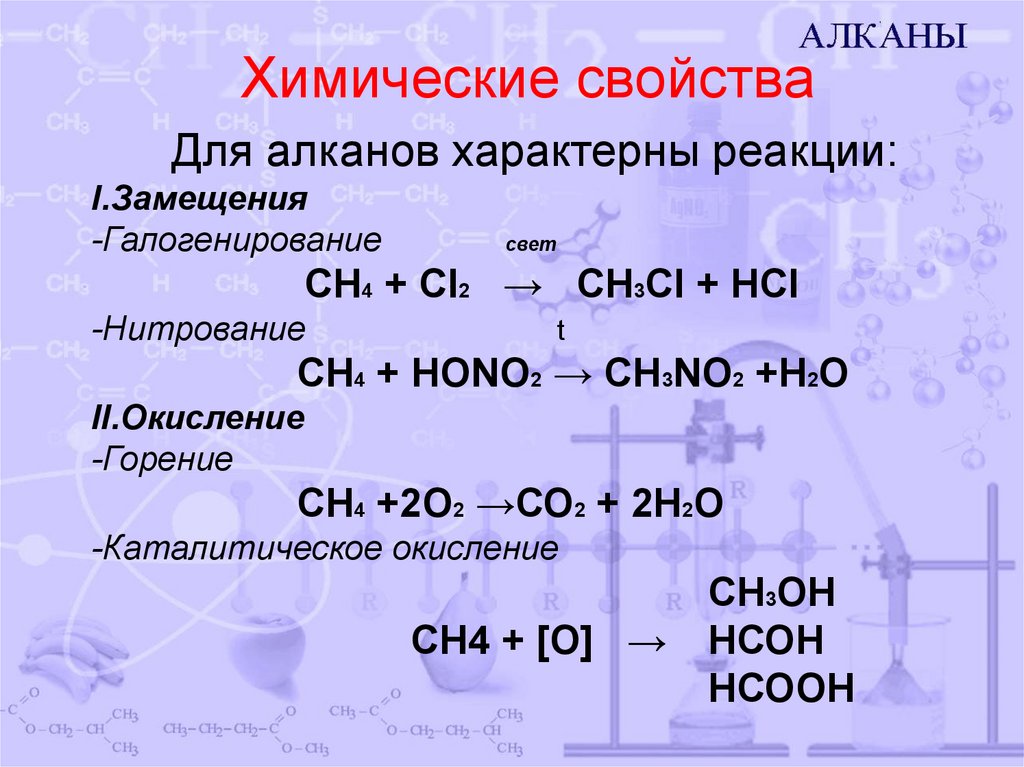
6. Химические свойства
Для алканов характерны реакции:I.Замещения
-Галогенирование
свет
CH4 + Cl2 → CH3Cl + HCl
-Нитрование
t
СН4 + HONO2 → CH3NO2 +H2O
II.Окисление
-Горение
СН4 +2О2 →СО2 + 2Н2О
-Каталитическое окисление
СН4 + [О] →
СН3ОН
НСОН
НСООН
7. Химические свойства
III.Отщепления1.Дегидрирование
t,Ni
С3Н8→С3Н6 + Н2
15000C
2СН4 → С2Н2 + 3Н2
2.Пиролиз
10000c
СН4 →С+ 2Н2
IV.Крекинг
6000c
С8Н18 →С4Н10 + С4Н8
IV.Изомеризация
t,AlCl3
СН3-СН2-СН2-СН3 →СН3-СН-СН3
/
СН3
8. Методы получения метана
1.Разложение карбида алюминия водой иликислотой.
Al4C3 +12H2O → 4Al(OH)3 + 3CH4
Al4C3 +12HСl → 4AlCl3 + 3CH4
2.Синтез из простых веществ
t,Ni
С + 2Н2 →СН4
3.Восстановление оксидов углерода:
t,Ni
СО + 3Н2 → СН4 + Н2О
4.Декарбоксилирование
CH3COONa + NaOH CH4 + Na2CO3
9. Способы получения
1.Гидрирование алкенов и алкинов(Ni,t)
СН2=СН2 +Н2 → СН3-СН3
СН ≡ СН +2Н2 → СН3-СН3
2.Реакция Вюрца
СН3Сl + 2Na + CH3Cl → C2H6 + 2NaCl
10. Применение
Для получения:1. Резины
2.Типографской краски
3.Синтетического бензина
4.Синтез-газа
5.Растворителей
6.Горючего
7.Хладаагентов







 Химия
Химия








