Похожие презентации:
Строение,изомерия, физические и химические свойства алканов. Способы получения алканов.применение
1. СТРОЕНИЕ,ИЗОМЕРИЯ, ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.ПРИМЕНЕНИЕ.
Модуль 1 «Предельныеуглеводороды. Алканы»
СТРОЕНИЕ,ИЗОМЕРИЯ,
ФИЗИЧЕСКИЕ И
ХИМИЧЕСКИЕ СВОЙСТВА
АЛКАНОВ. СПОСОБЫ
ПОЛУЧЕНИЯ
АЛКАНОВ.ПРИМЕНЕНИЕ.
2.
Изучение учебных элементов модуля 1«Предельные углеводороды.
Алканы»(Максимально 15 баллов).
Общая
формула
Строение
молекулы(тип
гибридизации,
угол, форма,
вид связи, длина
связи)
УЭ1
Изомерия,
Номенклатура,
гомологический
ряд (примеры
изомеров к С6)
УЭ2
Физические
свойства,
получение
(уравнения
реакций)
УЭ3
Химические
свойства
(уравнения
реакций) УЭ4
Применение
Соединений
(направления
использования
по химическим
свойствам) УЭ5
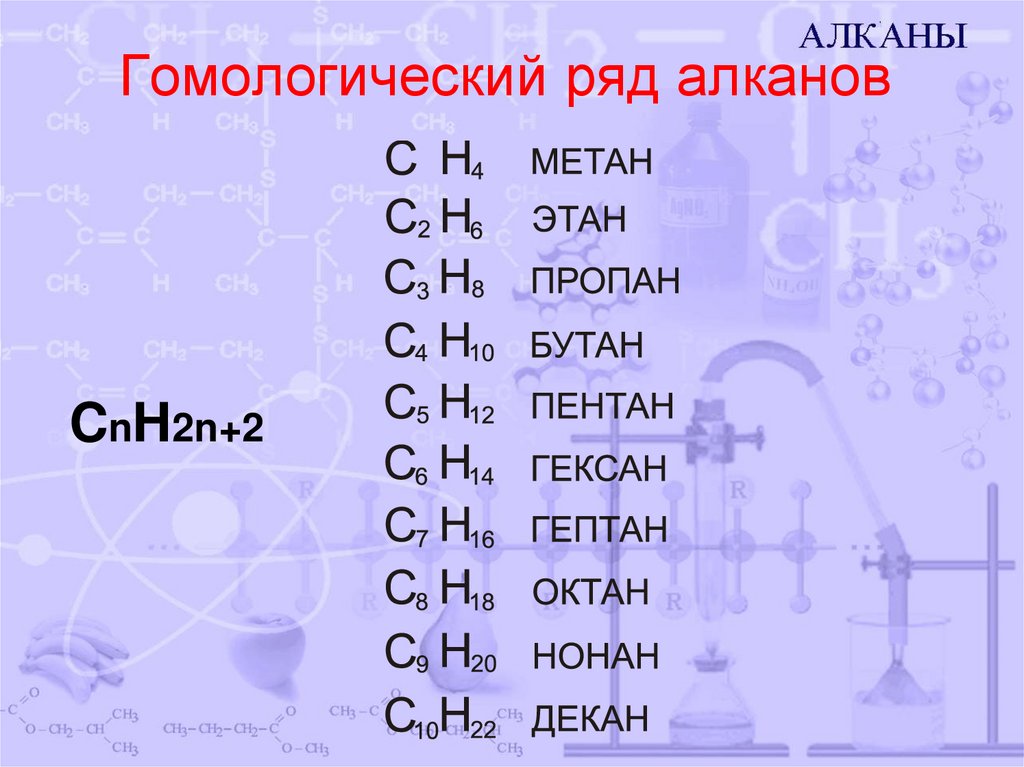
3. Гомологический ряд алканов
CnH2n+24. Строение алканов
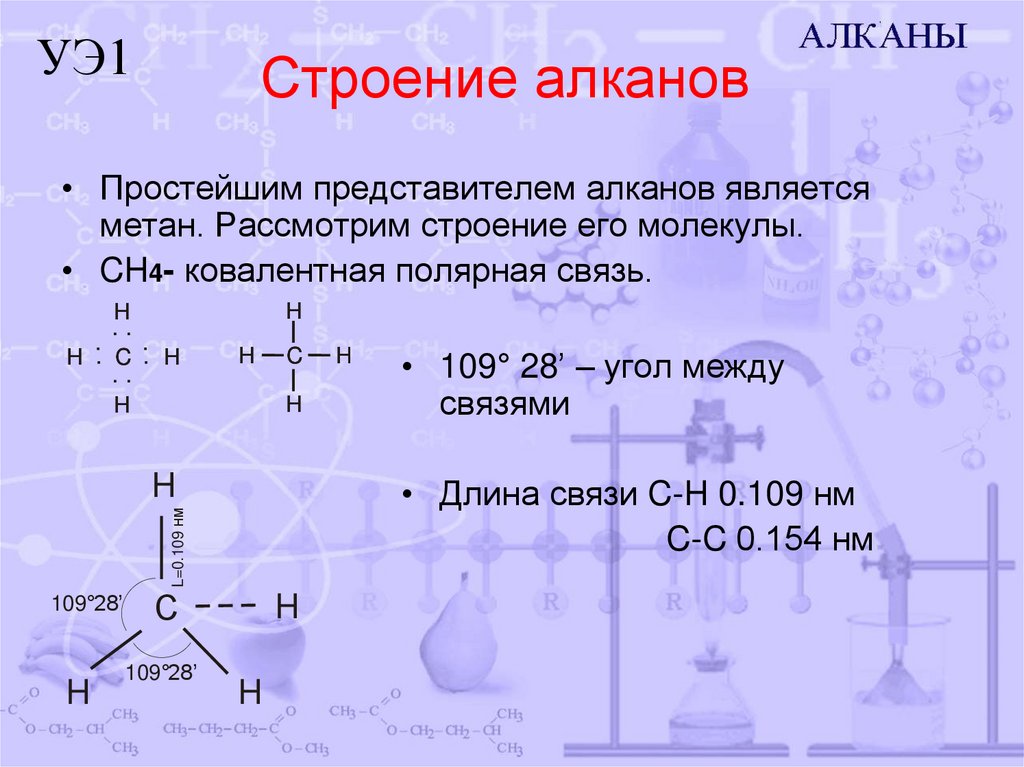
УЭ1Строение алканов
• Простейшим представителем алканов является
метан. Рассмотрим строение его молекулы.
• CH4- ковалентная полярная связь.
H
H
..
C
..
..
..
H
H
H
C
H
H
H
H
С
109°28’
• 109° 28’ – угол между
связями
• Длина связи C-H 0.109 нм
C-C 0.154 нм
L=0.109 нм
109°28’
H
H
H
5.
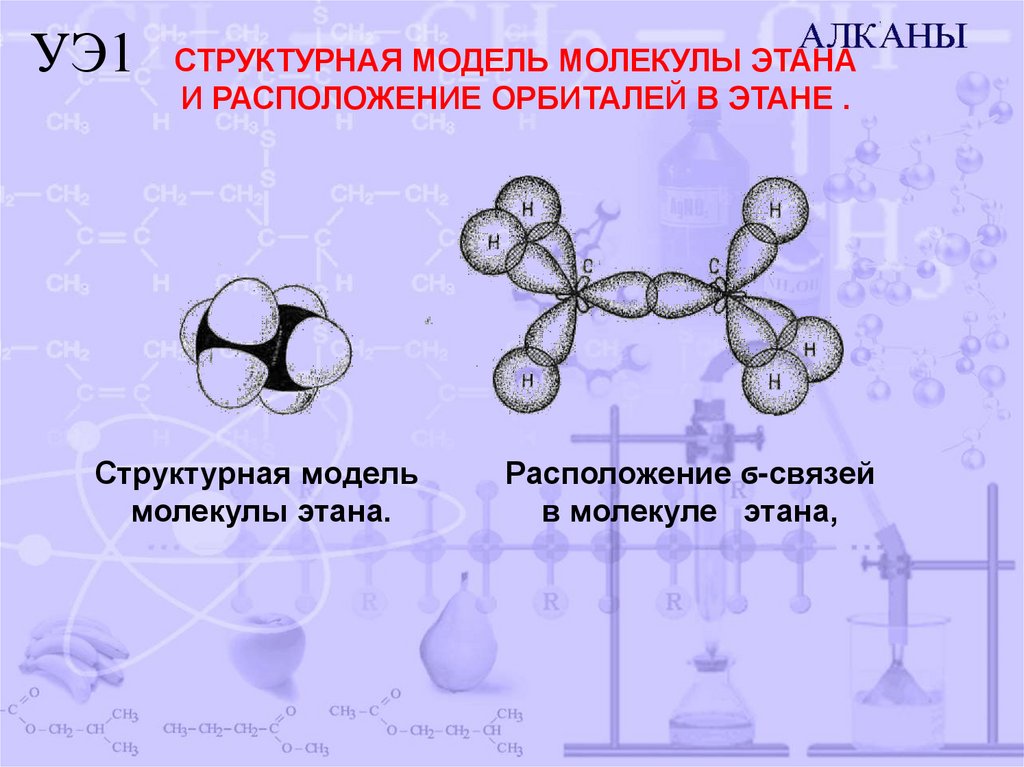
УЭ1 СТРУКТУРНАЯ МОДЕЛЬ МОЛЕКУЛЫ ЭТАНАИ РАСПОЛОЖЕНИЕ ОРБИТАЛЕЙ В ЭТАНЕ .
Структурная модель
молекулы этана.
Расположение ϭ-связей
в молекуле этана,
6.
УЭ22. ИЗОМЕРИЯ АЛКАНОВ
Изомерия – это явление, при котором вещества
имеют одинаковый качественный и количественный
состав, но различные свойства.
Тип изомерии алканов:
1. Структурная изомерия ( изомерия углеродного скелета)
ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА
7. Физические свойства
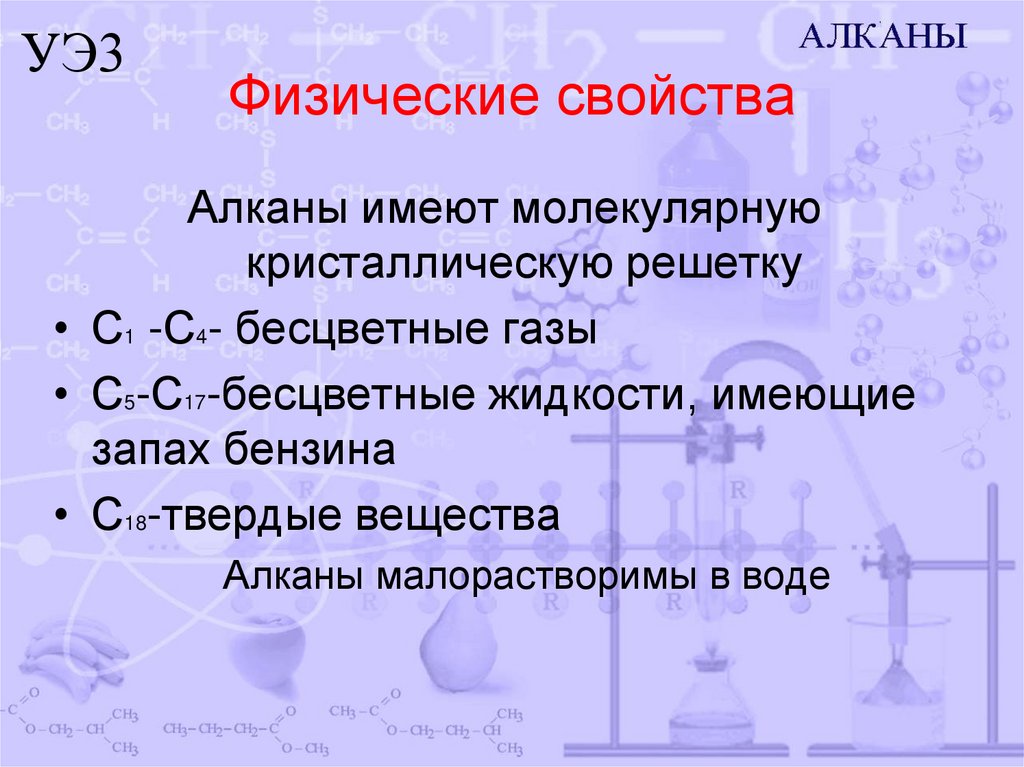
УЭ3Физические свойства
Алканы имеют молекулярную
кристаллическую решетку
• С1 -С4- бесцветные газы
• С5-С17-бесцветные жидкости, имеющие
запах бензина
• С18-твердые вещества
Алканы малорастворимы в воде
8. Методы получения метана
УЭ3Методы получения метана
1.Разложение карбида алюминия водой или
кислотой.
Al4C3 +12H2O → 4Al(OH)3 + 3CH4
Al4C3 +12HСl → 4AlCl3 + 3CH4
2.Синтез из простых веществ
t, Ni
С + 2Н2 →СН4
3.Сплавление ацетата натрия со щелочами.
CH3COONa + NaOH
СН4+ Na2CO3
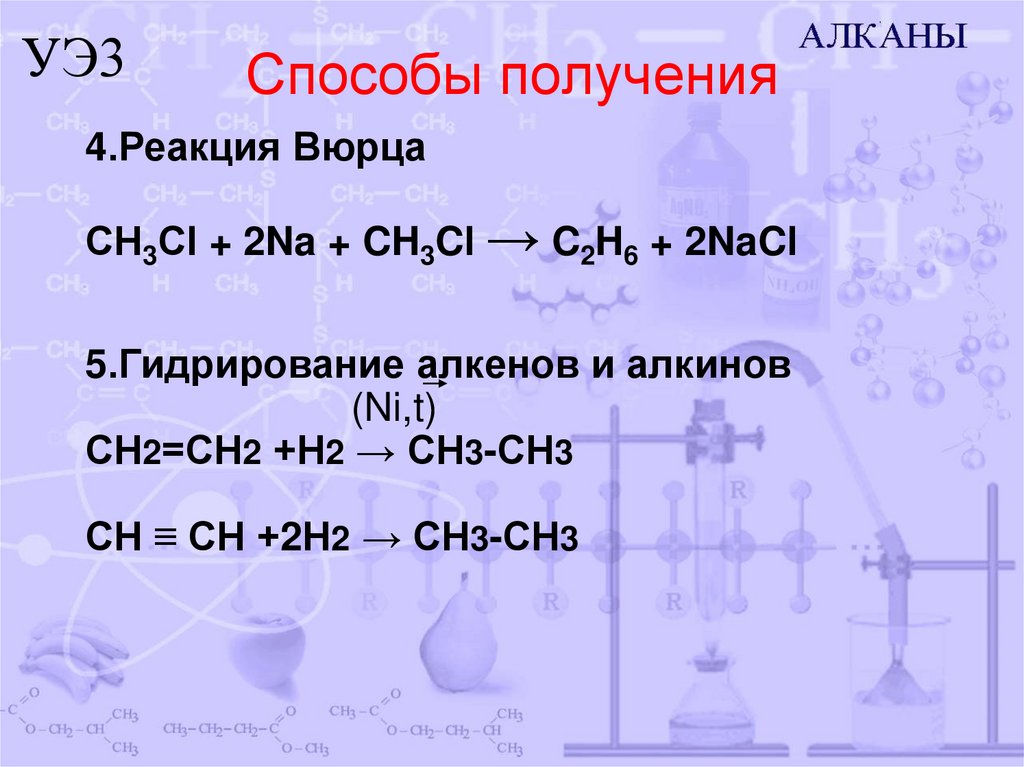
9. Способы получения
УЭ3Способы получения
4.Реакция Вюрца
СН3Сl + 2Na + CH3Cl → C2H6 + 2NaCl
5.Гидрирование алкенов и алкинов
(Ni,t)
СН2=СН2 +Н2 → СН3-СН3
СН ≡ СН +2Н2 → СН3-СН3
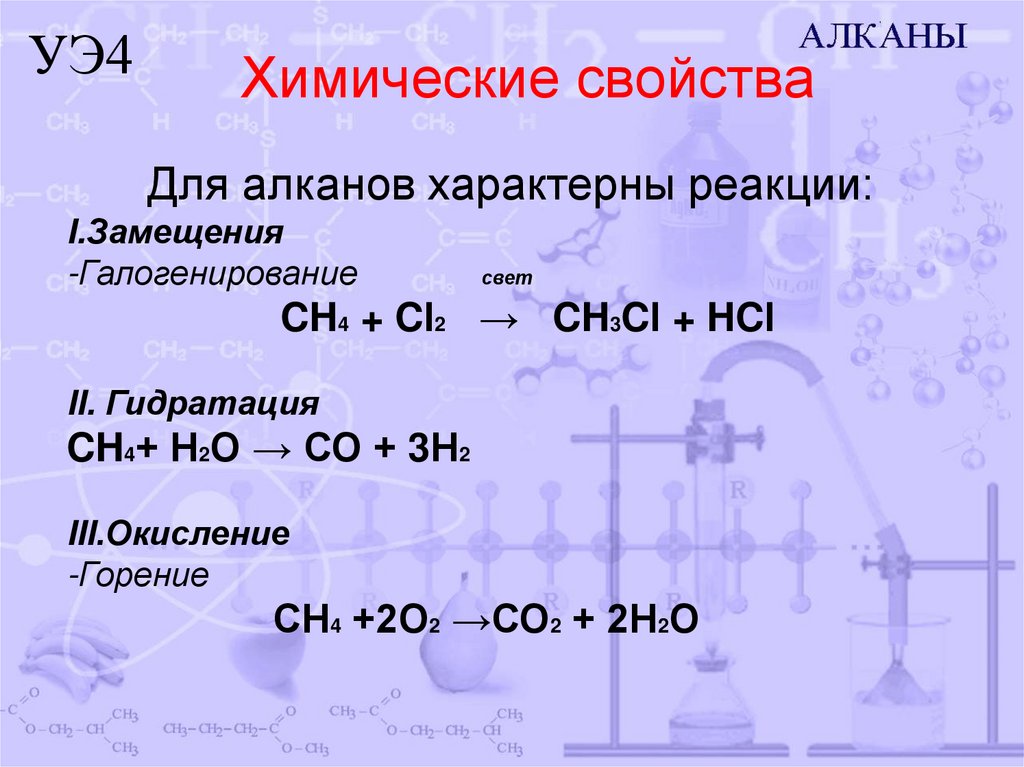
10. Химические свойства
УЭ4Химические свойства
Для алканов характерны реакции:
I.Замещения
-Галогенирование
свет
CH4 + Cl2 → CH3Cl + HCl
II. Гидратация
CH4+ Н2О → СО + 3Н2
III.Окисление
-Горение
СН4 +2О2 →СО2 + 2Н2О
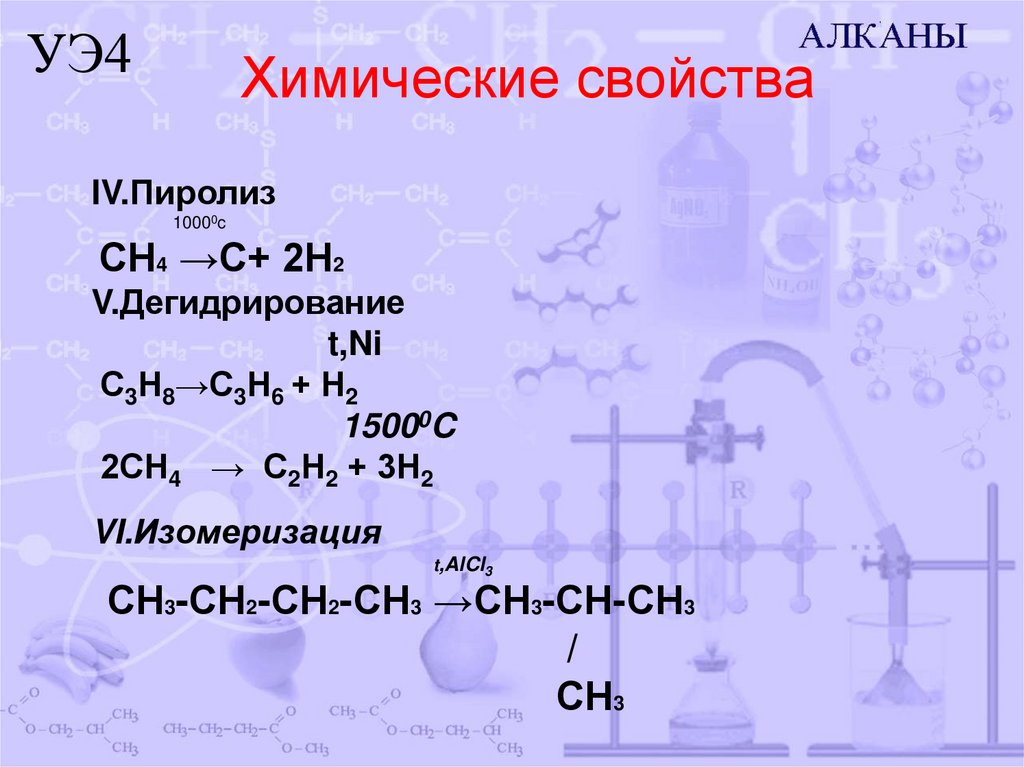
11. Химические свойства
УЭ4Химические свойства
IV.Пиролиз
10000c
СН4 →С+ 2Н2
V.Дегидрирование
t,Ni
С3Н8→С3Н6 + Н2
15000C
2СН4 → С2Н2 + 3Н2
VI.Изомеризация
t,AlCl3
СН3-СН2-СН2-СН3 →СН3-СН-СН3
/
СН3
12. Применение
УЭ5Применение
Для получения:
1.Растворителей, хладагентов
2.Синтез-газа, получение спирта
3.Горючего
4.Типографской краски
5. Каучука, резины, уксусной кислоты
(органический синтез)
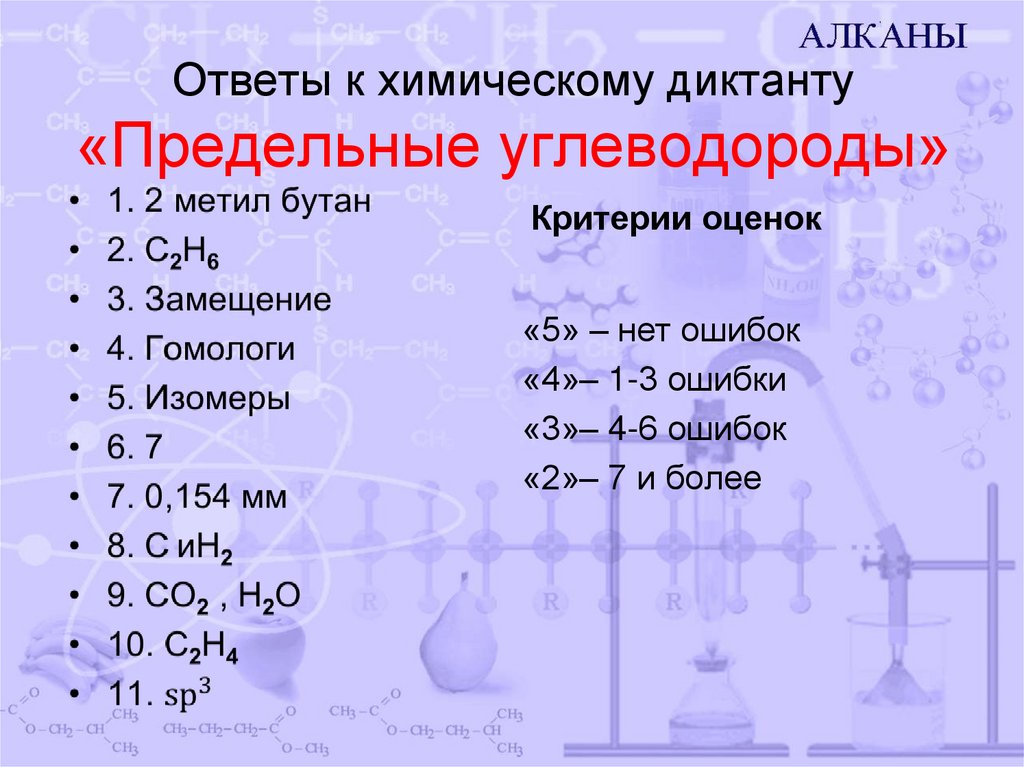
13. Ответы к химическому диктанту «Предельные углеводороды»
Критерии оценок«5» – нет ошибок
«4»– 1-3 ошибки
«3»– 4-6 ошибок
«2»– 7 и более





 Химия
Химия








