Похожие презентации:
Равновесие химических реакций. Занятие 12
1.
Занятие 12РАВНОВЕСИЕ
ХИМИЧЕСКИХ
РЕАКЦИЙ
2.
Содержание• Модуль 1. Понятие химического
равновесия. Принцип Ле Шателье —
Брауна
• Модуль 2. Условия смещения химического
равновесия
3.
Модуль 1. Понятие химического равновесия.Принцип Ле Шателье — Брауна
Состояние химического равновесия характерно
только для обратимых реакций
4.
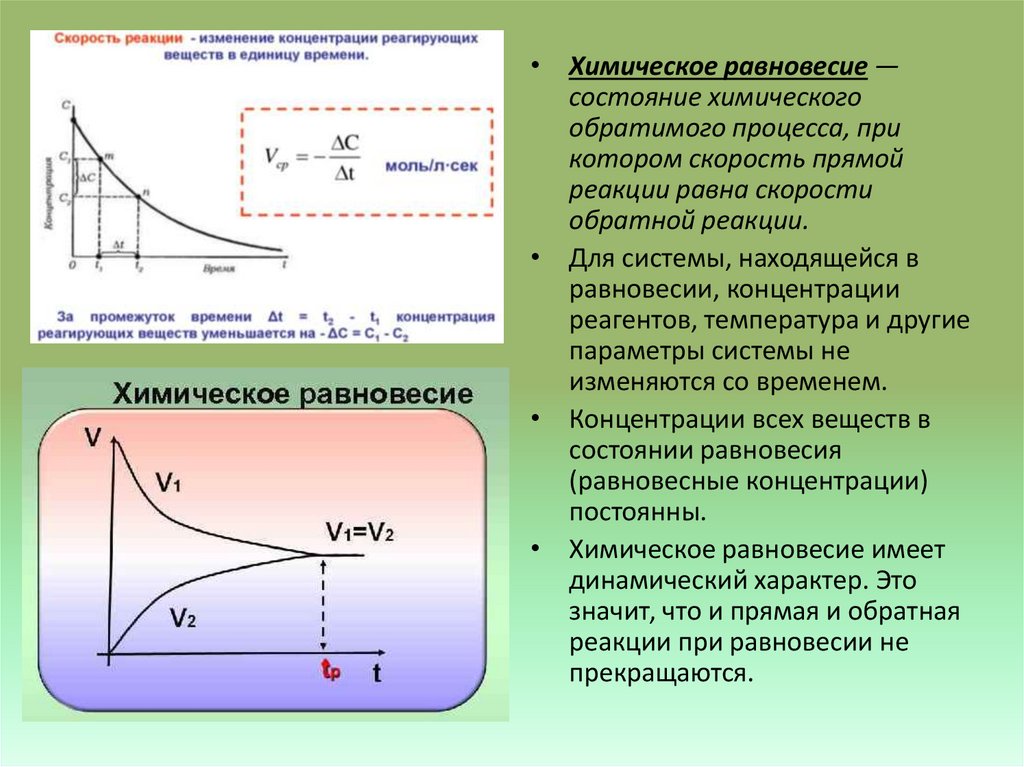
• Химическое равновесие —состояние химического
обратимого процесса, при
котором скорость прямой
реакции равна скорости
обратной реакции.
• Для системы, находящейся в
равновесии, концентрации
реагентов, температура и другие
параметры системы не
изменяются со временем.
• Концентрации всех веществ в
состоянии равновесия
(равновесные концентрации)
постоянны.
• Химическое равновесие имеет
динамический характер. Это
значит, что и прямая и обратная
реакции при равновесии не
прекращаются.
5.
Принцип Ле Шателье— Брауна (1884г)Анри Луи Ле Шателье
(1850-1936)
Карл Фердинанд
Браун (1850–1918)
Если на систему, находящуюся в устойчивом
равновесии, воздействовать извне, изменяя
какое-либо из условий равновесия
(температура, давление, концентрация), то в
системе усиливаются процессы, направленные в
сторону противодействия изменениям.
Анри Ле Шателье сформулировал этот
термодинамический принцип подвижного
равновесия, позже обобщённый Карлом Брауном
Принцип применим к равновесию любой природы:
механическому, тепловому, химическому,
электрическому
Если внешние условия изменяются, это приводит к
изменению равновесных концентраций веществ. В
этом случае говорят о нарушении или
смещении химического равновесия
6.
Модуль 2. Условия смещенияхимического равновесия
• ВЛИЯНИЕ
КОНЦЕНТРАЦИИ
При повышении
концентрации реагентов
(т.е вправо) равновесие
смещается в сторону
продуктов реакции.
• При повышении
концентрации
продуктов реакции
равновесие смещается
влево, в сторону
исходных веществ.
7.
2.ВЛИЯНИЕ ТЕМПЕРАТУРЫ• Реакции, сопровождающиеся
выделением теплоты,
называются
экзотермическими,
поглощением эндотермическими.
• Каждой обратимой реакции
одно из направлений отвечает
экзотермическому процессу, а
другое - эндотермическому.
• При повышении температуры
химическое равновесие
смещается в направлении
эндотермической реакции, при
понижении температуры экзотермической реакции.
8.
3. ВЛИЯНИЕ ДАВЛЕНИЯ• СаО + СО2 ↔ СаСО3
• Влияние давления на
состояние равновесия
проявляется только при
наличии в системе газов !!!
• При повышении давления
равновесие сдвигается в
направлении образования
веществ (исходных или
продуктов) с меньшим
объемом (числом моль),
при понижении - с большим
объемом
9.
• Катализаторы невлияют на
• положение
равновесия!
• При введении
• катализатора
ускоряется
• скорость как прямой,
так
• и обратной реакции








 Химия
Химия








