Похожие презентации:
Типы химических реакций
1.
Типы химических реакций«Чтобы
познать,
нужно
наблюдать».
Составитель: учитель химии
МАОУ «Лицей №15» г.Мытищи
Миронова Наталия Сергеевна
2.
Химическая реакция — превращениеодного или нескольких исходных веществ
(реагентов) в отличающиеся от них по
химическому составу или строению вещества
(продукты реакции), сопровождающееся
разрывом и/или образованием химических
связей.
3.
Признаки химических реакцийВыпадение осадка
4.
Выделение газа5.
Изменение окраски6.
Выделение света и тепла7.
??
Условия проведения
химических реакций
?
?
8.
Соприкосновениереагирующих
веществ
Нагревание
Условия проведения
химических реакций
Свет
Электрический ток
9.
Типы химических реакцийреакция соединения А+В=АВ
реакция разложения АВ=А+В
реакция замещения А+ВС=АС+В
реакция обмена
АВ+СD=АС+ВD
10.
Реакция соединения – реакция, в ходе которой изнескольких простых и сложных веществ
образуется одно более сложное вещество.
Горение кальция
2Ca + O2 = 2CaO
Горение оксида серы (IV)
2SO2 + O2 = 2SO3
Взаимодействие оксида серы (IV) с водой
SO2 + H2O = H2SO3
11.
Реакция разложения – реакция, в которой изодного исходного вещества образуется несколько
новых веществ.
Разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2
Электролиз воды
2H2O = 2H2 + O2
Разложение нитрата калия
2KNO3 = 2KNO2 + O2
12.
Реакция замещения – реакция между простым исложным веществами, в результате которой
атомы простого вещества замещают атомы
одного из элементов сложного вещества.
Взаимодействие цинка с соляной кислотой
Zn + 2HCl = ZnCl2 + H2
Взаимодействие натрия с водой
2Na + 2H2O = 2NaOH + H2
Взаимодействие железа с раствором сульфата
меди (II)
Fe + CuSO4 = FeSO4 + Cu↓
13.
Реакция обмена – реакция, в результате которойдва вещества обмениваются своими составными
частями, образуя два новых вещества.
Взаимодействие растворов сульфата меди (II) и
гидроксида калия
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Взаимодействие раствора гидроксида натрия с
азотной кислотой
NaOH + HNO3 = NaNO3 + H2O
Взаимодействие хлорида аммония с гидроксидом
кальция
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
14.
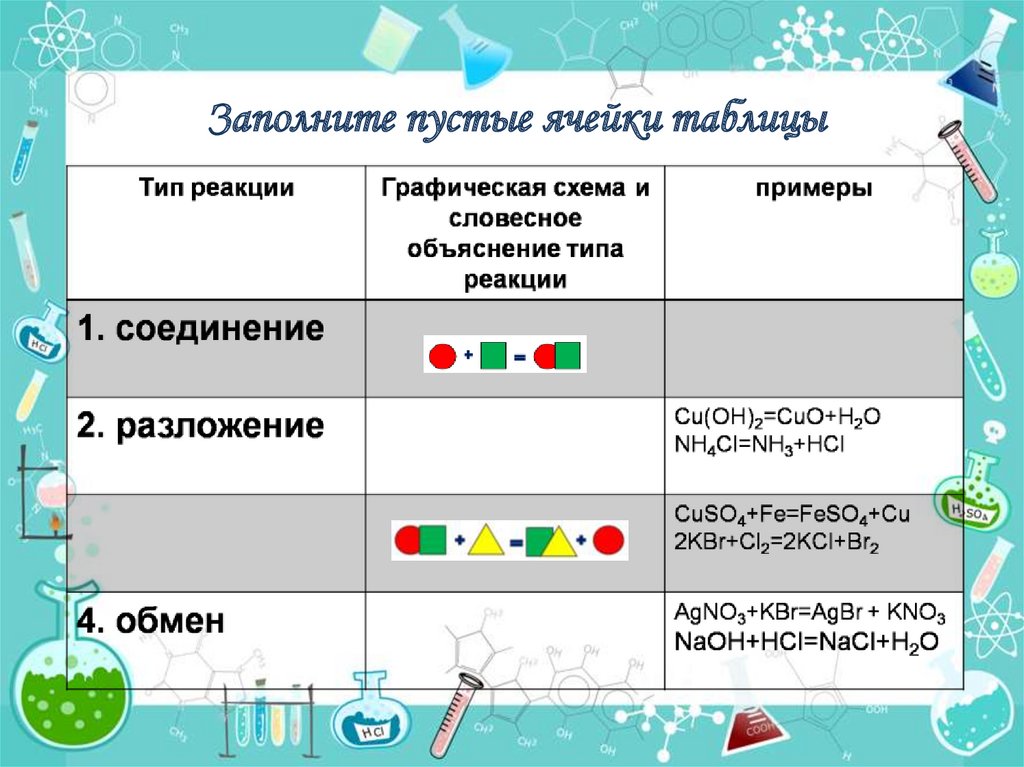
Заполните пустые ячейки таблицы15.
Интересное о важном…Жилец из квартиры №26 решил помочь
освободиться жильцу из квартиры №29 из его
хлорида, но сам попал в западню. Почему?
Напишите уравнение реакции, определите тип
реакции, расставьте коэффициенты.
16.
Царь зовет к себе Стрельца -удалого молодца, идает ему поручение государственного значения:
«Чтоб я стал опять богат, нужен мне алюминия
сульфид. Ночь даю тебе подумать, утром буду
ждать доклад. Не сможешь – кого винить?
Должен я тебя казнить. Запиши себе название,
чтоб со страху не забыть».
Напишите в тетради формулу сульфида
алюминия, уравнения реакций его получения,
укажите тип реакций.
17.
Домашнее задание§16,записи в тетради
письменно
задание №6
18.
Допишите уравнения реакций, расставьте коэффициенты,определите тип реакции.
Уравнение реакции
HNO3+Mg(OH)2→
CuCl2+Fe→
Ba+O2→
CH4→
H2SO4+NaOH→
Тип реакции


















 Химия
Химия








