Похожие презентации:
Типы химических реакций
1. Тема урока: «Типы химических реакций» Учитель: Лисенкова Елена Петровна
Школа ЭпиграфТема урока:
«Типы химических
реакций»
Учитель: Лисенкова Елена
Петровна
2. Установи соответствие
3. Сравни и оцени
Физические явленияХимические явления
4. Классификация реакций
по числу и составу исходных веществ и продуктов реакцииреакция соединения
реакция разложения
реакция замещения
реакция обмена
по тепловому эффекту
экзотермическая реакция
эндотермическая реакция
5. По числу и составу исходных веществ и продуктов реакции
Реакция соединения – реакция, в ходе, которой изнескольких простых и сложных веществ образуется одно
более сложное вещество.
Взаимодействие оксида кальция с водой
CaO + H2O = Ca(OH)2
Взаимодействие оксида серы (IV) с водой
SO2 + H2O = H2SO3
6. Реакция разложения
Реакция разложения – реакция, в которой из одногоисходного вещества образуется несколько новых веществ.
Электролиз воды
2H2O = 2H2 + O2
Разложение нитрата калия
2KNO3 = 2KNO2 + O2
Разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2
7. Реакция замещения
Реакция замещения – реакция между простыми сложным веществами, в результате которой
атомы простого вещества замещают атомы
одного из элементов сложного вещества.
Взаимодействие цинка с соляной кислотой
Zn + 2HCl = ZnCl2 + H2
Взаимодействие натрия с водой
2Na + 2H2O = 2NaOH + H2
Взаимодействие железа с раствором сульфата меди (II)
Fe + CuSO4 = FeSO4 + Cu↓
8. Реакция обмена
Реакция обмена – реакция, в результате которой двавещества обмениваются своими составными частями,
образуя два новых вещества.
Взаимодействие растворов сульфата меди (II) и гидроксида калия
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Взаимодействие раствора гидроксида натрия с азотной кислотой
NaOH + HNO3 = NaNO3 + H2O
Взаимодействие хлорида аммония с гидроксидом кальция
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
9. По тепловому эффекту химической реакции
Экзотермические реакции – реакции,протекающие с выделением энергии (тепла).
Горение фосфора в кислороде
4P + 5O2 = 2P2O5 + Q кДж
Горение этилового спирта
C2H5OH + 3O2 = 2CO2 + 3H2O + Q кДж
10. Эндотермическая реакция
Эндотермические реакции – реакции,протекающие с поглощением энергии (тепла).
Горение азота в атмосфере кислорода
N2 + O2 = 2NO – Q кДж
Разложение оксида ртути
2HgO = 2Hg↓ + O2↑ – Q кДж
Горение аммиака в кислороде
4NH3 + 5O2 = 4NO + 6H2O – Q кДж
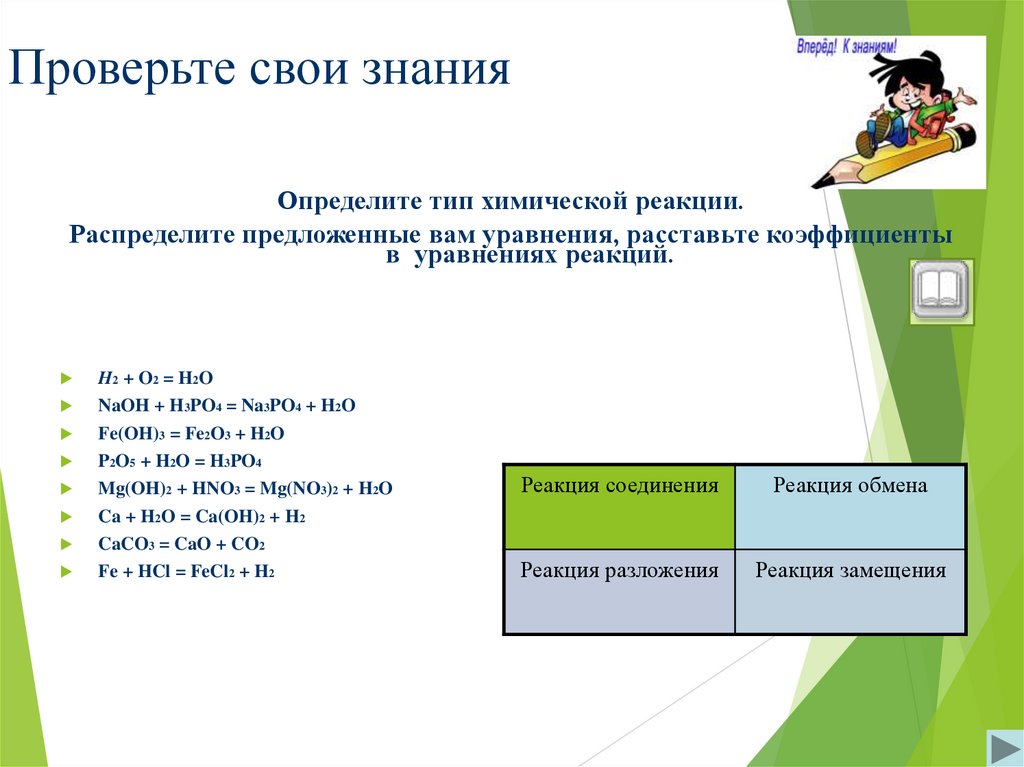
11. Проверьте свои знания
Определите тип химической реакции.Распределите предложенные вам уравнения, расставьте коэффициенты
в уравнениях реакций.
H2 + O2 = H2O
NaOH + H3PO4 = Na3PO4 + H2O
Fe(OH)3 = Fe2O3 + H2O
P2O5 + H2O = H3PO4
Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
Ca + H2O = Ca(OH)2 + H2
CaCO3 = CaO + CO2
Fe + HCl = FeCl2 + H2
Реакция соединения
Реакция обмена
Реакция разложения
Реакция замещения
12. Сравни и оцени
Реакция соединенияРеакция обмена
Реакция разложения
Реакция замещения
2H2 + O2 = 2H2O
3NaOH + H3PO4 = Na3PO4 + 3H2O
2Fe(OH)3 = Fe2O3 +3H2O
P2O5 + 3H2O = 2H3PO4
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
Ca + 2H2O = Ca(OH)2 + H2
CaCO3 = CaO + CO2
Fe +2HCl = FeCl2 + H2
0 ошибок - «5»
1-2 ошибки – «4»
3-4 ошибки – «3»
5 и более – «2»
13. Рефлексия
Сделай выводЧто было трудно
запомнить на уроке
1.
2.
3.
Что нового узнал
на уроке
1.
2.
3.
Что вызвало интерес
на уроке
1.
2.
3.
Подумай, кого из одноклассников ты бы отметил
за работу на уроке?
14. Домашнее задание
15. Глоссарий
Химическая реакция – процесс превращения исходных веществ в продукты реакций.Физические явления – явления, приводящие к изменению формы или агрегатного
состояния вещества, но не приводящие к образованию новых веществ.
Химические явления – явления, при которых одни вещества превращаются в другие,
отличающиеся от исходных составом и свойствами.
Электролиз – процесс, протекающий на электродах при пропускании электрического
тока.
Горение – физико-химический процесс, при котором превращение вещества
сопровождается интенсивным выделением энергии (тепла).
Коэффициенты – оказывают количество молекул данного вещества.
Индексы – показывают количество атомов элемента в веществе.
Уравнения реакций – условная запись химической реакции
посредством химических формул и математических знаков.
16. Список литературы
Рудзитис Г. Е. Химия. Неорганическая химия. 8класс : учеб, для общеобразоват. учреждений / Г. Е.
Рудзитис, Ф. Г. Фельдман. - 13-е изд. - М. :
Просвещение, 2011. - 176 с.: ил.
Брейгер, Л. М. Нестандартные уроки. Химия. 8, 10,
11 классы / Л. М. Брейгер. - Волгоград : Учитель,
2004
http://www.nachalka.com/book/export/html/1325
http://www.youtube.com/watch?v=Le3Jxjx7ABs















 Химия
Химия








