Похожие презентации:
Реакции замещения
1.
Реакциизамещения
Реакции
соединения
Реакции
обмена
Реакции
разложения
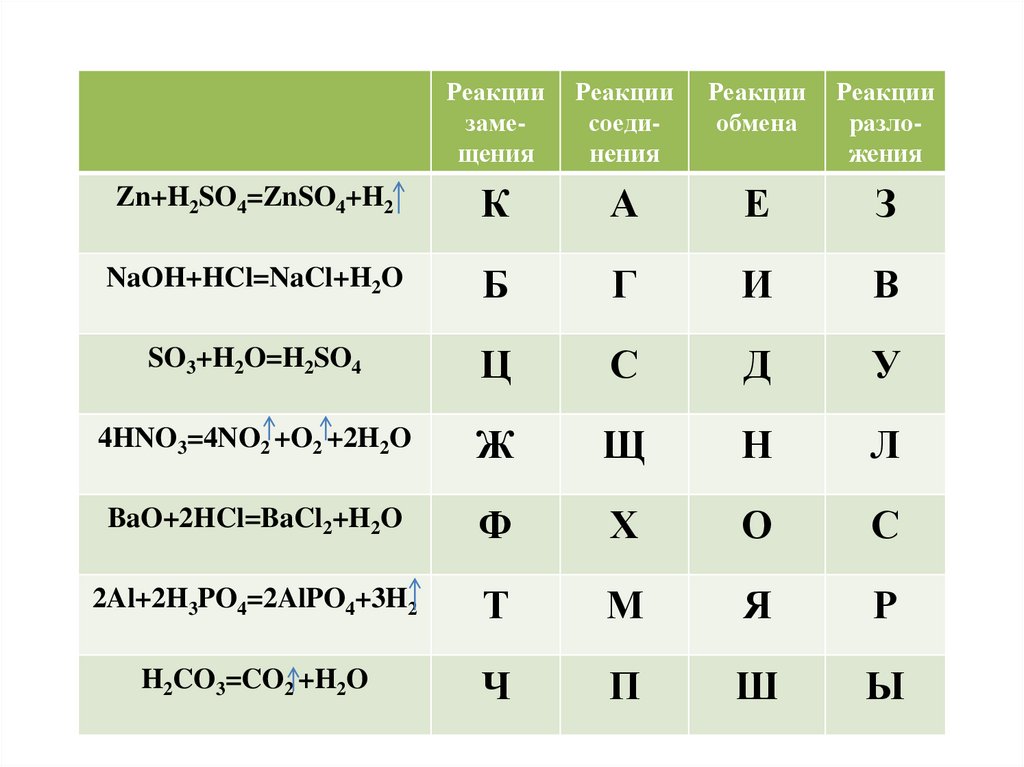
Zn+H2SO4=ZnSO4+H2
К
А
Е
З
NaOH+HCl=NaCl+H2O
Б
Г
И
В
SO3+H2O=H2SO4
Ц
С
Д
У
4HNO3=4NO2 +O2 +2H2O
Ж
Щ
Н
Л
BaO+2HCl=BaCl2+H2O
Ф
Х
О
С
2Al+2H3PO4=2AlPO4+3H2
Т
М
Я
Р
H2CO3=CO2 +H2O
Ч
П
Ш
Ы
2.
Реакциизамещения
Реакции
соединения
Реакции
обмена
Реакции
разложения
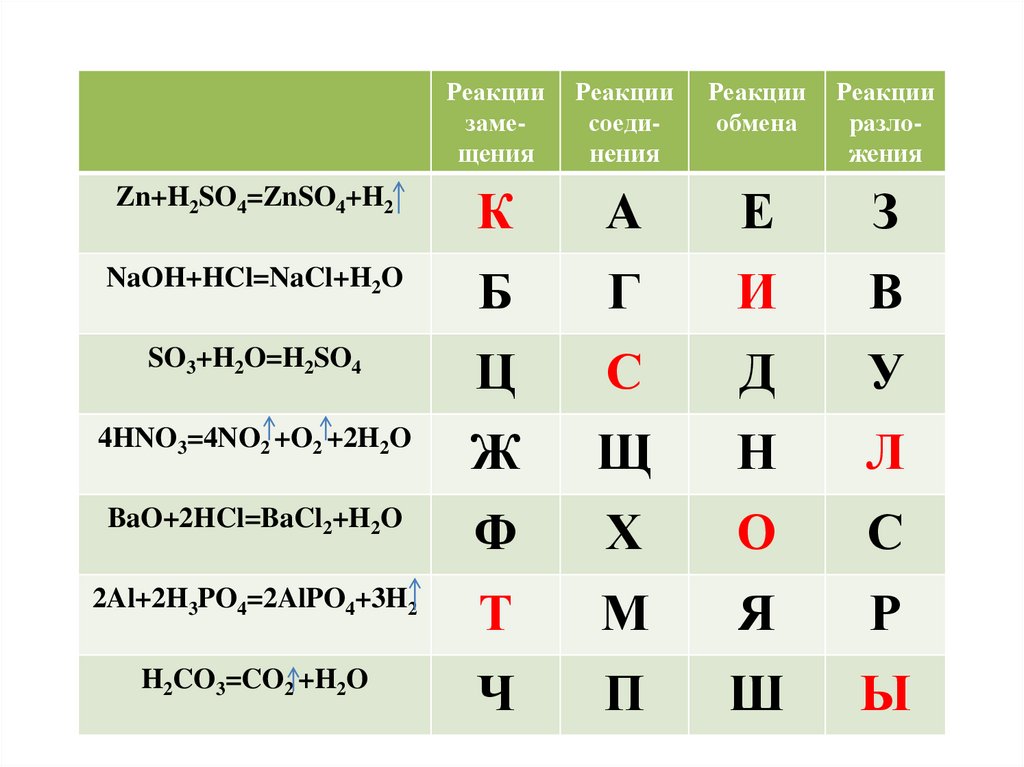
Zn+H2SO4=ZnSO4+H2
К
А
Е
З
NaOH+HCl=NaCl+H2O
Б
Г
И
В
SO3+H2O=H2SO4
Ц
С
Д
У
4HNO3=4NO2 +O2 +2H2O
Ж
Щ
Н
Л
BaO+2HCl=BaCl2+H2O
Ф
Х
О
С
2Al+2H3PO4=2AlPO4+3H2
Т
М
Я
Р
H2CO3=CO2 +H2O
Ч
П
Ш
Ы
3.
Тема урока: «Классификация кислот.Химические свойства кислот в свете
теории электролитической
диссоциации»
4.
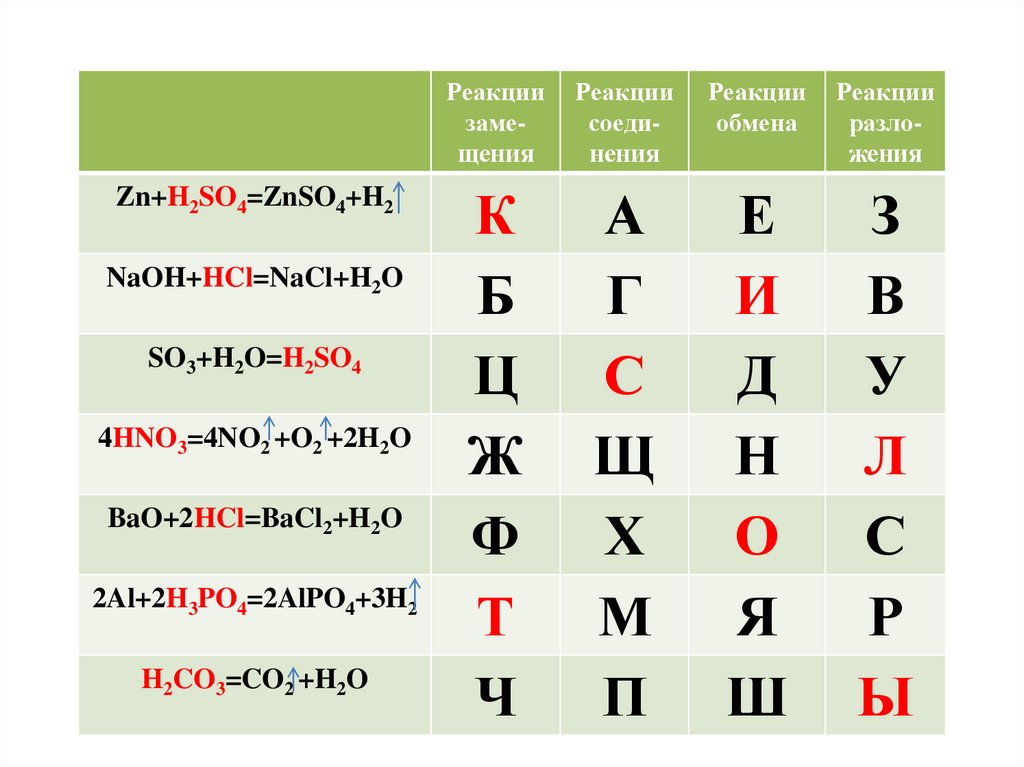
Zn+H2SO4=ZnSO4+H2NaOH+HCl=NaCl+H2O
SO3+H2O=H2SO4
4HNO3=4NO2 +O2 +2H2O
BaO+2HCl=BaCl2+H2O
2Al+2H3PO4=2AlPO4+3H2
H2CO3=CO2 +H2O
Реакции
замещения
Реакции
соединения
Реакции
обмена
Реакции
разложения
К
Б
Ц
Ж
Ф
Т
Ч
А
Г
С
Щ
Х
М
П
Е
И
Д
Н
О
Я
Ш
З
В
У
Л
С
Р
Ы
5.
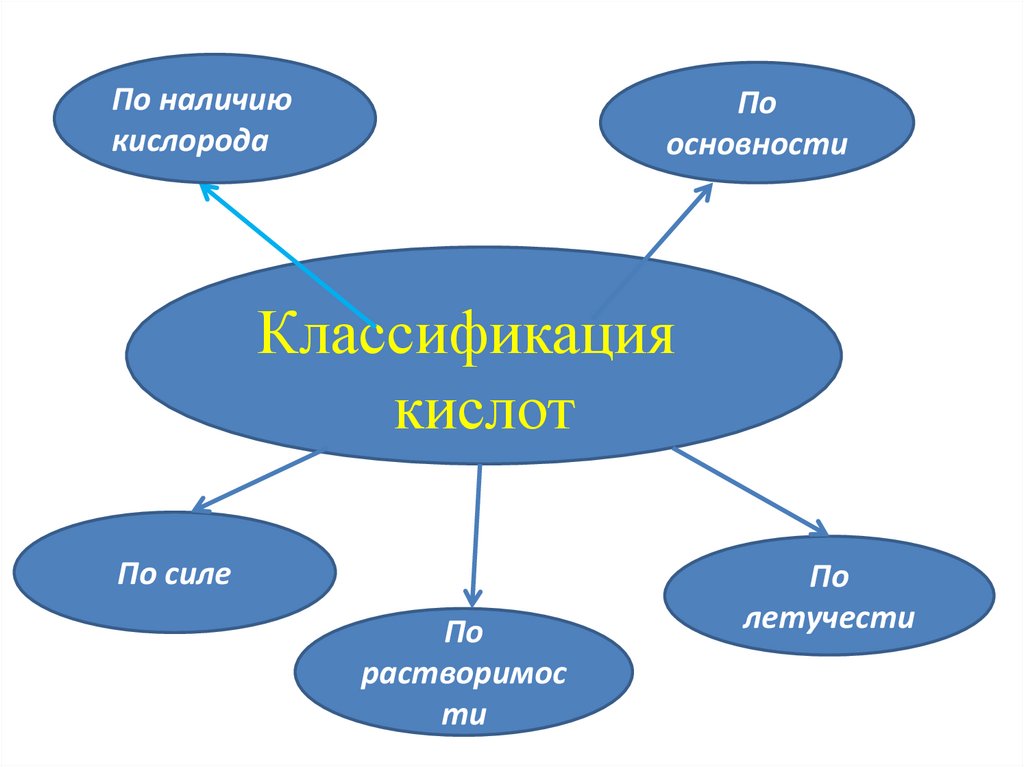
По наличиюкислорода
По
основности
Классификация
кислот
По силе
По
растворимос
ти
По
летучести
6.
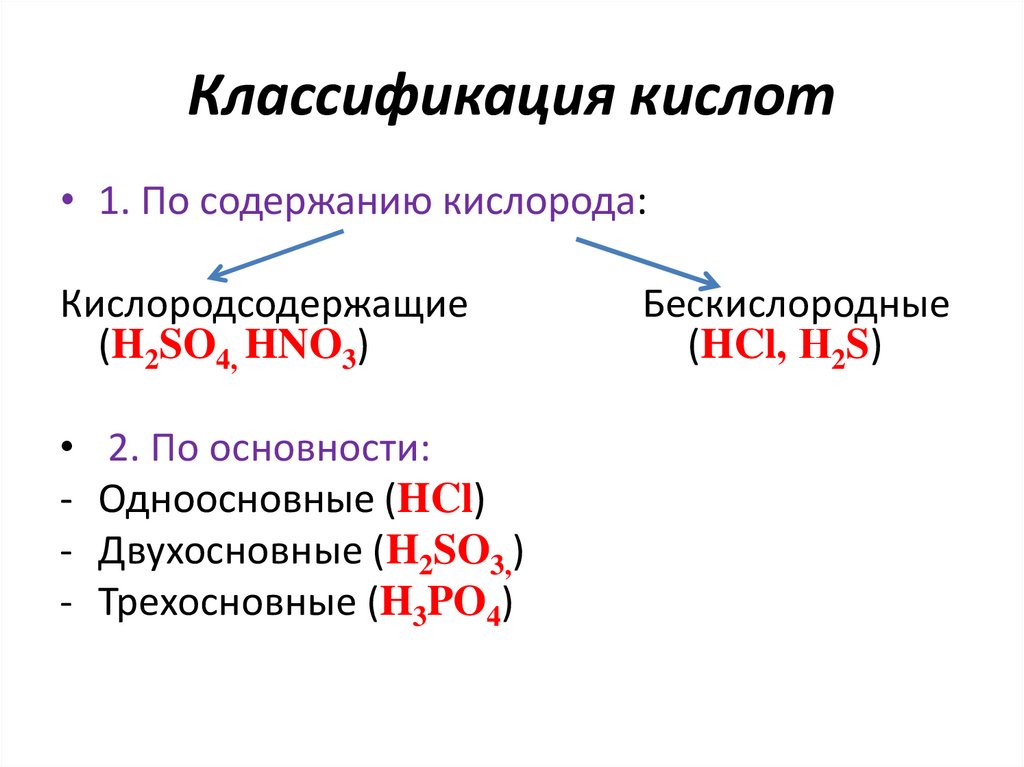
Классификация кислот• 1. По содержанию кислорода:
Кислородсодержащие
(H2SO4, HNO3)
-
2. По основности:
Одноосновные (HCl)
Двухосновные (H2SO3,)
Трехосновные (H3PO4)
Бескислородные
(HCl, Н2S)
7.
• 3. По силе кислот:- сильные (H2SO4, HNO3, HCl)
- средние (H3PO4)
- слабые (H2SiO3, H2СO3, H2S, H2SO3, HNO2 )
• 4. По растворимости
- Нерастворимые (H2SiO3)
- Растворимые (все остальные)
8.
• 5. По летучести9.
Химические свойства кислот• 1) Взаимодействие с активными металлами
Кислота+ Металл= Соль+Н2О
10.
• 2) Взаимодействие с основными оксидамиКислота +Основный оксид = Соль + Н2О





 Химия
Химия








