Похожие презентации:
Обоснованный отбор содержания образовательного процесса при планировании урока
1.
Тема: «Обоснованный отборсодержания образовательного процесса при
планировании урока» .
Содоклад на педсовете 29.12.2017г.
Учитель химии: Козленко А.В.
2.
Моделируя урок необходимо:• Отобрать учебный материал, т.е. определить его
объём, содержание, установить связь с ранее
изученными темами, рассмотреть дополнительный
материал для дифференцированной работы и
продумать содержание, объём и форму домашнего
задания.
• Задания должны формировать у школьников навыки
самостоятельного учебного труда, умения
анализировать, обобщать, сравнивать, делать
выводы, развивать речь, память, воображение,
кругозор. Вопросы должны быть проблемные и
информационные, связанные с жизнью.
3.
Типы уроков.1. Урок изучения нового или «открытия» нового знания.
Это традиционный (комбинированный), лекция, беседа, самостоятельная работа,
экскурсия, исследовательская работа, практикум, эксперимент.
Работа ведётся с опорой на изученный ранее материал, с активным включением учащихся,
работавших по опережающим заданиям.
2. Урок закрепления и систематизации знаний, формирование умений и навыков.
Это: практикум, лабораторная работа, собеседование, консультация.
Имеет целью выработку умений по применению знаний.
При планировании урока данного типа вместе с повторением целесообразно организовать
- систематизацию знаний и контроль.
3. Урок комплексного применения знаний.
Это: практикум, лабораторная работа, семинар.
Имеет целью выработку умений самостоятельного применять знания в комплексе, в новых
условиях.
4. Урок обобщения и систематизации знаний.
Это: семинар, конференция, круглый стол.
Имеет целью обобщение знаний в систему.
5. Урок контроля и оценки, коррекции знаний.
Этот вид комбинированного урока: урок самостоятельной, контрольной работы,
практикума, зачётного урока, тестовой проверки, где ученики не только применяют
полученные знания, но и обобщают, закрепляют их. Имеют целью определить уровень
овладения знаниями, умениями и навыками.
4.
Использование ИКТ• Видео-фильмы, видео-опыты, видео-фрагменты
видео-уроков, виртуальные экскурсии на
химические заводы и производства.
• Мультимедийное пособие «Наглядная химия».
• Учебные электронные пособия, книги, задачи с
алгоритмами решения, презентации, лекции,
тестирование.
• Составлять таблицы, графики, схемы, диаграммы,
алгоритмы и т.д.
5.
Формулировки заданий:Проанализируйте
Докажите (объясните)
Сравните
Выразите символом
Создайте схему или модель
Продолжите
Обобщите (сделайте вывод)
Выберите решение или способ решения
Исследуйте
Оцените
Придумайте и т.д.
6.
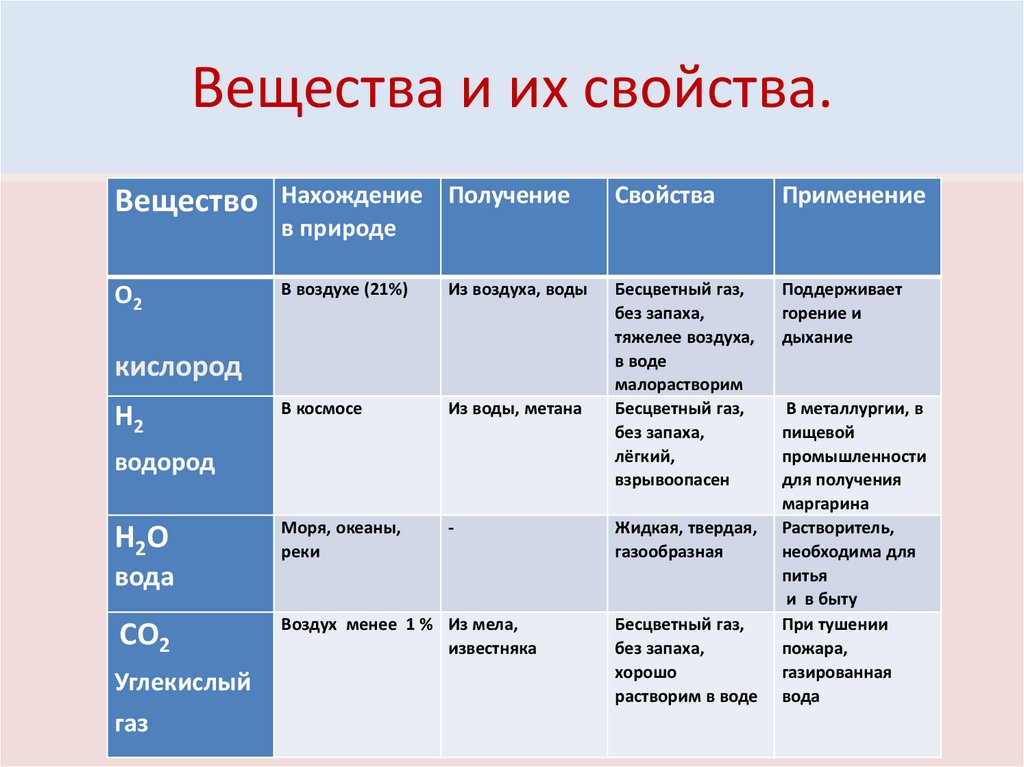
Вещества и их свойства.Вещество
Нахождение Получение
в природе
Свойства
Применение
О2
В воздухе (21%)
Из воздуха, воды
Поддерживает
горение и
дыхание
В космосе
Из воды, метана
Бесцветный газ,
без запаха,
тяжелее воздуха,
в воде
малорастворим
Бесцветный газ,
без запаха,
лёгкий,
взрывоопасен
Моря, океаны,
реки
-
кислород
Н2
водород
Н2О
Жидкая, твердая,
газообразная
вода
СО2
Углекислый
газ
Воздух менее 1 % Из мела,
известняка
Бесцветный газ,
без запаха,
хорошо
растворим в воде
В металлургии, в
пищевой
промышленности
для получения
маргарина
Растворитель,
необходима для
питья
и в быту
При тушении
пожара,
газированная
вода
7.
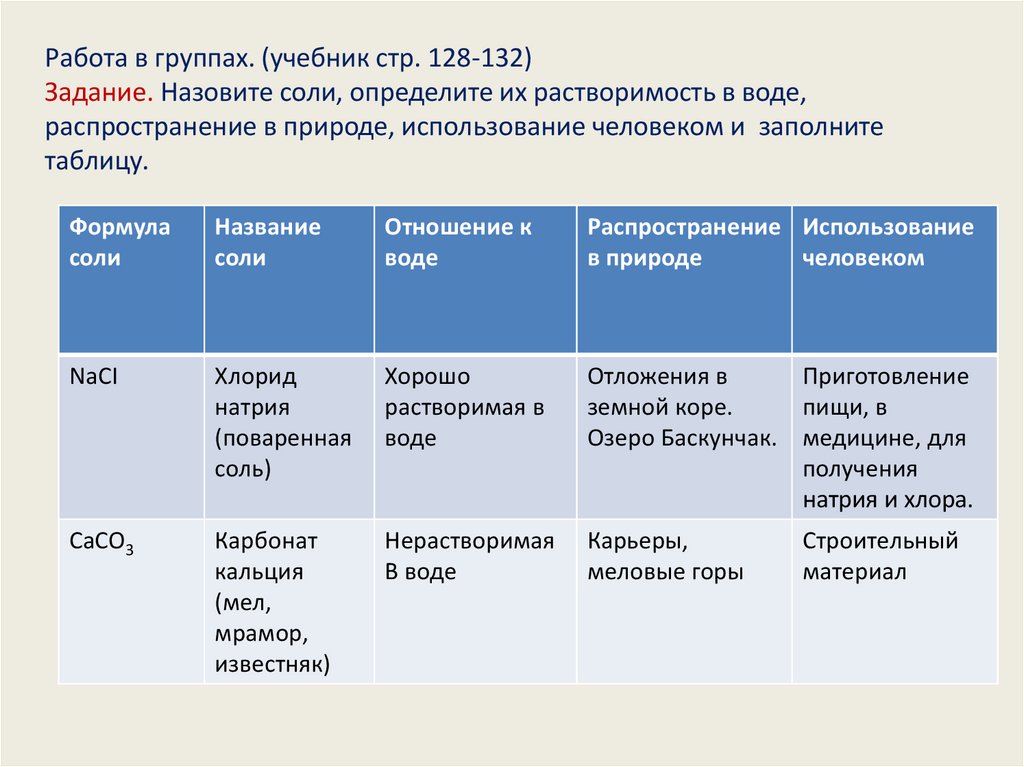
Работа в группах. (учебник стр. 128-132)Задание. Назовите соли, определите их растворимость в воде,
распространение в природе, использование человеком и заполните
таблицу.
Формула
соли
Название
соли
Отношение к
воде
Распространение Использование
в природе
человеком
NаCI
Хлорид
натрия
(поваренная
соль)
Хорошо
растворимая в
воде
Отложения в
Приготовление
земной коре.
пищи, в
Озеро Баскунчак. медицине, для
получения
натрия и хлора.
СаСО3
Карбонат
кальция
(мел,
мрамор,
известняк)
Нерастворимая
В воде
Карьеры,
меловые горы
Строительный
материал
8.
Формулы необходимые для решения задач.ν (моль) – количество
ν = m/М ;
ν = V/Vm ; ν = N/NA ;
ν = cVp
m (г) – масса
m=νM;
mp = Vp ; mсм = mв-ва/ w ; mв-ва = w mсм
V (л) – объем
V = ν Vm ;
Vm = 22,4 л/моль;
N (атомов, молекул) – число частиц
М (г/моль) – молярная масса
N = ν NA
Vp = m/p
NA = 6 ∙ 1023
М = m/ν ; M = pVm ; M = Dгаза Мгаза
w (%) – массовая доля w = mв-ва/mсм · 100%
с (моль/л) – молярная концентрация
с = ν/Vp
9.
8 класс. Относительная молекулярная масса. Массовая доля элемента.Из букв правильных ответов получится фамилия шведского химика, который жил в 18 веке и первым
получил перманганат калия KMnO4 (марганцовку), глицерин, сероводород, хлор.
1. Относительная молекулярная масса поваренной соли (NaCl) равна
а) 28
к) 59
ш) 58,5
я) 46,5
2. Относительная молекулярная масса мела (СаСО3) равна
е) 100
о) 68
у) 50
и) 80
3. Относительная молекулярная масса кальцинированной соды, молекула которой состоит из двух атомов
натрия, одного атома углерода и трех атомов кислорода, равна
а) 74
е) 106
п) 25
с) 82
4. Массовая доля кислорода в натриевой селитре, формула которой NaNO3, равна
л) 56,5 %
р) 18,8 %
н) 30,8 %
з) 57,1 %
5. Массовая доля углерода в глюкозе, формула которой состоит из 6 атомов углерода, 12 атомов водорода и 6
атомов кислорода, равна
и) 42 %
а) 6,7 %
о) 35,3 %
е) 40 %
Дополнительное задание.
1*. Относительная молекулярная масса ацетона равна 58, его формула Х3Н6О
Как называется элемент Х?
2*. В соединении X2S3 массовая доля серы равна 48 %. Определите и назовите элемент Х.
10.
Типы заданий.1. Задания, требующие воспроизведение знаний.
К ним относятся задания по узнаванию, воспроизведению
отдельных фактов, понятий, правил, схем, опорных конспектов.
Начинаются задания подобного типа со слов: какая из, что
это, как называется, дайте определение и т.д.
2. Задания, требующие применения мыслительных операций.
Эти задания по выявлению, перечислению, описанию фактов
(измерение, взвешивание, простые исчисления, перечень и т.д.).
Данная группа заданий начинается со слов: опишите, из чего
состоит; составьте перечень; опишите, как протекает; как
действует при; почему; каким способом; что является причиной
и т.д.
11.
Задача. Стр. 149 №3(Химия 8 класс, О.С. Габриелян
• Рассчитайте количество вещества спирта,
который содержится в 500 г водки (40 % ный раствор спирта). Не забудьте, что
количество вещества измеряется в молях.
12.
Продукты разложения:• Продуктами распада аспартама, являются
аминокислоты - аспарагиновая и фенилаланин, а
также токсичное вещество – метанол.
•Но при нагревании выше 30 градусов по Цельсию
метанол превращается в формальдегид.
•Эти вещества: метиловый спирт и формальдегид –
сильнейшие яды!
13.
Газированные напитки,жевательные резинки и их состав:
Специально подготовленная вода, двуокись
углерода Е-290, регулятор кислотности Е - 330,
подсластитель Е-951, консервант Е-211,
краситель, ароматизатор.
•содержат подсластитель аспартам- Е951!!!
14.
Анкетирование:■ Покупаете, ли Вы газированные напитки?
■ Обращаете, ли Вы внимание на состав
продукта, перед тем как его купить?
■ Если Вы приобретаете жевательные
резинки и прохладительные газированные
напитки, то каким отдаете предпочтение?
15.
Вопрос 1. Покупаете ли Выгазированные напитки?
3%
Да
Нет
97%
16.
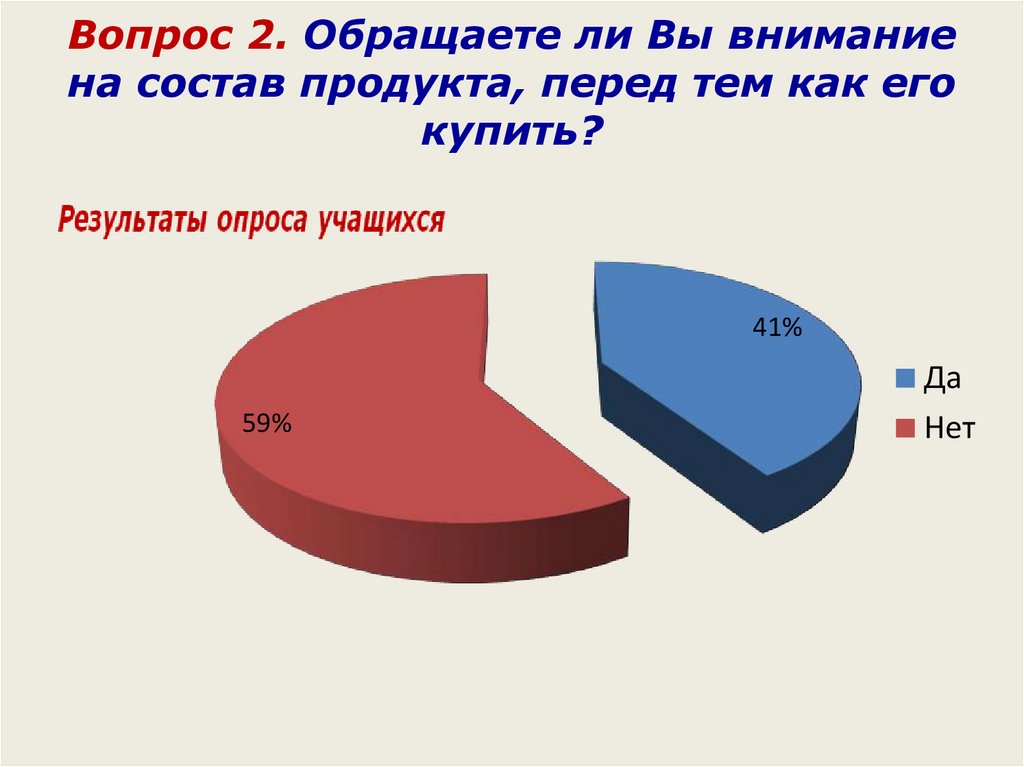
Вопрос 2. Обращаете ли Вы вниманиена состав продукта, перед тем как его
купить?
41%
59%
Да
Нет
17.
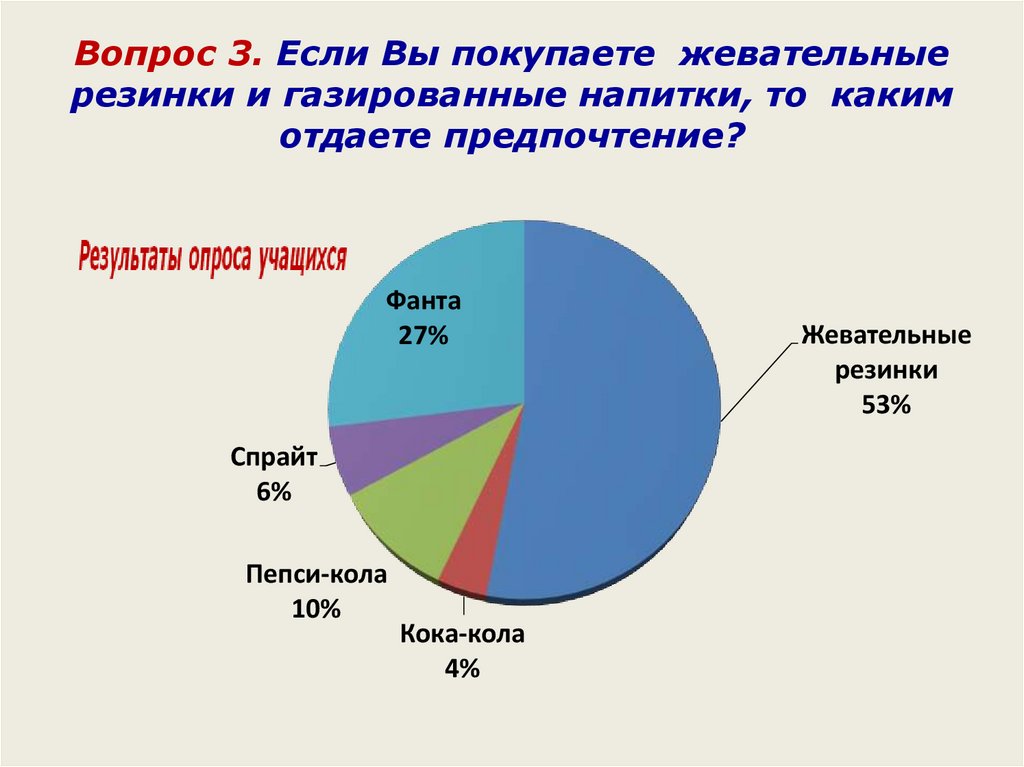
Вопрос 3. Если Вы покупаете жевательныерезинки и газированные напитки, то каким
отдаете предпочтение?
Фанта
27%
Спрайт
6%
Пепси-кола
10%
Кока-кола
4%
Жевательные
резинки
53%
18.
Анализ газированного напитка напродукты распада аспартама.
■реакция серебряного зеркала
H- COH + 2[Ag(NH3)2]OH→H- COONH4+ 2 Ag ↓ +3NH3 ↑ + H2O
формальдегид
серебро














 Образование
Образование








