Похожие презентации:
Строение атома и периодическая система Д.И. Менделеева
1.
Раздел 1«Строение атома и вещества»
Печенкина Екатерина Сергеевна
кандидат химических наук,
Учитель химии
2.
Разбор задания первой части № 1Строение электронных оболочек
атомов элементов первых четырех
периодов: s-, p-, d-элементы
3.
Основные элементы содержания:атом, атомное ядро, протон, нейтрон,
электрон, атомная орбиталь, энергетический
уровень,
энергетический
подуровень,
электронная конфигурация атома, внешние и
валентные
электроны,
основное
и
возбужденное состояние атома.
4.
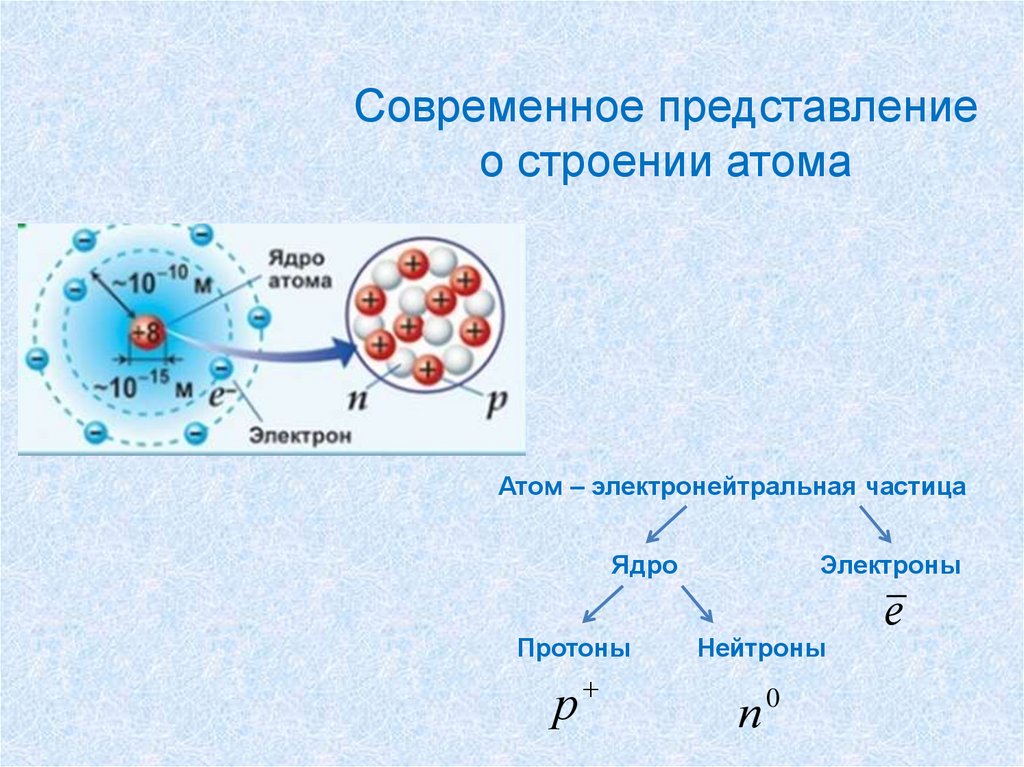
Современное представлениео строении атома
Атом – электронейтральная частица
Ядро
Протоны
р
Электроны
Нейтроны
п0
е
5.
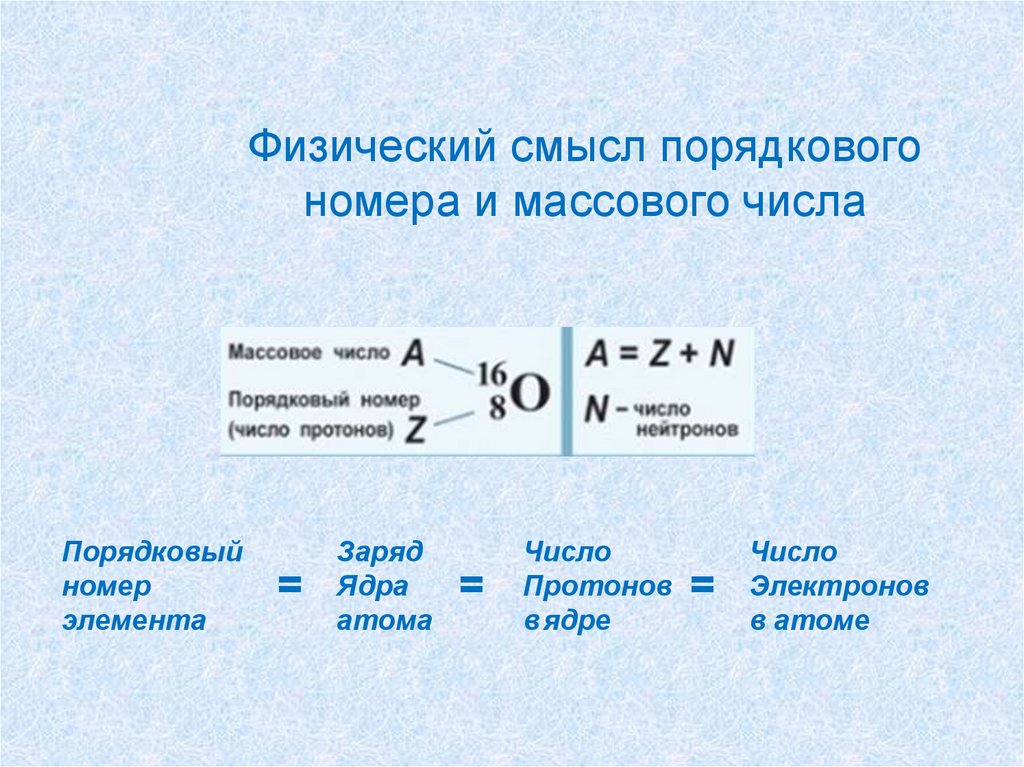
Физический смысл порядковогономера и массового числа
Порядковый
номер
элемента
=
Заряд
Ядра
атома
=
Число
Протонов
в ядре
=
Число
Электронов
в атоме
6.
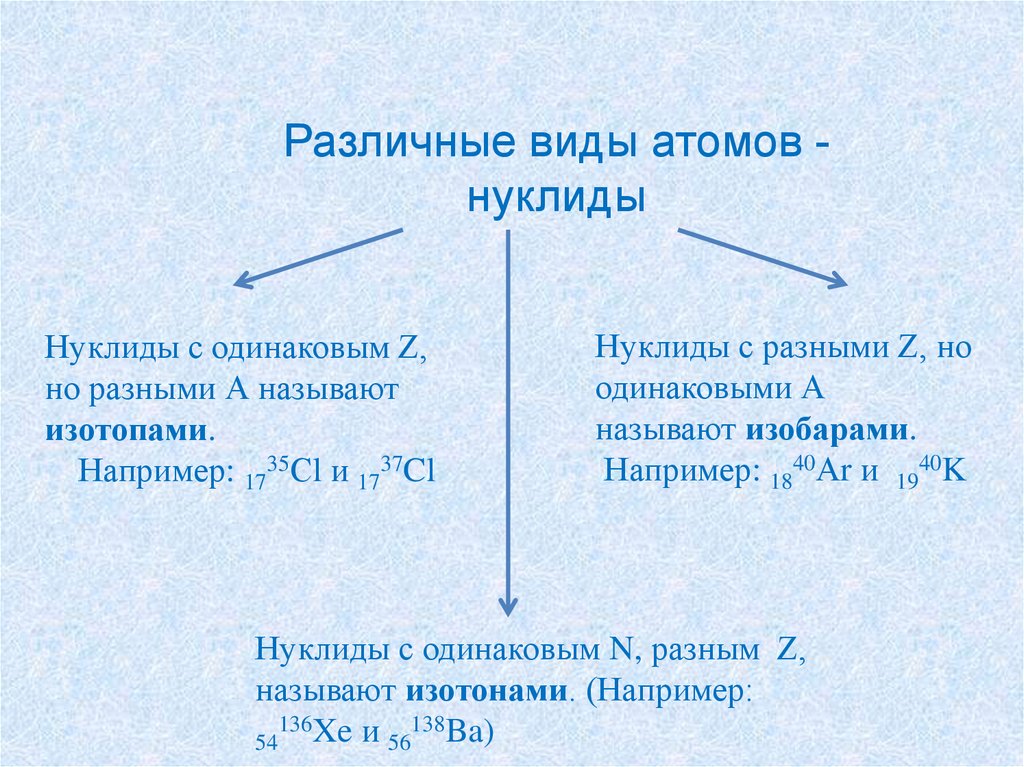
Различные виды атомов нуклидыНуклиды с одинаковым Z,
но разными А называют
изотопами.
Например: 1735Сl и 1737Cl
Нуклиды с разными Z, но
одинаковыми А
называют изобарами.
Например: 1840Аr и 1940K
Нуклиды с одинаковым N, разным Z,
называют изотонами. (Например:
136Xe и 138Ba)
54
56
7.
Изотопы(на примере водорода)
Разновидности атомов
одного и того же
химического элемента,
имеющие одинаковое
число протонов в ядре,
но разную массу,
называют изотопами
8.
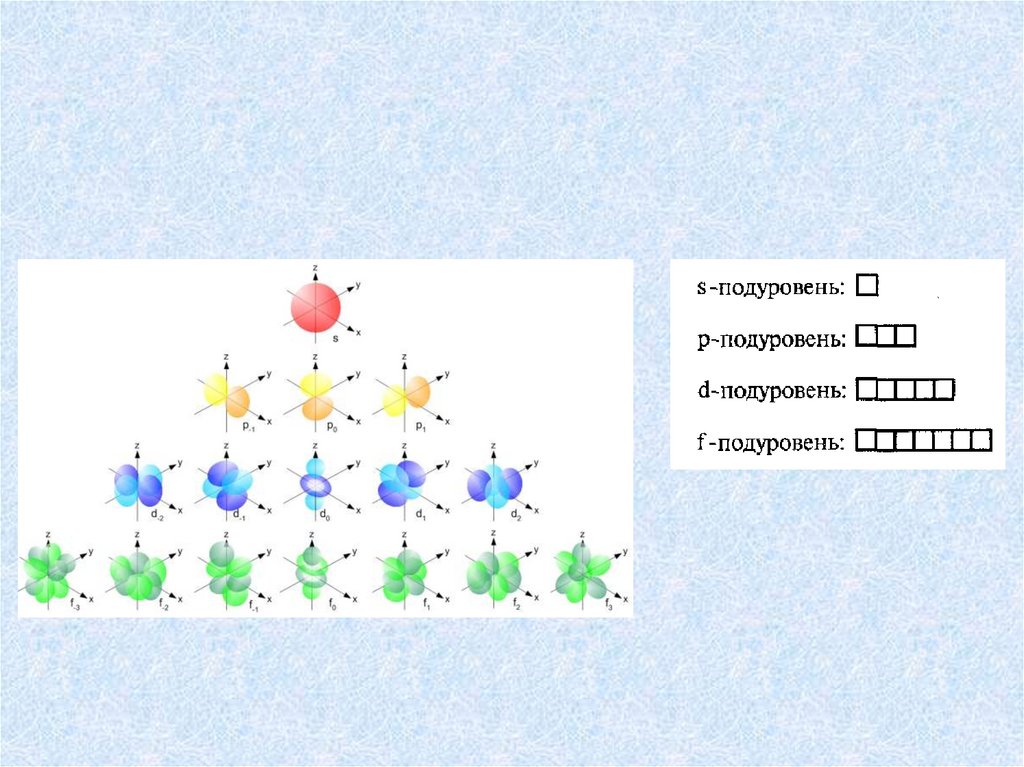
Определения• Пространство вокруг ядра, в котором наиболее
вероятно нахождение электронов называется
орбиталью
• Электроны, движущиеся в орбиталях близкого
размера и имеющие близкие значения энергии,
образуют один энергетический уровень
9.
10.
Энергетические уровнии подуровни в атоме
11.
Принцип Паули:в атоме не может быть двух электронов с одинаковым
набором всех четырех квантовых чисел
Максимальное число электронов на энергетических уровнях
Уровень
Подуровни
К (первый)
1s
2s
2р
3s
3р
3d
L (второй)
М (третий)
Максимальное
Максимальное
число электронов число электронов
на подуровне
на уровне
2
2
2
8
6
2
6
18
10
12.
Принцип минимума энергии:основное (устойчивое) состояние атома - это
такое состояние, которое характеризуется
минимальной энергией
Электроны заполняют орбитали в порядке
увеличения их энергии
13.
14.
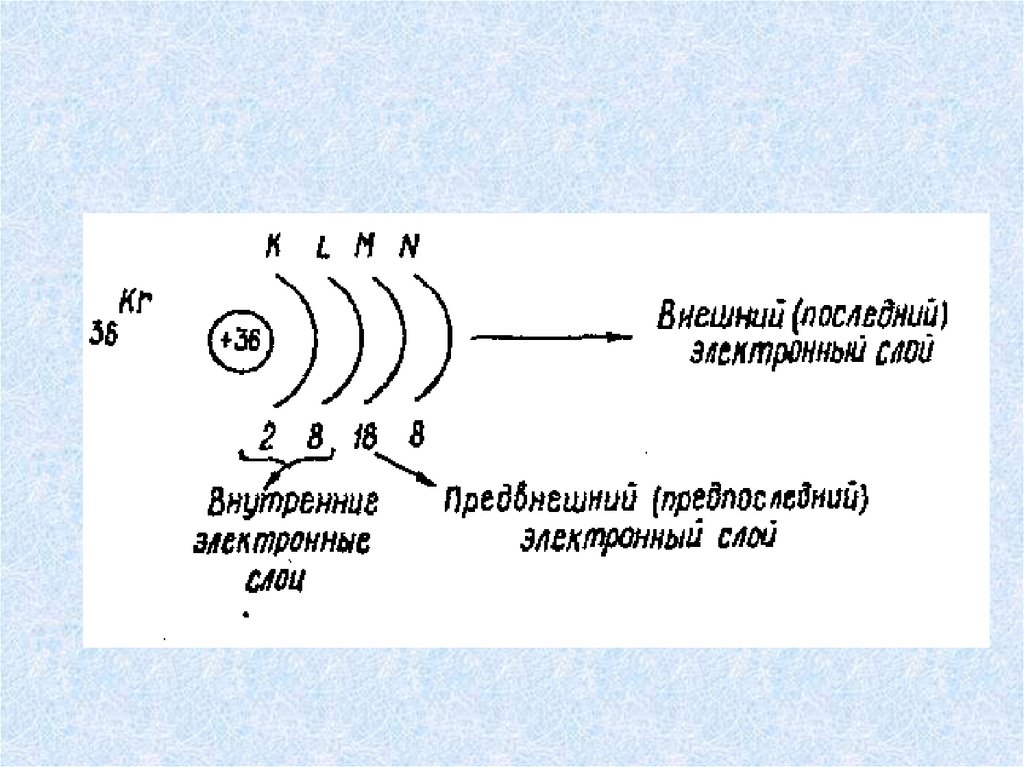
Электроны, находящиеся на последнем энергетическом уровне,называются внешними.
Электроны, которые могут принимать участие в образовании
химических связей, называются валентными.
Для элементов главных подгрупп валентными являются внешние sи р-электроны:
22s22p6 3s23p6 - валентные электроны.
Cl
1s
17
Для элементов побочных подгрупп валентными являются
внешние s-электроны и предвнешние d-электроны:
22s22p6 3s23p6 4s13d5 - валентные
Cr
1s
24
электроны
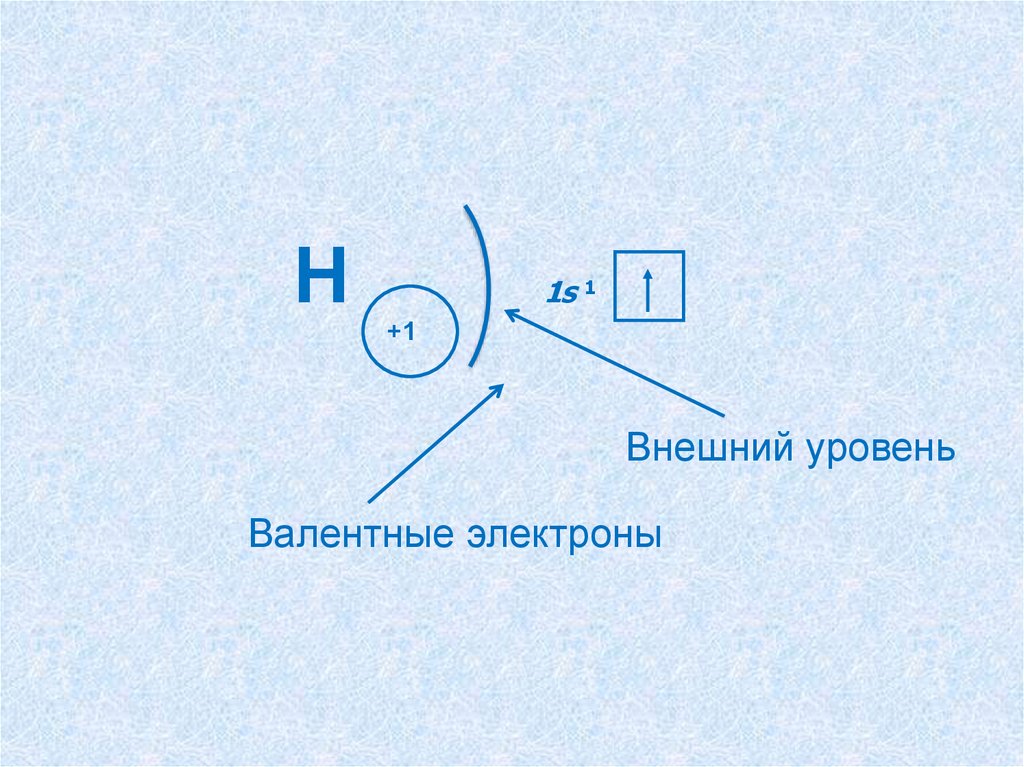
15.
Н1s 1
+1
Внешний уровень
Валентные электроны
16.
В зависимости от характера заполнения электронами,орбитали делятся на:
17.
В зависимости от характера заполнения электронами,орбитали делятся на:
Вакантные - без электронов
18.
В зависимости от характера заполнения электронами,орбитали делятся на:
Вакантные - без электронов
Полузаселенные - один электрон
19.
В зависимости от характера заполнения электронами,орбитали делятся на:
Вакантные - без электронов
Полузаселенные - один электрон
Полностью заселенные - два электрона
20.
В зависимости от характера заполнения электронами,орбитали делятся на:
Вакантные - без электронов
Полузаселенные - один электрон
Полностью заселенные - два электрона
Два электрона, которые находятся на одной орбитали и
имеют противоположные спины, называются спаренными
21.
Правило Хунда:на одном подуровне электроны располагаются так, чтобы
абсолютное значение суммарного спина было максимальным
Это соответствует устойчивому состоянию атома
22.
Правило Хунда:на одном подуровне электроны располагаются так, чтобы
абсолютное значение суммарного спина было максимальным
Это соответствует устойчивому состоянию атома
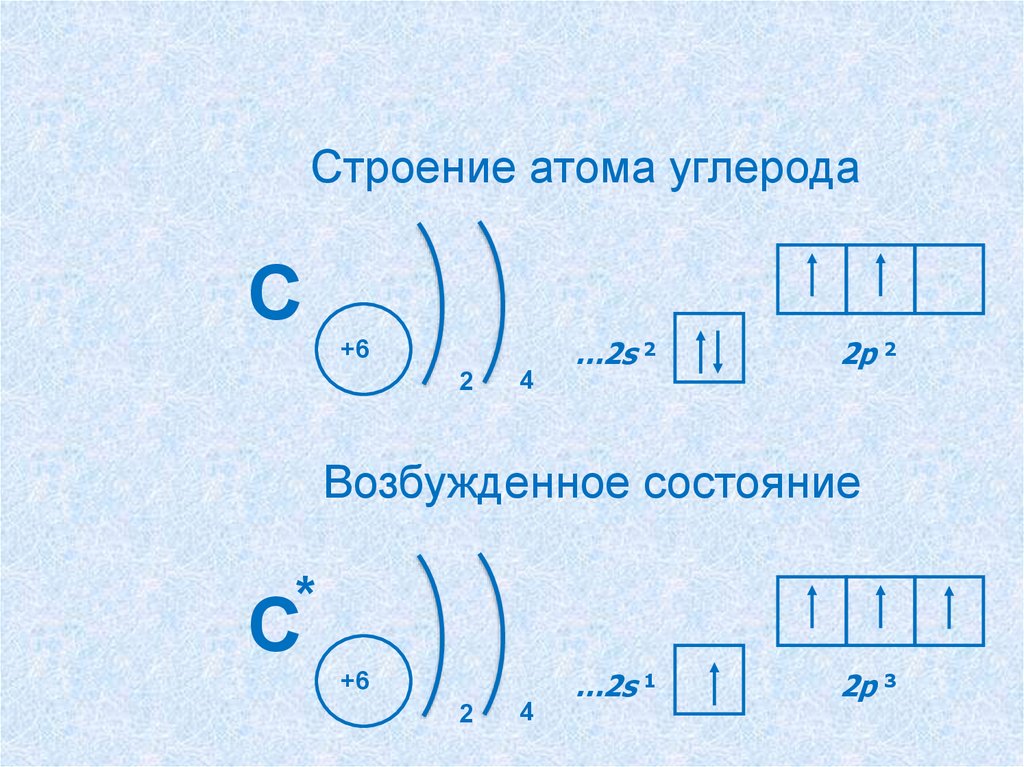
23.
Строение атома углеродаС
+6
2
4
…2s 2
2p 2
Возбужденное состояние
*
С
+6
2
4
…2s 1
2p 3
24.
Строение атома азотаN
+7
2
5
…2s 2
2p 3
Строение атома кислорода
O
+8
2
6
…2s 2
2p 2
25.
Строение атома серыS
+16
2
8
4
3d 0
3p 4
3s 2
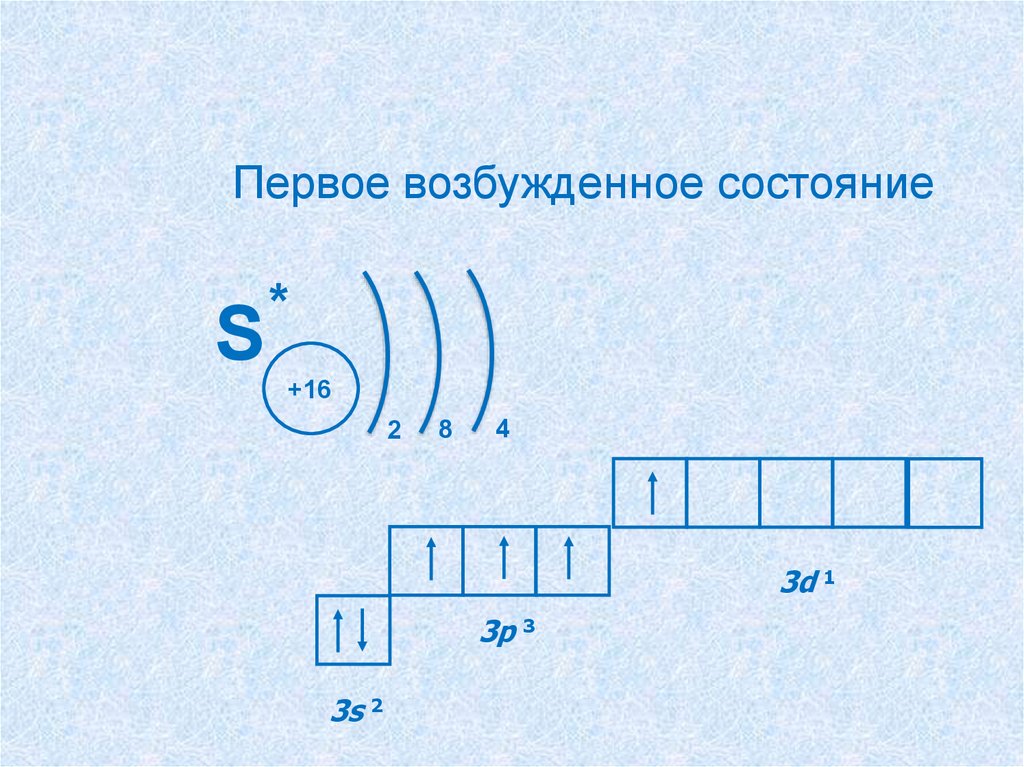
26.
Первое возбужденное состояниеS
*
+16
2
8
4
3d 1
3p 3
3s 2
27.
Второе возбужденное состояниеS
**
+16
2
8
4
3d 2
3p 3
3s 1
28.
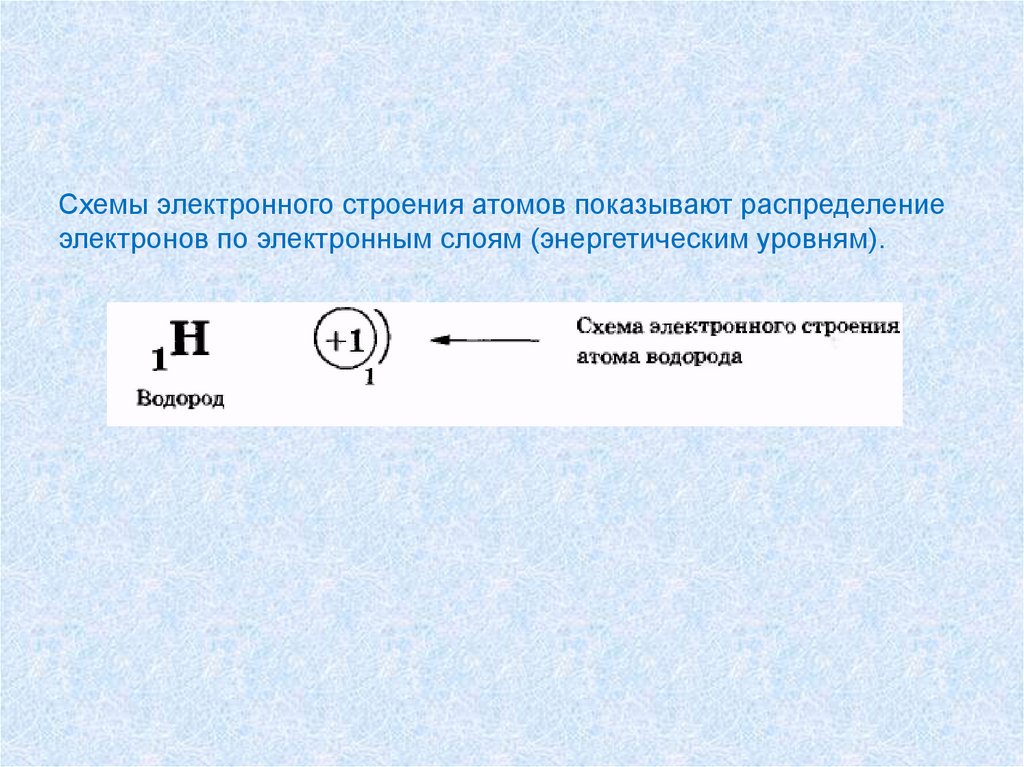
Схемы электронного строения атомов показывают распределениеэлектронов по электронным слоям (энергетическим уровням).
29.
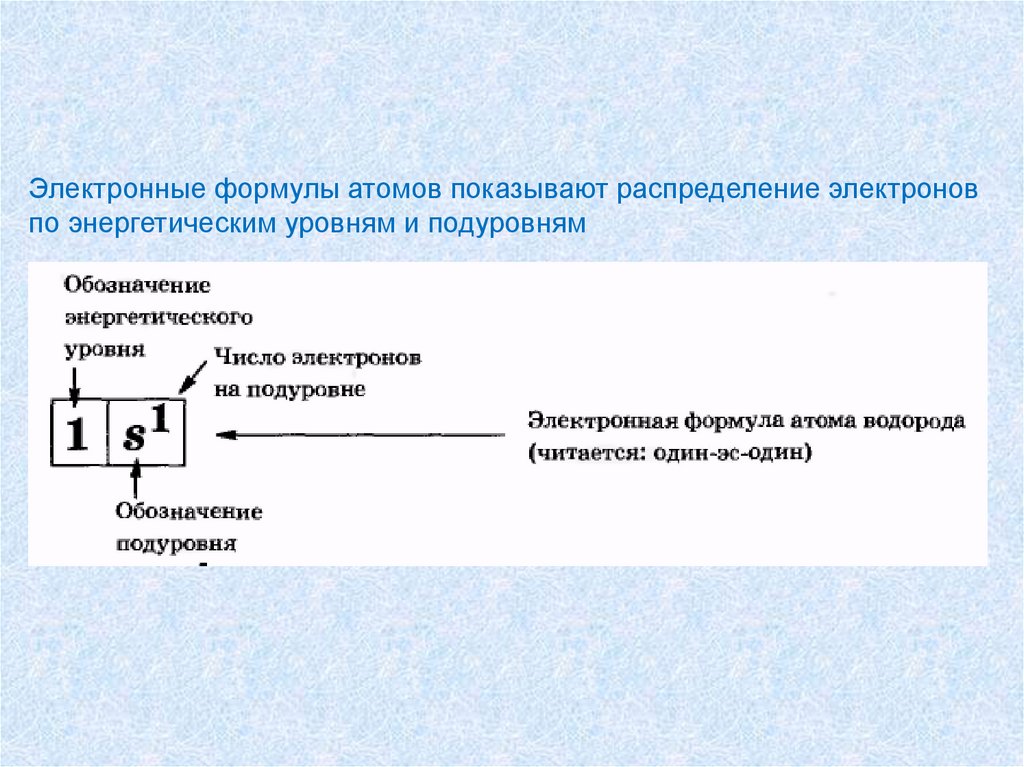
Электронные формулы атомов показывают распределение электроновпо энергетическим уровням и подуровням
30.
Графические электронные формулы атомов показываютраспределение электронов не только по уровням и подуровням, но и по
орбиталям
31.
Провал электронаCr
«Провал» электрона приводит к повышению устойчивости подуровней,
поэтому у хрома распределение электронов по уровням следующее: 2,
8,13,1
32.
Элементы делятся на семейства, в зависимости от того,какой подуровень у них заполняется последним
s-элементы - элементы главных подгрупп 1 и 2 групп
р-элементы - элементы главных подгрупп 3-8 групп
d-элементы - элементы побочных подгрупп
f-элементы - лантаноиды и актиноиды
33.
Разбор задания первой части № 2Закономерности изменения
химических свойств элементов и их
соединений по периодам и группам
(ПЗ и ПСХЭ)
34.
Основные элементы содержания:Периодический закон, Периодическая система
химических
элементов,
периодические
изменения в системе химических элементов,
атомный радиус, электроотрицательность,
35.
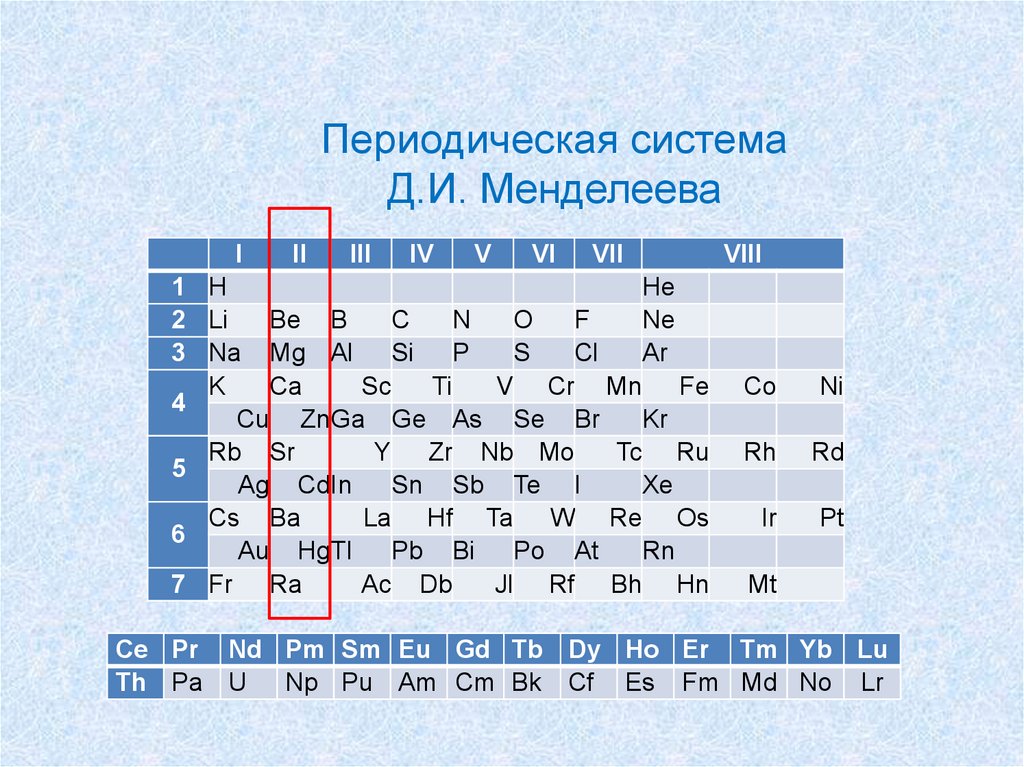
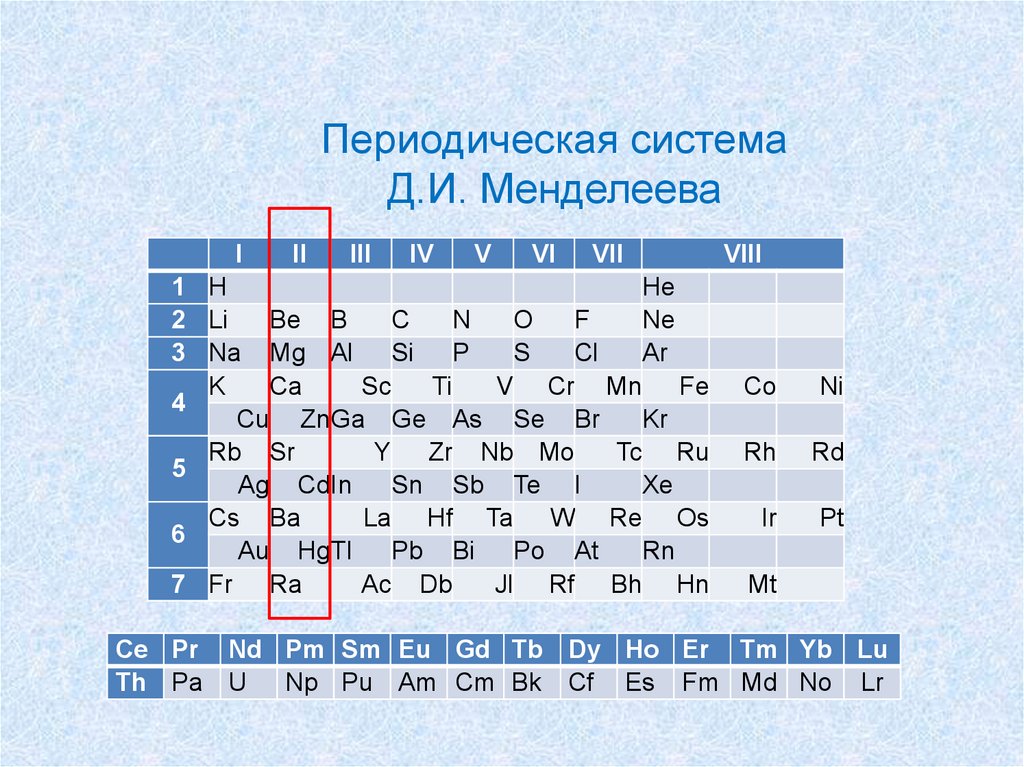
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
36.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
37.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
38.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
39.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
40.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
41.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
42.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
43.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
44.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
45.
Периодическая системаД.И. Менделеева
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
46.
Радиус атомаI
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
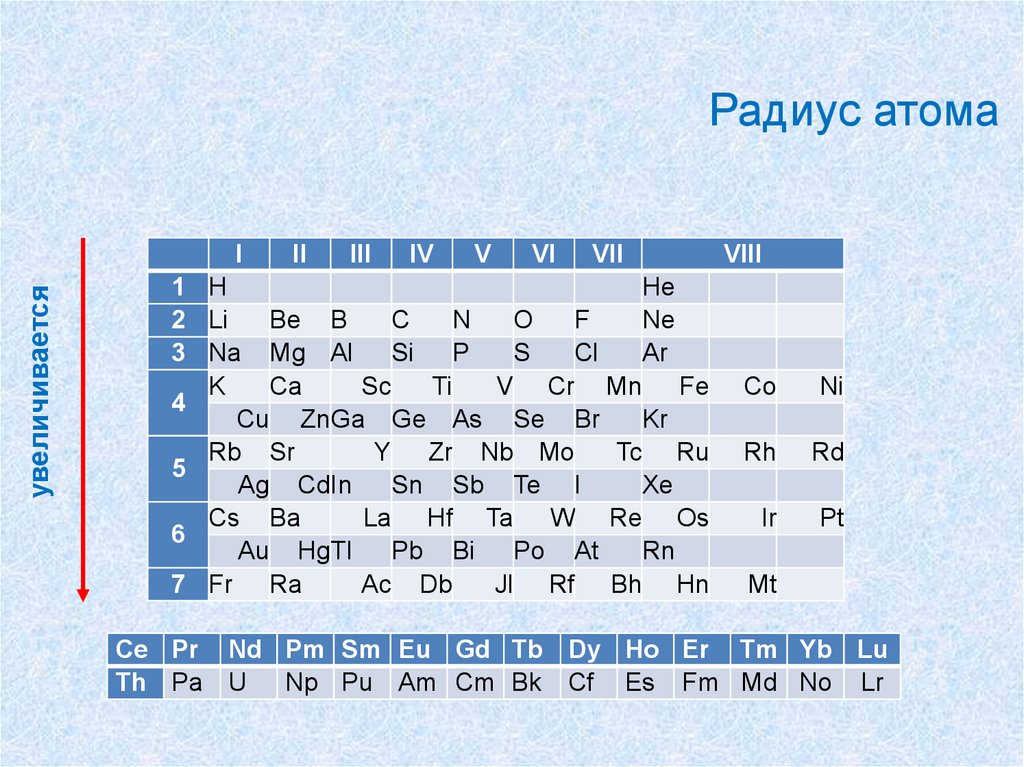
47.
Радиус атомаувеличивается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
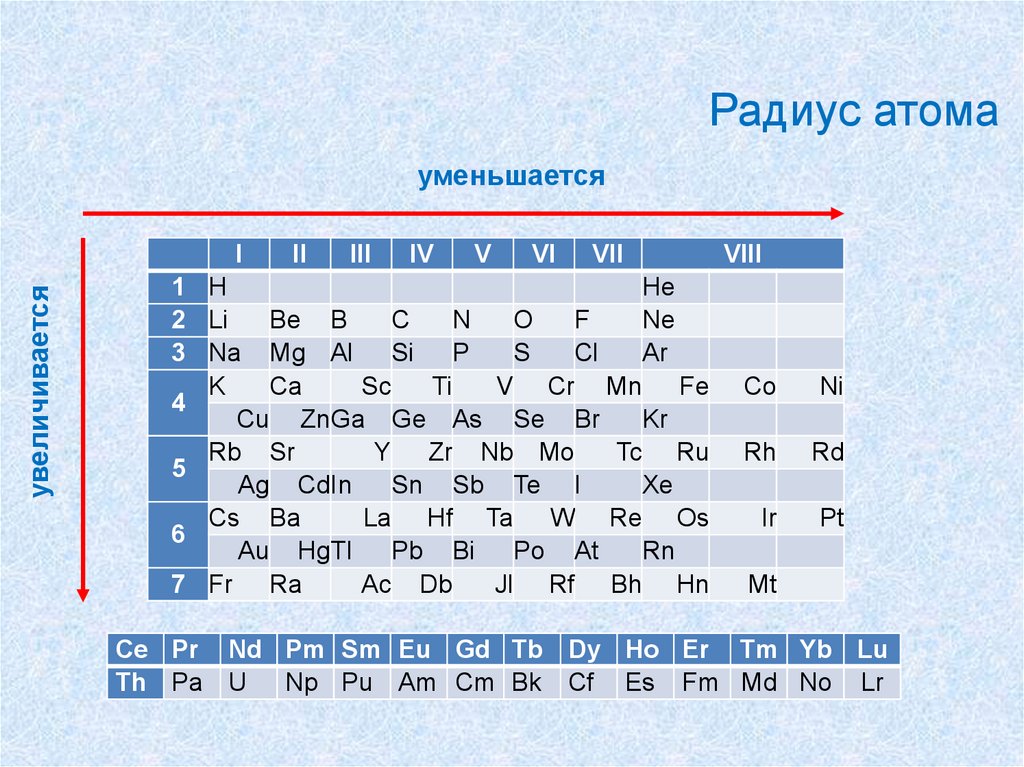
48.
Радиус атомаувеличивается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
49.
Радиус атомауменьшается
увеличивается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
50.
Прочность связи внешнихэлектронов с ядром
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
51.
Прочность связи внешнихэлектронов с ядром
уменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
52.
Прочность связи внешнихэлектронов с ядром
уменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
53.
Прочность связи внешнихэлектронов с ядром
увеличивается
уменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
54.
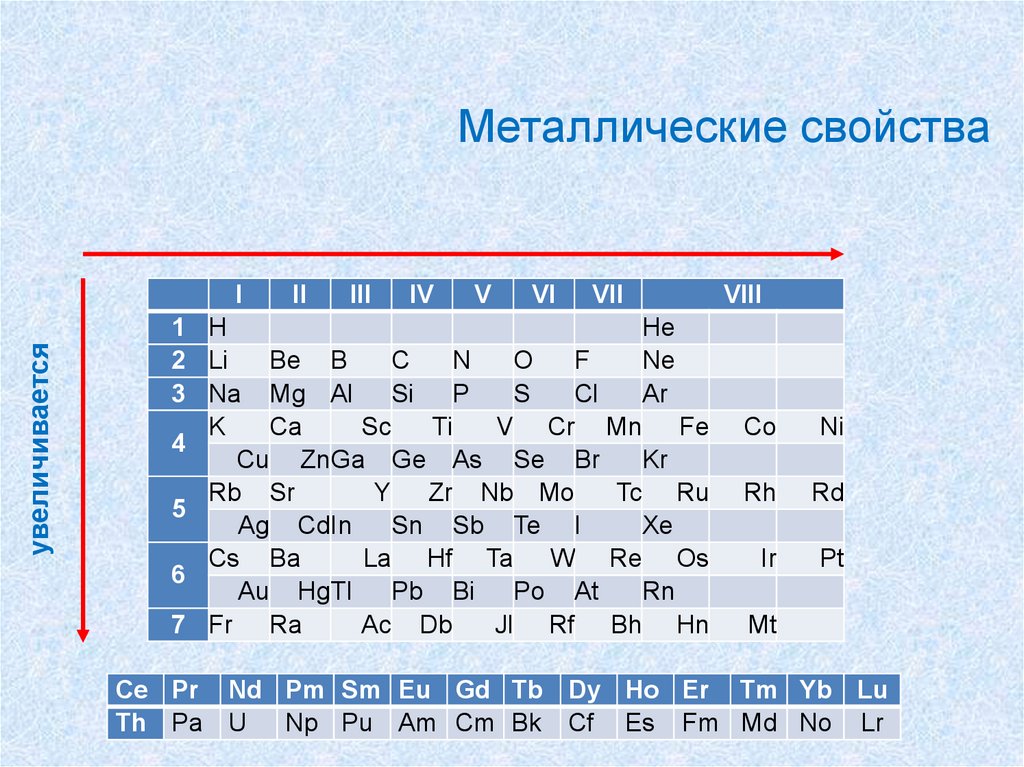
Металлические свойстваI
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
55.
Металлические свойстваувеличивается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
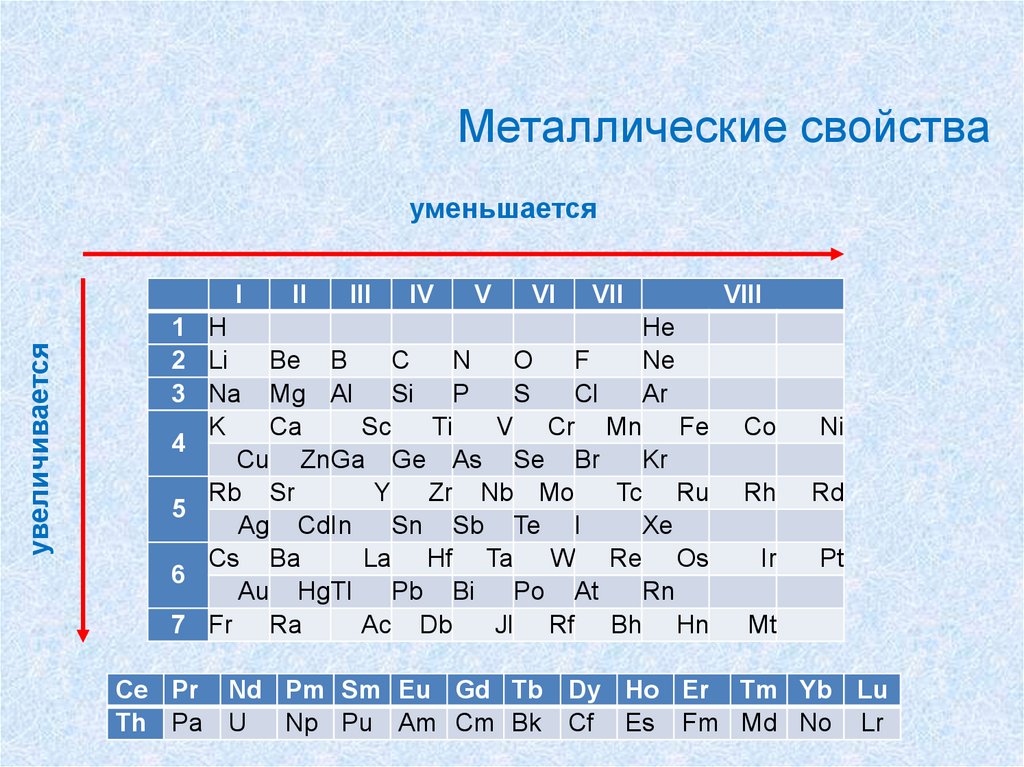
56.
Металлические свойстваувеличивается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
57.
Металлические свойствауменьшается
увеличивается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
58.
Неметаллические свойстваI
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
59.
Неметаллические свойствауменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
60.
Неметаллические свойствауменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
61.
Неметаллические свойстваувеличивается
уменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
62.
Энергия ионизацииI
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
63.
Энергия ионизацииуменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
64.
Энергия ионизацииуменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
65.
Энергия ионизацииувеличивается
уменьшается
I
II
III
IV
V
VI
VII
1 H
He
2 Li
Be B
C
N
O
F
Ne
3 Na Mg Al Si P
S
Cl
Ar
K
Ca
Sc
Ti
V Cr Mn Fe
4
Cu ZnGa Ge As Se Br
Kr
Rb Sr
Y Zr Nb Mo
Tc Ru
5
Ag CdIn
Sn Sb Te I
Xe
Cs Ba
La Hf Ta W Re Os
6
Au HgTl
Pb Bi Po At
Rn
7 Fr Ra
Ac Db
Jl Rf Bh Hn
VIII
Co
Ni
Rh
Rd
Ir
Pt
Mt
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
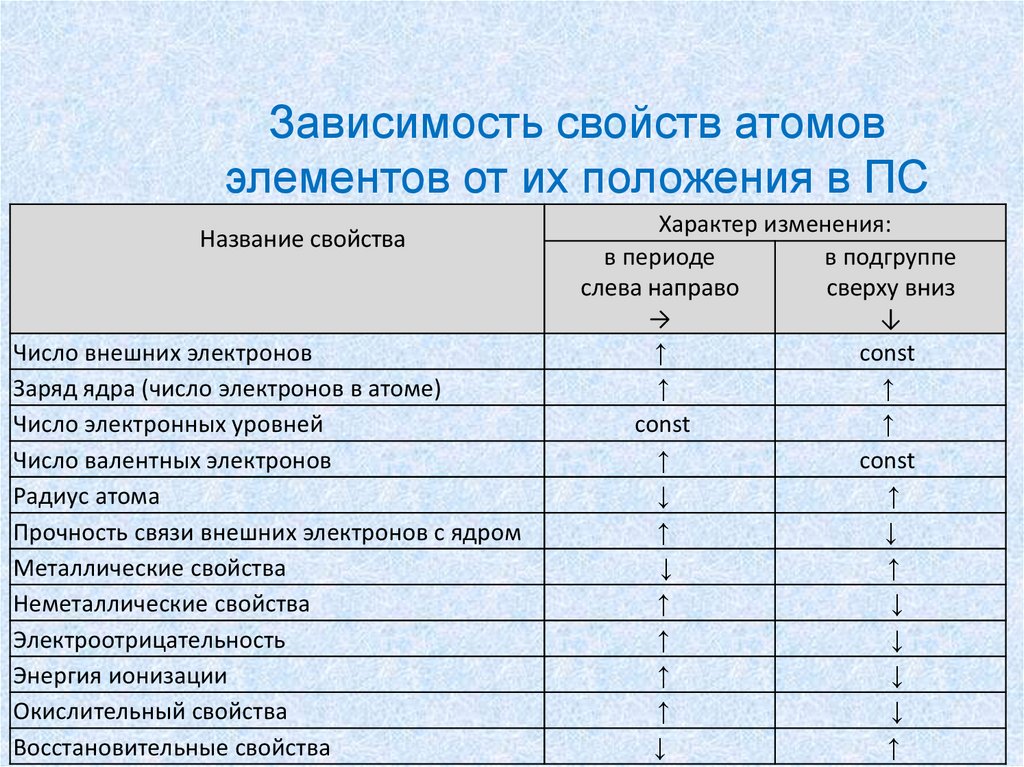
66.
Зависимость свойств атомовэлементов от их положения в ПС
Название свойства
Число внешних электронов
Заряд ядра (число электронов в атоме)
Число электронных уровней
Число валентных электронов
Радиус атома
Прочность связи внешних электронов с ядром
Металлические свойства
Неметаллические свойства
Электроотрицательность
Энергия ионизации
Окислительный свойства
Восстановительные свойства
Характер изменения:
в периоде
в подгруппе
слева направо
сверху вниз
→
↓
↑
const
↑
↑
const
↑
↑
const
↓
↑
↑
↓
↓
↑
↑
↓
↑
↓
↑
↓
↑
↓
↓
↑
67.
Общая характеристика металлов главныхподгрупп I – III групп и особенностями
строения их атомов
Металлы IА
- строение валентного
слоя ns1→ с.о. +1
- в подгруппе радиус
атома увеличивается, ⇒,
восстановительные
свойства увеличиваются
- активные металлы
- образуют основные
оксиды и гидроксиды,
хорошо растворимые в
воде
Металлы IIА
Металлы IIIА
При переходе от I к III группе радиус атома уменьшается
⇒восстановительные свойства уменьшаются
68.
Общая характеристика металлов главныхподгрупп I – III групп и особенностями
строения их атомов
Металлы IА
- строение валентного
слоя ns1→ с.о. +1
- в подгруппе радиус
атома увеличивается, ⇒,
восстановительные
свойства увеличиваются
- активные металлы
- образуют основные
оксиды и гидроксиды,
хорошо растворимые в
воде
Металлы IIА
- строение валентного слоя
ns2→ с.о. +2
- в подгруппе радиус атома
увеличивается, ⇒,
восстановительные свойства
увеличиваются
- все элементы, кроме Ве,
обладают ярко выраженными
металлическими свойствами
- образуют основные оксиды и
гидроксиды, хорошо
растворимые в воде
Ве – амфотерный элемент
Металлы IIIА
При переходе от I к III группе радиус атома уменьшается
⇒восстановительные свойства уменьшаются
69.
Общая характеристика металлов главныхподгрупп I – III групп и особенностями
строения их атомов
Металлы IА
- строение валентного
слоя ns1→ с.о. +1
- в подгруппе радиус
атома увеличивается, ⇒,
восстановительные
свойства увеличиваются
- активные металлы
- образуют основные
оксиды и гидроксиды,
хорошо растворимые в
воде
Металлы IIА
- строение валентного слоя
ns2→ с.о. +2
- в подгруппе радиус атома
увеличивается, ⇒,
восстановительные свойства
увеличиваются
- все элементы, кроме Ве,
обладают ярко выраженными
металлическими свойствами
- образуют основные оксиды и
гидроксиды, хорошо
растворимые в воде
Ве – амфотерный элемент
Металлы IIIА
- строение валентного
слоя ns2np1→ с.о. +3
- в подгруппе радиус
атома увеличивается, ⇒,
восстановительные
свойства увеличиваются
- металлические
свойства возрастают
- оксиды и гидроксиды
являются амфотерными
Исключение Tl и его
соединения проявляют
основные свойства
При переходе от I к III группе радиус атома уменьшается
⇒восстановительные свойства уменьшаются
70.
Общая характеристика неметаллов главныхподгрупп IV – VII групп и особенностями
строения их атомов
Элементы IV A
строение атома
ns2np2
С Si Ge Sn Pb
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются, а
металлические
увеличиваются
с.о. -4; 0; +2; + 4
Элементы V A
Элементы VI A
Элементы VII A
71.
Общая характеристика неметаллов главныхподгрупп IV – VII групп и особенностями
строения их атомов
Элементы IV A
строение атома
ns2np2
С Si Ge Sn Pb
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются, а
металлические
увеличиваются
Элементы V A
строение атома
ns2np3d0
Исключение N нет d-подуровня
N P As Sb Bi
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются
с.о. -4; 0; +2; + 4
с.о. -3; 0; +3; + 5
Элементы VI A
Элементы VII A
72.
Общая характеристика неметаллов главныхподгрупп IV – VII групп и особенностями
строения их атомов
Элементы IV A
строение атома
ns2np2
С Si Ge Sn Pb
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются, а
металлические
увеличиваются
Элементы V A
строение атома
ns2np3d0
Исключение N нет d-подуровня
N P As Sb Bi
Элементы VI A
строение атома
ns2np4d0
Исключение О нет d-подуровня
О S Se Te Po
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются
с.о. -3; 0; +3; + 5
с.о. -2; 0; +2; +4 ;
+6
Исключение О,
только -2; 0; +2
с.о. -4; 0; +2; + 4
Элементы VII A
73.
Общая характеристика неметаллов главныхподгрупп IV – VII групп и особенностями
строения их атомов Элементы VII A
Элементы IV A
строение атома
ns2np2
С Si Ge Sn Pb
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются, а
металлические
увеличиваются
Элементы V A
строение атома
ns2np3d0
Исключение N нет d-подуровня
N P As Sb Bi
Элементы VI A
строение атома
ns2np4d0
Исключение О нет d-подуровня
О S Se Te Po
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются
радиус
увеличивается ⇒
неметаллические
свойства
уменьшаются
с.о. -3; 0; +3; + 5
с.о. -2; 0; +2; +4 ;
+6
Исключение О,
только -2; 0; +2
с.о. -4; 0; +2; + 4
строение атома
ns2np5d0
Исключение F нет d-подуровня
F Cl Br I
радиус увеличивается ⇒
неметаллические свойства
уменьшаются
с.о. -1; 0; +1; +3 ; +5; +7
Исключение F, только -1; 0
- окислительные свойства
уменьшаются
- сила межмолекулярного
взаимодействия
увеличивается ⇒
увеличивается прочность
кристаллической решетки
-HF – HCl – HBr – HJ
увеличивается сила кислоты,
т.к. радиус атома
увеличивается и прочность
связи уменьшается
74.
Характеристика переходных элементов(меди, цинка, хрома, железа) по их положению в ПСХЭ и
особенностями строения их атомов
металлические свойства этих элементов выражены слабее, чем
у элементов главных подгрупп ⇒ восстановительные свойства
простых веществ, тоже более слабые
• оксиды и гидроксиды в с.о. +1 и +2 проявляют основные
свойства
• оксиды и гидроксиды в с.о. +3; +4 и +5 – амфотерные
• оксиды и гидроксиды в с.о +6 и +7 - кислотные
75.
Разбор тестовых заданий76.
Задание 1Химический элемент, имеющий электронную конфигурацию
1s22s22p63s23p64s2, в периодической системе находится в
1) 3-м периоде, VIIIВ группе
2) 4-м периоде, IIА группе
3) 4-м периоде, IIВ группе
4) 3-м периоде, VIIIA группе
77.
Задание 1Химический элемент, имеющий электронную конфигурацию
1s22s22p63s23p64s2, в периодической системе находится в
1) 3-м периоде, VIIIВ группе
2) 4-м периоде, IIА группе
3) 4-м периоде, IIВ группе
4) 3-м периоде, VIIIA группе
78.
Задание 2Атом хрома имеет электронную конфигурацию
1) 1s22s22p4
2) 1s22s22p63s23p6
3) 1s22s22p63s23p63d54s1
4) 1s22s22p63s23p4
79.
Задание 2Атом хрома имеет электронную конфигурацию
1) 1s22s22p4
2) 1s22s22p63s23p6
3) 1s22s22p63s23p63d54s1
4) 1s22s22p63s23p4
80.
Задание 3Сходную конфигурацию внешнего
энергетического уровня имеют элементы хлор и
1) марганец
2) сера
3) аргон
4) бром
81.
Задание 3Сходную конфигурацию внешнего
энергетического уровня имеют элементы хлор и
1) марганец
2) сера
3) аргон
4) бром
82.
Задание 4Число электронов на 3р-орбиталях атома фосфора в
основном состоянии равно:
1) пяти
2) двум
3) трем
4) четырем
83.
Задание 4Число электронов на 3р-орбиталях атома фосфора в
основном состоянии равно:
1) пяти
2) двум
3) трем
4) четырем
84.
Задание 5У атома кремния в основном состоянии число неспаренных
электронов равно
1) 1
2) 2
3) 3
4) 0
85.
Задание 5У атома кремния в основном состоянии число неспаренных
электронов равно
1) 1
2) 2
3) 3
4) 0
86.
Задание 6Атом серы в максимально возбужденном состоянии имеет
электронную конфигурацию валентных электронов
1) 3s23p43d0
2) 3s23p33d1
3) 3s13p23d3
4) 3s13p33d2
87.
Задание 6Атом серы в максимально возбужденном состоянии имеет
электронную конфигурацию валентных электронов
1) 3s23p43d0
2) 3s23p33d1
3) 3s13p23d3
4) 3s13p33d2
88.
Задание 7Не может находиться в возбужденном состоянии атом
1) углерода
2) азота
3) фосфора
4) серы
89.
Задание 7Не может находиться в возбужденном состоянии атом
1) углерода
2) азота
3) фосфора
4) серы
90.
Задание 8Электронная конфигурация иона хлора Cl-:
1) 1s22s22p63s23p3
2) 1s22s22p63s23p4
3) 1s22s22p63s23p5
4) 1s22s22p63s23p6
91.
Задание 8Электронная конфигурация иона хлора Cl-:
1) 1s22s22p63s23p3
2) 1s22s22p63s23p4
3) 1s22s22p63s23p5
4) 1s22s22p63s23p6
92.
Задание 9Одинаковую электронную конфигурацию имеют атомы
неона и частица:
1) Mg2+
2) S23) Cl+
4) К+
93.
Задание 9Одинаковую электронную конфигурацию имеют атомы
неона и частица:
1) Mg2+
2) S23) Cl+
4) К+
94.
Задание 10Частицей, имеющей такое же строение электронной
оболочки, как у атома аргона, является
1) Сl+3
2) Cl+
3) Cl0
4) Сl-
95.
Задание 10Частицей, имеющей такое же строение электронной
оболочки, как у атома аргона, является
1) Сl+3
2) Cl+
3) Cl0
4) Сl-
96.
Задание 51Атомы элементов 4-го периода имеют одинаковое число:
1) электронов на внешнем энергетическом уровне
2) нейтронов
3) энергетических уровней
4)протонов
97.
Задание 51Атомы элементов 4-го периода имеют одинаковое число:
1) электронов на внешнем энергетическом уровне
2) нейтронов
3) энергетических уровней
4)протонов
98.
Задание 52Атомы элементов IIА группы сходны по:
1) числу электронов в атоме
2) числу электронов на внешнем электронном слое
3) числу энергетических уровней в электронной оболочке
4) радиусу атомов
99.
Задание 52Атомы элементов IIА группы сходны по:
1) числу электронов в атоме
2) числу электронов на внешнем электронном слое
3) числу энергетических уровней в электронной оболочке
4) радиусу атомов
100.
Задание 53Какая из характеристик атомов одинакова для всех элементов 3-го
периода периодической системы?
1) число энергетических уровней
2) радиусы атомов
3) число электронов на внешнем энергетическом уровне
4) число протонов в ядре атома
101.
Задание 53Какая из характеристик атомов одинакова для всех элементов 3-го
периода периодической системы?
1) число энергетических уровней
2) радиусы атомов
3) число электронов на внешнем энергетическом уровне
4) число протонов в ядре атома
102.
Задание 54В группах с ростом порядкового номера атомов элементов
увеличивается:
1) число валентных электронов
2) атомный радиус
3) электроотрицательность
4) кислотные свойства высших гидроксидов
103.
Задание 54В группах с ростом порядкового номера атомов элементов
увеличивается:
1) число валентных электронов
2) атомный радиус
3) электроотрицательность
4) кислотные свойства высших гидроксидов
104.
Задание 55Наименьший радиус имеет атом
1) фтора
2) бериллия
3) бария
4) кремния
105.
Задание 55Наименьший радиус имеет атом
1) фтора
2) бериллия
3) бария
4) кремния
106.
Задание 56Атому с наибольшим радиусом соответствует электронная
конфигурация
1) 1s22s22p63s23p1
2) 1s22s22p4
3) 1s22s22p63s23p5
4) 1s22s22p2
107.
Задание 56Атому с наибольшим радиусом соответствует электронная
конфигурация
1) 1s22s22p63s23p1
2) 1s22s22p4
3) 1s22s22p63s23p5
4) 1s22s22p2
108.
Задание 57Наибольший радиус имеет ион
1) Rb+
2) Sr2+
3) Те2-
4) I-
109.
Задание 57Наибольший радиус имеет ион
1) Rb+
2) Sr2+
3) Те2-
4) I-
110.
Задание 58Наименьший радиус имеет ион
1) Сl-
2) Mg2+
3) S2-
4) Са2+
111.
Задание 58Наименьший радиус имеет ион
1) Сl-
2) Mg2+
3) S2-
4) Са2+
112.
Задание 59Наибольшее значение электроотрицательности имеет атом,
электронная конфигурация которого
1) 1s22s22p1
2) 1s22s22p4
3) 1s22s22p5
4) 1s22s22p63s23p5
113.
Задание 59Наибольшее значение электроотрицательности имеет атом,
электронная конфигурация которого
1) 1s22s22p1
2) 1s22s22p4
3) 1s22s22p5
4) 1s22s22p63s23p5
114.
Задание 60Химическому элементу, электронная формула которого
1s22s22p63s23p2, соответствует водородное соединение
1) хлороводород
2) сероводород
3) фосфин
4) силан
115.
Задание 60Химическому элементу, электронная формула которого
1s22s22p63s23p2, соответствует водородное соединение
1) хлороводород
2) сероводород
3) фосфин
4) силан
































































































 Химия
Химия








