Похожие презентации:
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
1.
Гидролиз неорганическихвеществ
(теоретический материал
для подготовки к ЕГЭ)
Учитель химии МБОУ «СОШ № 36»
города Курска
Ломакина Галина Алексеевна
2.
• Гидролиз(от греческого hydro – вода;
lysis – разложение)
• Гидролиз соли – это химическая реакция
обменного взаимодействия соли с водой, в
результате которой ионы слабого электролита,
входящие в состав соли, соединяются с
составными частями воды: H+ и OH- .
• Сопровождается изменением реакции среды
3.
Гидролиз• Неорганические
вещества:
а) Соли
б) Карбиды металлов
в) Гидриды металлов
• Органические
вещества
4.
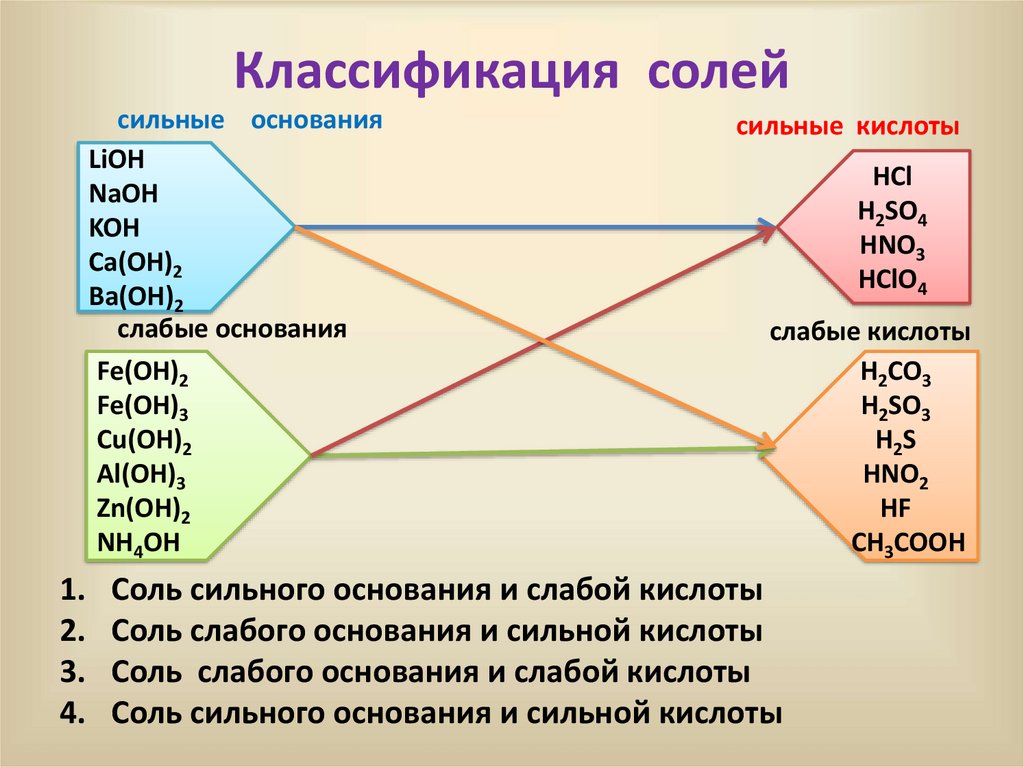
Классификация солейcильные основания
LiOH
NaOH
KOH
Ca(OH)2
Ba(OH)2
слабые основания
Fe(OH)2
Fe(OH)3
Cu(OH)2
Al(OH)3
Zn(OH)2
NH4OH
1.
2.
3.
4.
сильные кислоты
HCl
H2SO4
HNO3
HClO4
слабые кислоты
H2CO3
H2SO3
H2S
HNO2
HF
CH3COOH
Соль сильного основания и слабой кислоты
Соль слабого основания и сильной кислоты
Соль слабого основания и слабой кислоты
Соль сильного основания и сильной кислоты
5.
Алгоритм написанияуравнений реакций гидролиза:
1. Определяем тип гидролиза
2. Записываем сокращенное ионное и
полное ионное уравнение гидролиза,
определяем среду
3.Составляем молекулярное уравнение
6.
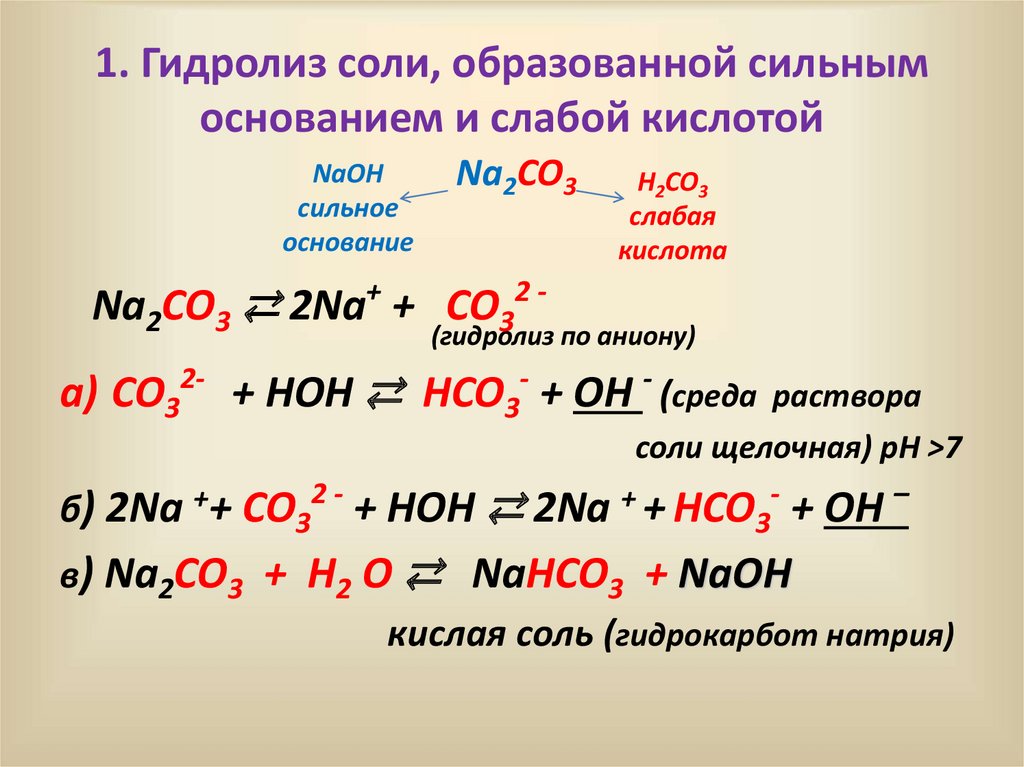
1. Гидролиз соли, образованной сильнымоснованием и слабой кислотой
NaOH
сильное
основание
Na2CO3
H2CO3
слабая
кислота
Na2CO3 ⇄ 2Na+ + CO32 -
(гидролиз по аниону)
a) CO32- - + HOH ⇄ HCO3- + OH - (среда
раствора
соли щелочная) рН >7
б) 2Na ++ CO32 - + HOH ⇄ 2Na + + HCO3- + OH –
в) Na2CO3 + H2 O ⇄ NaHCO3 + NaOH
кислая соль (гидрокарбот натрия)
7.
Гидролиз по аниону:• Ann– + H-OH ⇄ HAn(n-1)– + OH–
8.
2. Гидролиз соли, образованной слабымоснованием и сильной кислотой
Zn(ОН)2
ZnSO4 H2SO4
слабое
основание
сильная
кислота
ZnSO4 ⇄ Zn2+ + SO42 - (гидролиз по катиону)
2+
+
а) Zn + HOH ⇄ ZnOH + H+ среда раствора
соли кислотная (рН<7)
б) Zn2 + + SO42- + HOH ⇄ ZnOH + + H+ + SO42-
в)2 ZnSO4 + 2Н2О ⇄ (ZnOH)2SO4 + Н2 SO4
основная соль
(гидроксосульфат цинка)
9.
Гидролиз по катиону:n+
Me
+ H-OH ⇄
(n-1)+
MeOH
+
+
H
10.
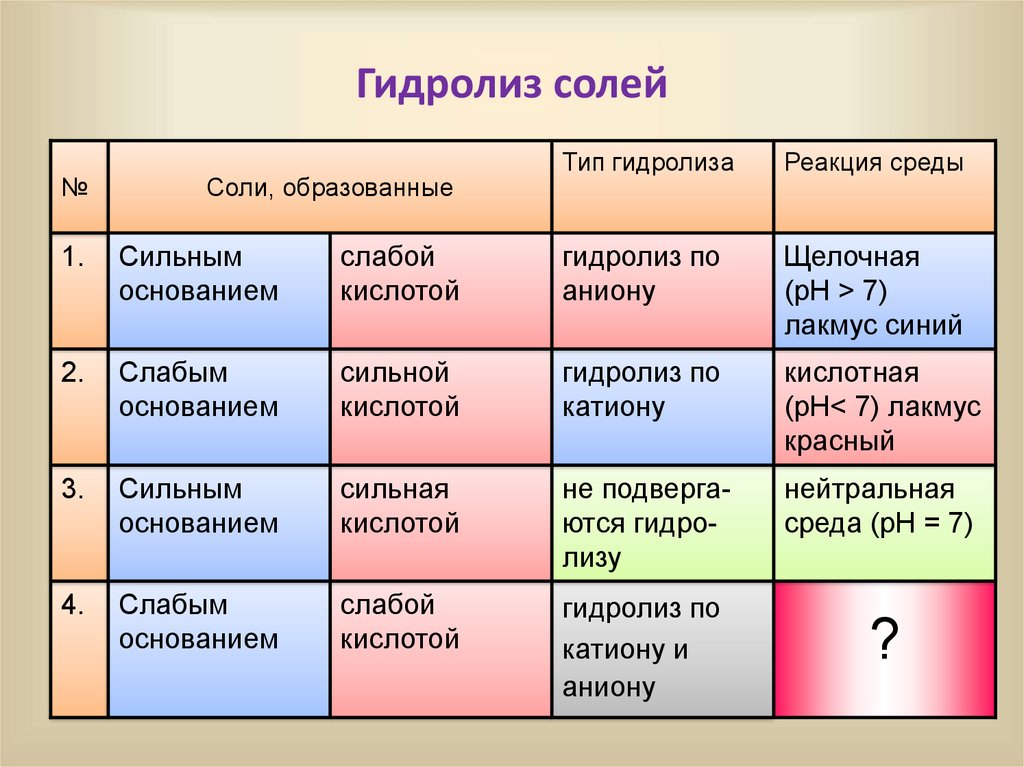
3. Гидролиз соли, образованной слабымоснованием и слабой кислотой
• С водой взаимодействует как катион
слабого основания, так и анион слабой
кислоты, например:
Al2S3 + 6 H2 O 2Al(OH)3 + 3H2S
• Гидролиз солей, образованных двумя
слабыми электролитами часто протекает до
конца (выделяется осадок или газ), т.е.
является необратимым.
11.
4. Соль, образованная сильным основаниеми сильной кислотой
• В растворе нитрата калия
КNO3
КOH сильное
основание
HNO3 сильная
кислота
К+ – катион сильного основания
NO3-- анион сильной кислоты
• Нет ионов которые могли бы связываться с
молекулами воды в малодиссоциирующие
ионы, гидролиза не происходит раствор
нейтральный, рН=7
12.
Факторы, влияющиена степень гидролиза:
гидролиз обратимая реакция, на состояние
равновесия гидролиза влияют:
• концентрации участников реакции,
• добавление посторонних веществ,
• температура,
• разбавление.
13.
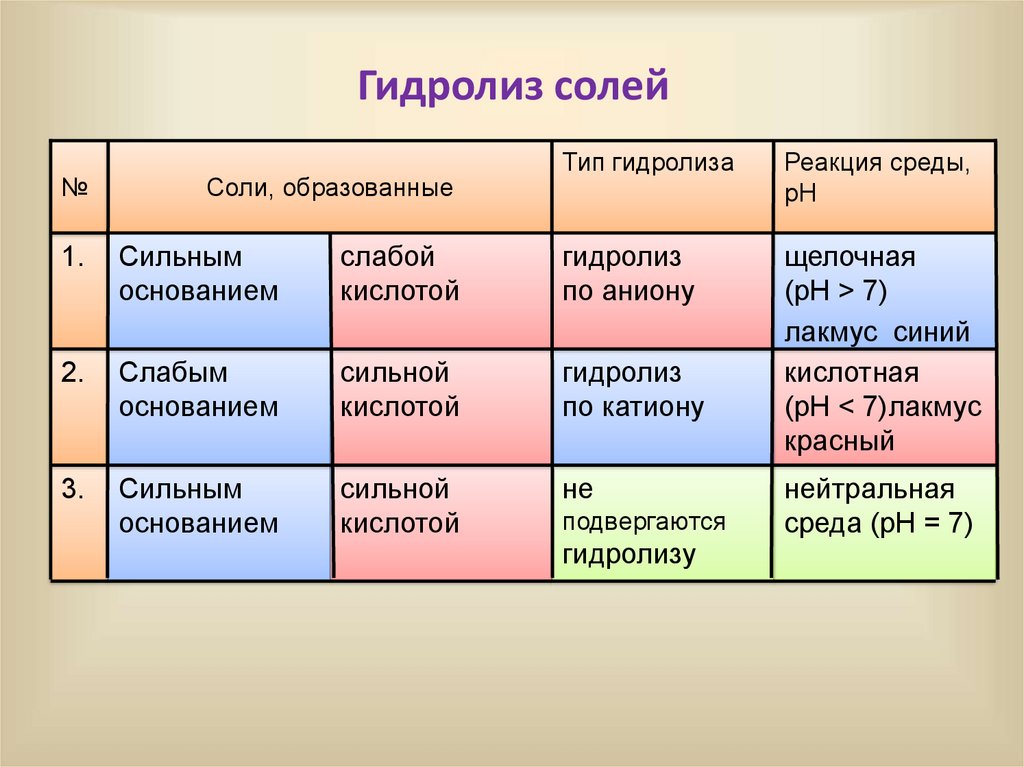
Гидролиз солей№
Соли, образованные
Тип гидролиза
Реакция среды,
pH
щелочная
(pH > 7)
лакмус синий
кислотная
(pH < 7)лакмус
красный
1.
Сильным
основанием
слабой
кислотой
гидролиз
по аниону
2.
Слабым
основанием
сильной
кислотой
гидролиз
по катиону
3.
Сильным
основанием
сильной
кислотой
не
подвергаются
гидролизу
нейтральная
среда (pH = 7)
14.
Гидролиз солей№
Соли, образованные
Тип гидролиза
Реакция среды
1.
Сильным
основанием
слабой
кислотой
гидролиз по
аниону
Щелочная
(pH > 7)
лакмус синий
2.
Слабым
основанием
сильной
кислотой
гидролиз по
катиону
кислотная
(pH< 7) лакмус
красный
3.
Сильным
основанием
сильная
кислотой
не подвергаются гидролизу
нейтральная
среда (pH = 7)
4.
Слабым
основанием
слабой
кислотой
гидролиз по
катиону и
аниону
?
15.
Готовимся к ЕГЭ1. Установите соответствие:
Формула соли
Тип гидролиза
1. FeCl2
А. по катиону
2. Ba(NO3)2
Б. по аниону
3. KF
В. не гидролизуется
4. Na3PO4
Ответ:
1А;
2В; 3Б; 4Б
16.
Готовимся к ЕГЭ2. Установите соответствие:
Формула соли
Среда раствора
1. K2SO4
А. кислотная
2. Li2CO3
Б. щелочная
3. NH4Br
В. нейтральная
4. CrCl3
Ответ:
1В; 2Б; 3А; 4А
17.
Готовимся к ЕГЭ3. Установите соответствие:
Формула соли
Значение pH
1. K2SiO3
А. pH < 7
2. LiNO3
Б. pH > 7
3. CuCl2
В. pH = 7
4. NaCl
Ответ: 1Б; 2В; 3А; 4В
18.
Готовимся к ЕГЭ4. Фенолфталеин можно использовать для
обнаружения в водном растворе соли:
1) ацетата алюминия (CH3COO)3 Al
2) нитрата калия
KNO3
3) сульфата алюминия Al2 (SO4)3
4) силиката натрия Na2SiO3
Ответ:
4
19.
Готовимся к ЕГЭНАЗВАНИЕ СОЛИ
ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) гидрокарбонат калия
Б) сульфат аммония
В) нитрат натрия
Г) ацетат алюминия
1) не гидролизуется
Ответ:
А
Б
3
2
В
1
Г
4
2) гидролизуется по катиону
3) гидролизуется по аниону
4) гидролизуется по катиону
и аниону
20.
Гидролиз неорганических веществ• CaC2 + 2H2O
Ca(OH)2 + C2H2
Карбид кальция
• Al4C3 + 12 H2O
3CH4
+ 4Al(OH)3
Карбид алюминия
• SiCI4 + 3HOH
H2SiO3 + 4HCI
кремниевая кислота
21.
Источники информации:• Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала
химии. — М.: Экзамен, 2001.
• Хомченко Г.П. , Хомченко И.Г. Сборник задач по
химии. — М., 2000 .
• http://hydorlysis.narod.ru/pages/teoria.htm
http://www.xumuk.ru/encyklopedia/1047.html
• Химия (ЕГЭ-2018), ФИПИ, по ред.Кавериной,
М-Национальное образование, 2018 .

















 Химия
Химия








