Похожие презентации:
Гидролиз неорганических соединений
1. Гидролиз неорганических соединений
1.2.
3.
Общая характеристика;
Гидролиз разных солей;
Связь с pH, применение.
2. Что такое гидролиз?
Гидролиз – реакция обменного разложениявеществ водой.
Гидролиз – это процесс взаимодействия ионов
соли с водой, приводящий к образованию слабого
электролита.
3.
Исследование растворов солей индикаторами показало, чтоони могут характеризоваться нейтральной, кислой и
щелочной реакцией среды. При растворении многих солей в
воде происходит взаимодействие ионов соли с катионами
водорода и гидроксид-анионами. В растворе происходит
накопление либо катионов водорода, либо гидроксиданионов и раствор, соответственно, приобретает кислую
или щелочную реакцию.
4.
5. Рассматривая соли, как продукт взаимодействия кислоты с основанием, выделяют четыре типа гидролиза в зависимости от силы исходных кислоты
и основания.6. 1. гидролиз соли, образованной сильным основанием и слабой кислотой
Na2 CO3 H 2 O гидролиз?
CO32 H OH
HCO3 OH
Na2 CO3 H 2 O
NaHCO3 NaOH
протекает в направлении
накопления ионов гидроксогруппы (щелочная среда).
Фенолфталеин малиновый.
щелочная
среда
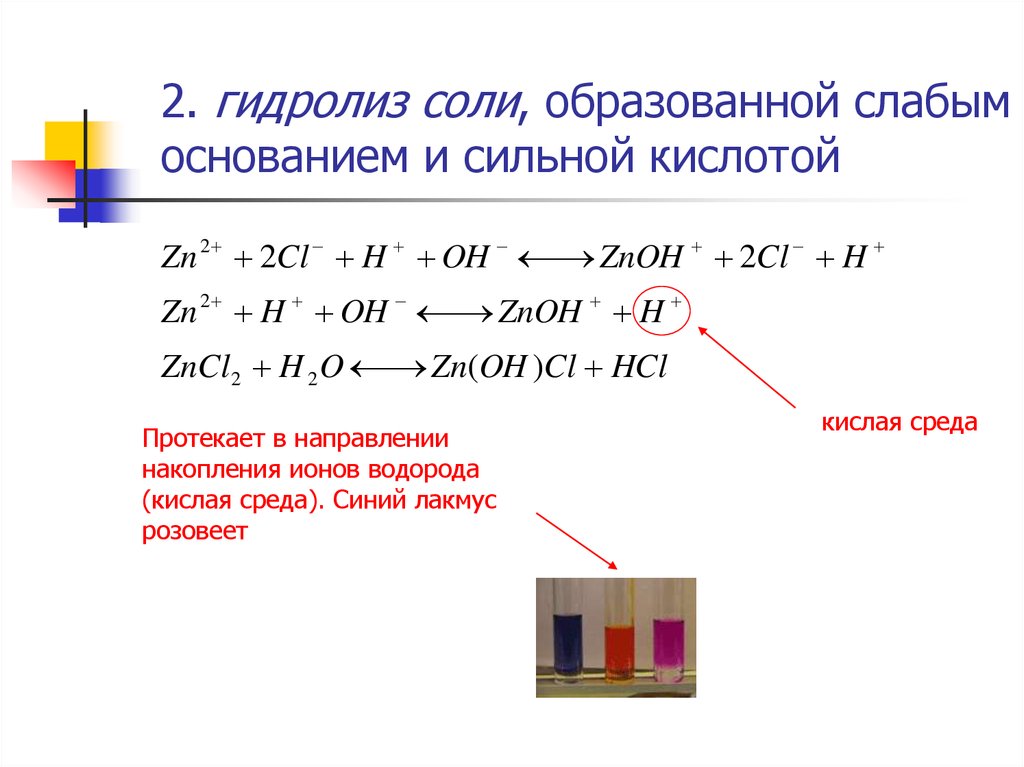
7. 2. гидролиз соли, образованной слабым основанием и сильной кислотой
Zn 2 2Cl H OHZnOH 2Cl H
Zn 2 H OH
ZnOH H
ZnCl 2 H 2 O
Zn(OH )Cl HCl
Протекает в направлении
накопления ионов водорода
(кислая среда). Синий лакмус
розовеет
кислая среда
8. 3. гидролиз соли, образованной сильным основанием и сильной кислотой
2 Na SO42 H OH2 Na SO42 H 2 O
Индикатор сохраняет свой
цвет
нейтральная среда
9. 4. гидролиз соли, образованной слабым основанием и слабой кислотой
Al 2 S 3 H 2 OAl (OH ) 3 H 2 S
гидролиз такой соли не имеет смысла. Гидролиз
идет и по катиону и по аниону. Реакция идет до
конца с образованием соответствующих кислоты и
основания. Реакция среды растворов таких солей
зависит от относительной силы образующихся
слабых кислот и оснований и может быть либо
нейтральной, либо слабощелочной, либо
слабокислой
10.
11.
12.
13. Выводы:
1.2.
3.
Процесс гидролиза обратимый;
В реакции гидролиза участвуют
одна молекула воды с одной
молекулой соли;
AgNO3 гидролизу не подвергается.














 Химия
Химия








