Похожие презентации:
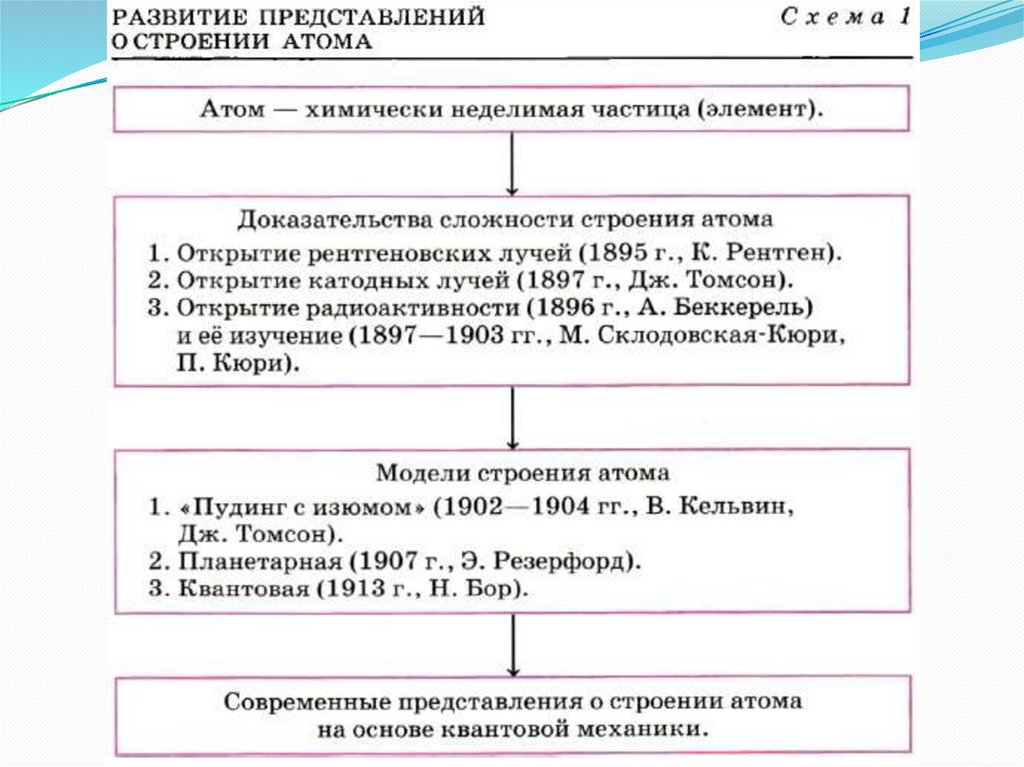
Строение атома
1.
2.
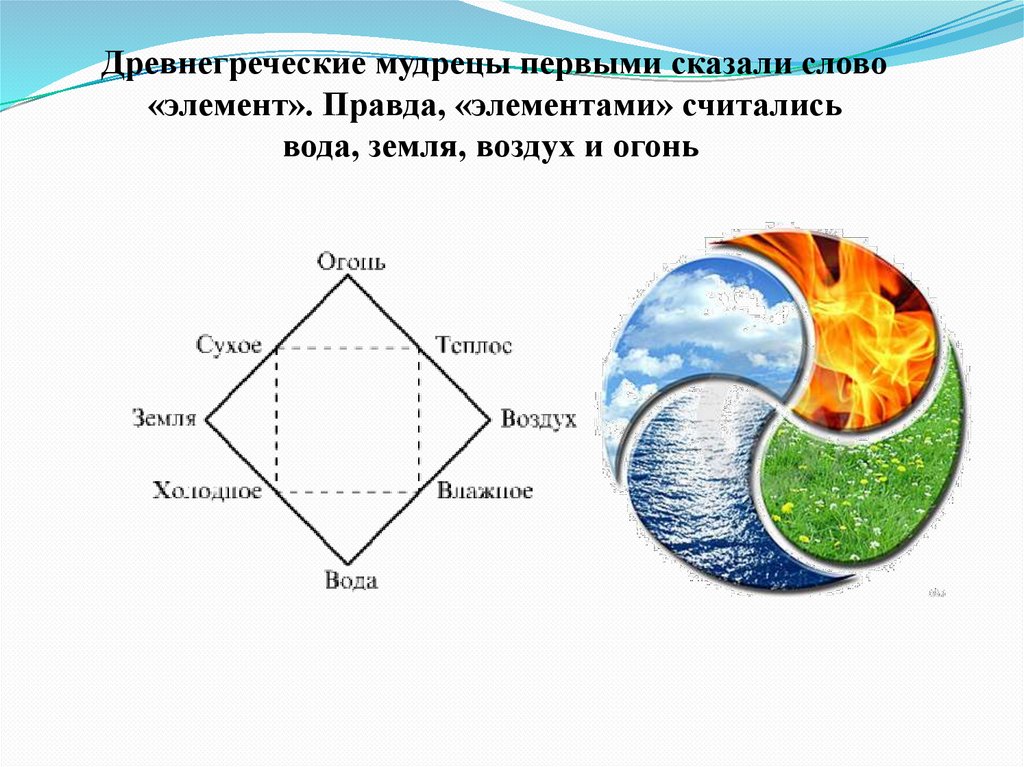
Древнегреческие мудрецы первыми сказали слово«элемент». Правда, «элементами» считались
вода, земля, воздух и огонь
3.
Алхимические символыэлементов
Изображение поглощения
ртутью золота
4.
Алхимики считали, что элементы связанысо звёздами и планетами
Золото - Солнце
Серебро - Луна
Железо - Марс
Медь - Венера
5.
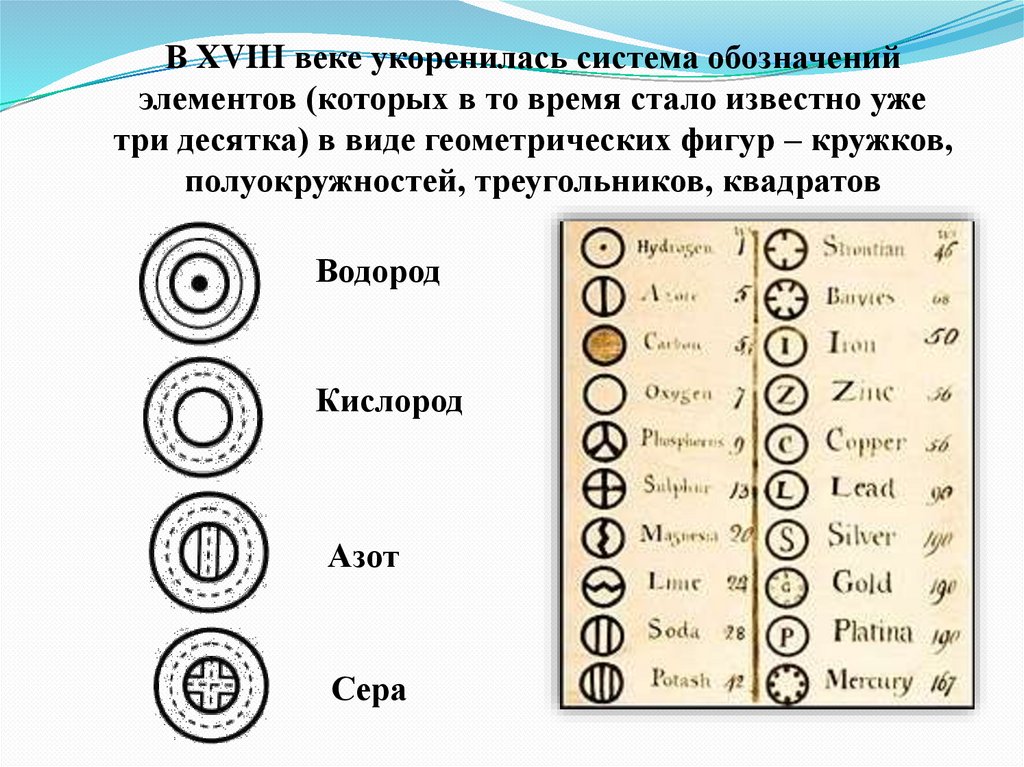
В XVIII веке укоренилась система обозначенийэлементов (которых в то время стало известно уже
три десятка) в виде геометрических фигур – кружков,
полуокружностей, треугольников, квадратов
Водород
Кислород
Азот
Сера
6.
В 1814 году шведский химик Йенс Якоб Берцелиуспредложил обозначать химические элементы первой
буквой латинского названия элемента
Углерод – Carboneum – C
Золото – Aurum – Au
Водород – Hydrogenium – H
Ртуть - Hidrargirum - Hg
7.
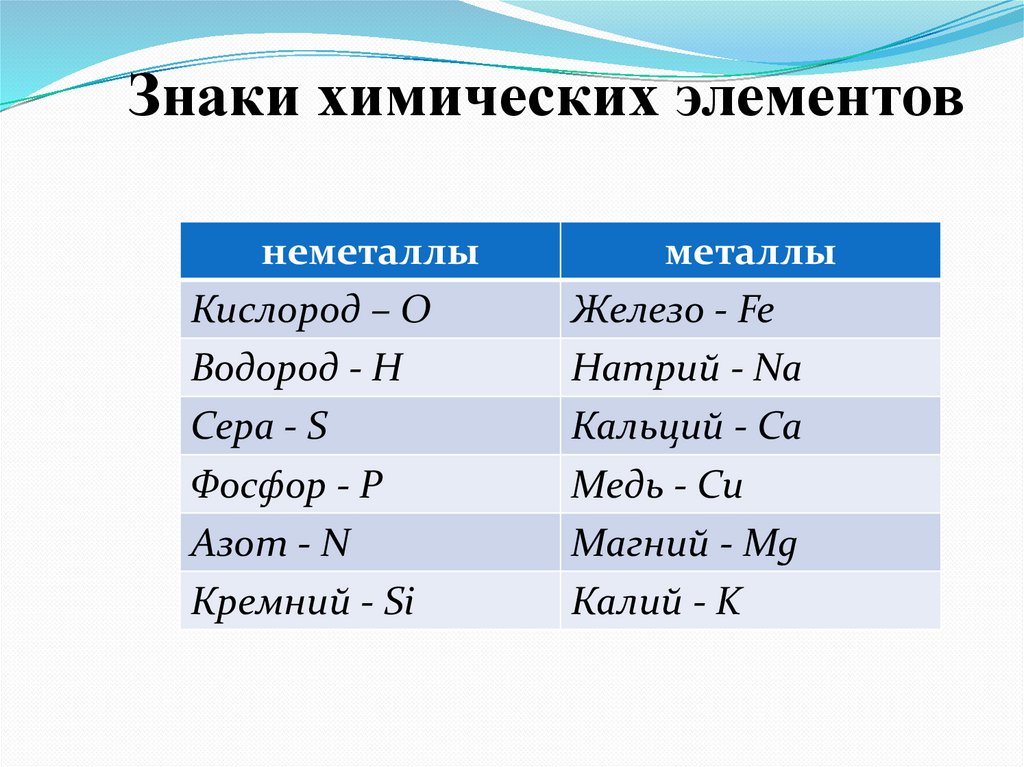
Знаки химических элементовнеметаллы
Кислород – О
Водород - H
Сера - S
Фосфор - P
Азот - N
Кремний - Si
металлы
Железо - Fe
Натрий - Na
Кальций - Ca
Медь - Cu
Магний - Mg
Калий - K
8.
9.
«пудинг с изюмом»«Планетарная модель»
«Квантовая
модель»
10.
11.
В 1913 г. Н. Бор дополнилпланетарную модель
постулатами
Электроны в атоме вращаются по
строго определенным замкнутым
орбитам, не испуская и не поглощая
энергии;
При переходе электронов с одной
орбиты на другую происходит
поглощение или выделение энергии.
12.
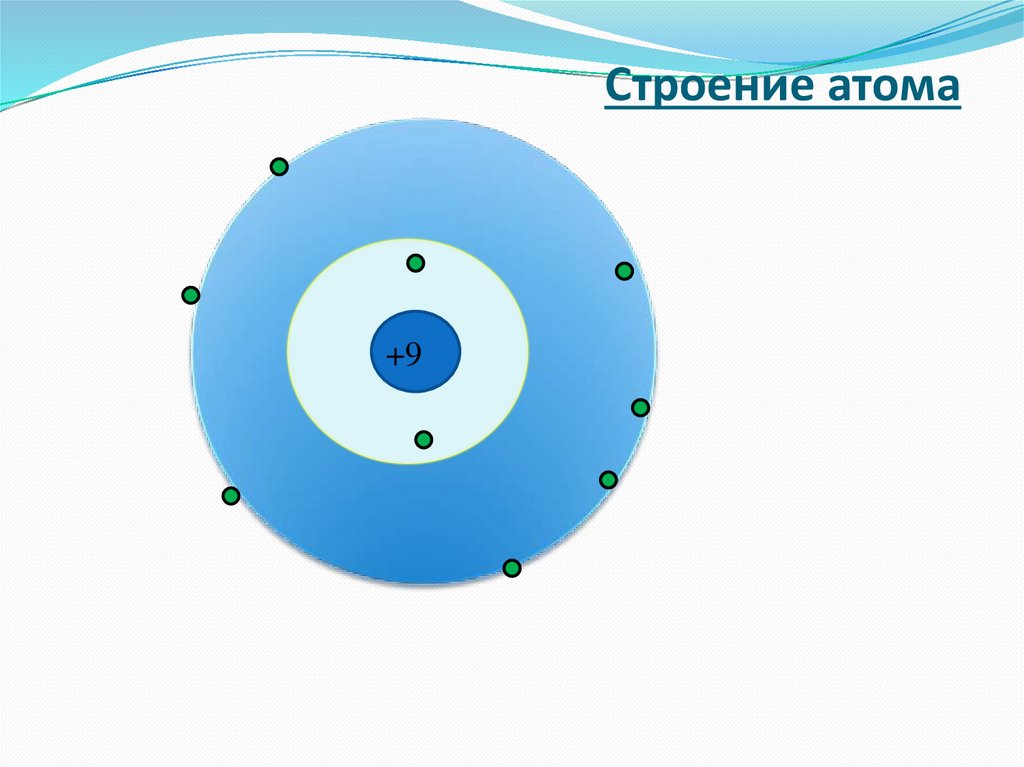
Строение атома+9
13.
электронЭлектрон — это стабильная отрицательно
заряженная элементарная частица.
2. Электрон имеет двойственную
(корпускулярно-волновую) природу.
3. Движущийся электрон обладает свойствами
волны.
4. Электрон в атоме не движется по
определенной траектории, а может
находиться в любой части около ядерного
пространства.
1.
14.
ядроВ 1932 г. была разработана протонно-нейтронная
теория ядра.
Ядро состоит из нуклонов - протонов и нейтронов.
Протон – р+.
Количество протонов (Z) в ядре равно порядковому
номеру элемента.
Нейтрон – n0.
Количество нейтронов (N) вычисляется по
формуле N = A – Z , где
А – массовое число элемента.
15.
Электрон – е-
Число электронов в атоме равно числу
протонов, т.е. порядковому номеру элемента.
атом электронейтральная частица.
Например, Р: № = 15, N е = 15
-
16.
Энергетический уровеньЭлектронная оболочка атома образована
электронными слоями или энергетическими
уровнями.
Электроны, занимающие один уровень, обладают
близкими значениями энергии.
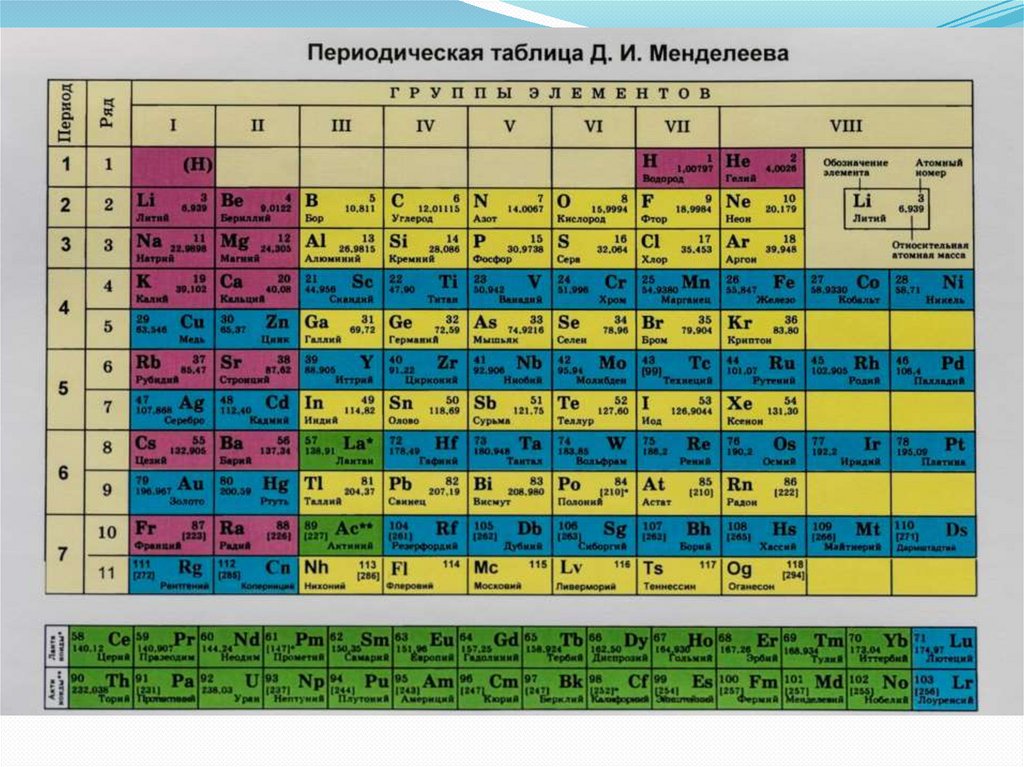
Число энергетических уровней в атоме равно
номеру периода в таблице Д.И.Менделеева, а
котором располагается химический элемент.
1 период – 1 уровень,
2 период – 2 уровня,
3 период – 3 уровня
17.
Энергетические уровни можнообозначать цифрами и буквами:
18.
Каждый уровень содержит различноечисло электронов, т.к. различен по
размеру:
1 уровень – 1-2 е2 уровень – 1 – 8 е3 уровень – 1 – 18 е4 уровень – 1 – 32 е-
19.
Энергетический уровень состоитиз подуровней:
1 уровень —> 1 подуровень (s)
2 уровень —> 2 подуровня (s, p)
3 уровень —> 3 подуровня (s, p, d)
4 уровень —> 4 подуровня (s, p, d, f)
s – орбиталь – форма сферы – одна на каждом
подуровне,
p – орбиталь – форма объемной восьмерки – три на
подуровне,
d – орбиталь – форма листа клевера – пять на
подуровне.
20.
Порядок заполнения электронамиэнергетических уровней и подуровней
осуществляется согласно правил:
Принцип Паули – в атоме не может быть двух
одинаковых электронов. Не: № = 2, N е- = 2, 1s2
Правило Гунда – в пределах подуровня электроны
располагаются таким образом, чтобы суммарное
магнитное спиновое число было максимальным.
Р: № = 15, N е- = 15, 1s22s22p63s23p3
Правило Клечковского – в атоме каждый электрон
располагается так, чтобы его энергия была
минимальной
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p
21.
Строение каждого атома можноотразить с помощью электронной и
электронно-графической формулы:
1s22s22p63s23p03d0 —> электронная формула
1
↑↓
2 ↑↓
↑↓
↑↓ ↑↓
3
↑↓
















 Химия
Химия








