Похожие презентации:
Строение атома
1. СТРОЕНИЕ АТОМА
12.
Строениеатома
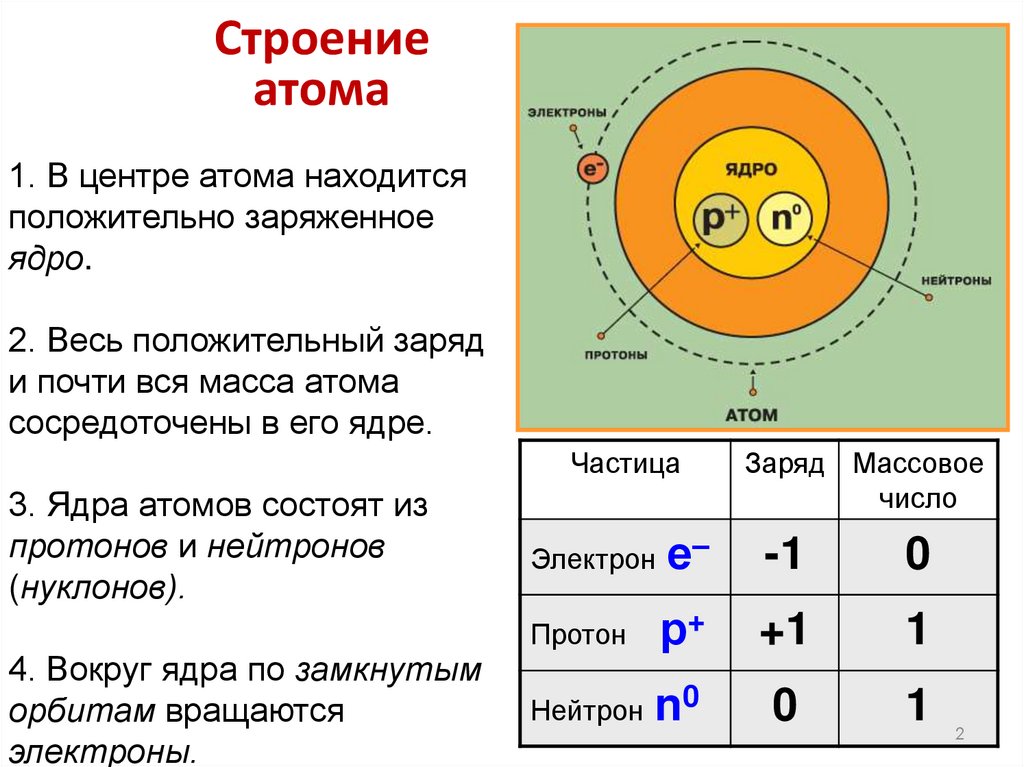
1. В центре атома находится
положительно заряженное
ядро.
2. Весь положительный заряд
и почти вся масса атома
сосредоточены в его ядре.
Частица
3. Ядра атомов состоят из
протонов и нейтронов
(нуклонов).
4. Вокруг ядра по замкнутым
орбитам вращаются
электроны.
Заряд Массовое
число
Электрон е–
-1
0
р+
+1
1
Нейтрон n0
0
1
Протон
2
3.
• Атом – наименьшая электронейтральнаячастица(наименьшая химически
неделимая частица вещества)
химического элемента, состоящая из
положительно заряженного ядра и
отрицательно заряженных электронов,
сохраняющая все свойства этого элемента.
3
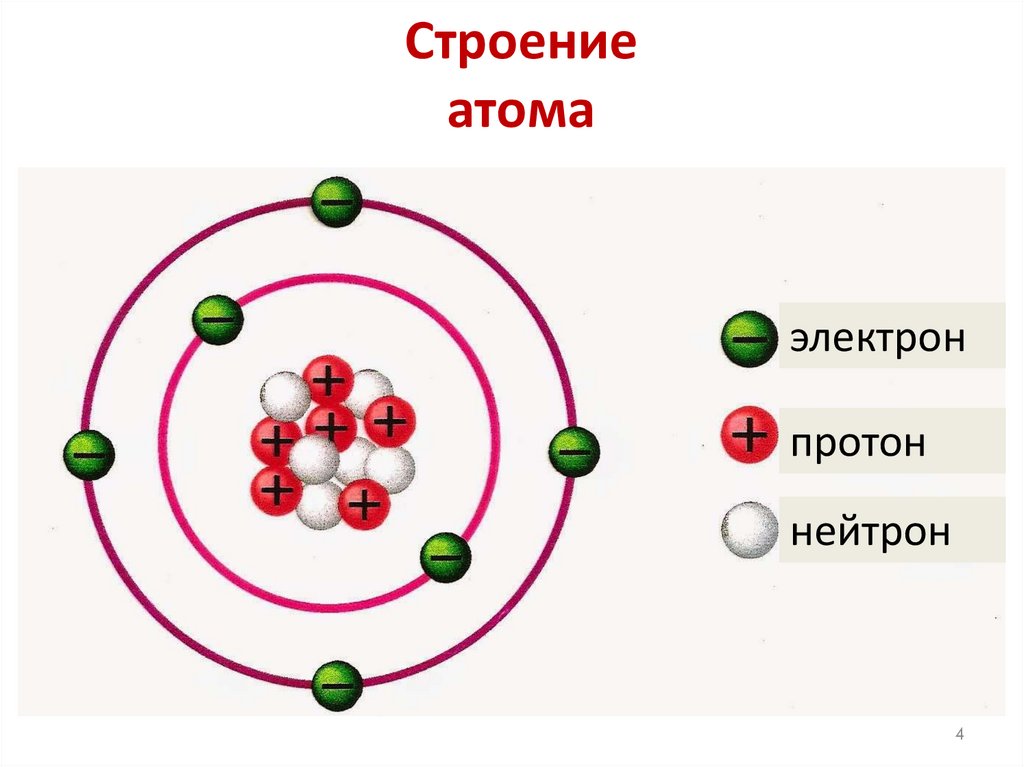
4. Строение атома
электронпротон
нейтрон
4
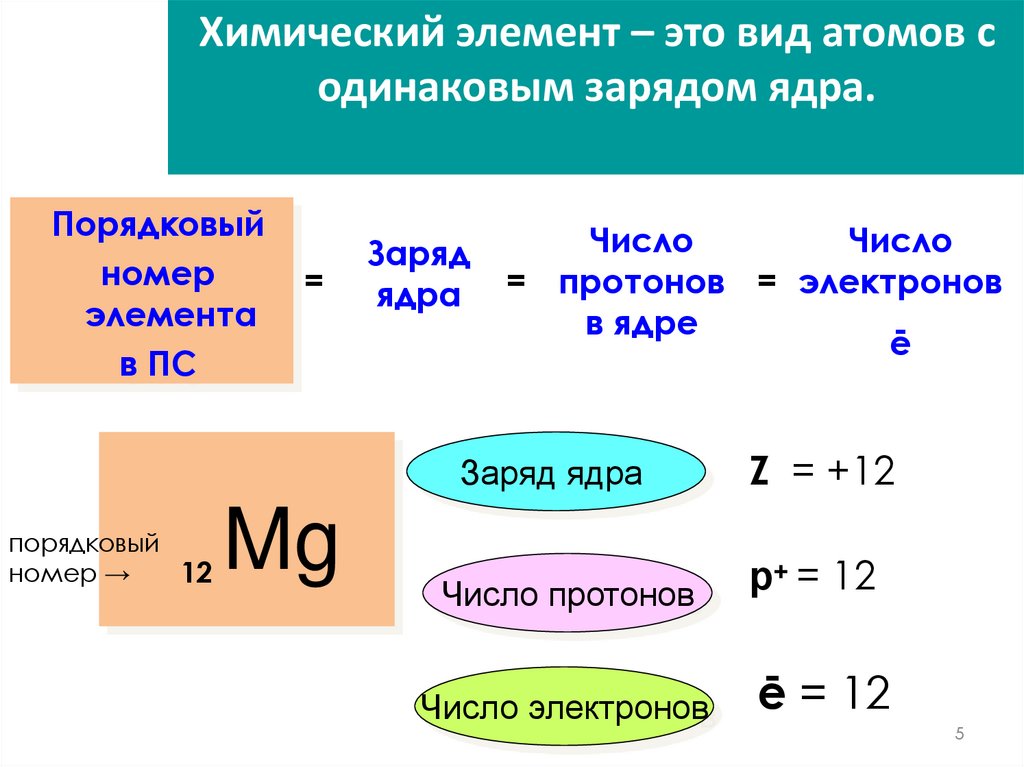
5.
Химический элемент – это вид атомов содинаковым зарядом ядра.
Порядковый
номер
элемента
в ПС
порядковый
номер →
12
=
Mg
Заряд
ядра
Число
Число
= протонов = электронов
в ядре
ē
Заряд ядра
Z = +12
Число протонов
р+ = 12
Число электронов
ē = 12
5
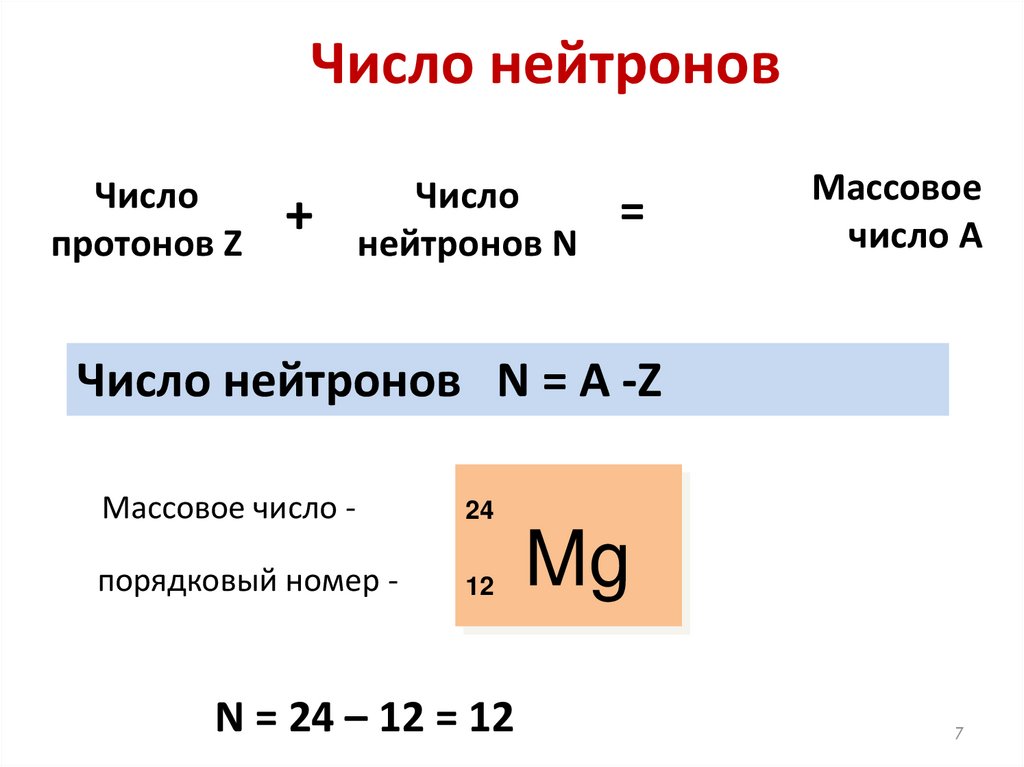
6. Число нейтронов
В атомах одного химического элементачисло
протонов р+ всегда одинаково (равно
заряду ядра Z), а число нейтронов N
бывает разным.
6
7.
Число нейтроновЧисло
протонов Z
+
Число
нейтронов N
=
Массовое
число А
Число нейтронов N = A -Z
Массовое число -
24
порядковый номер -
12
N = 24 – 12 = 12
Mg
7
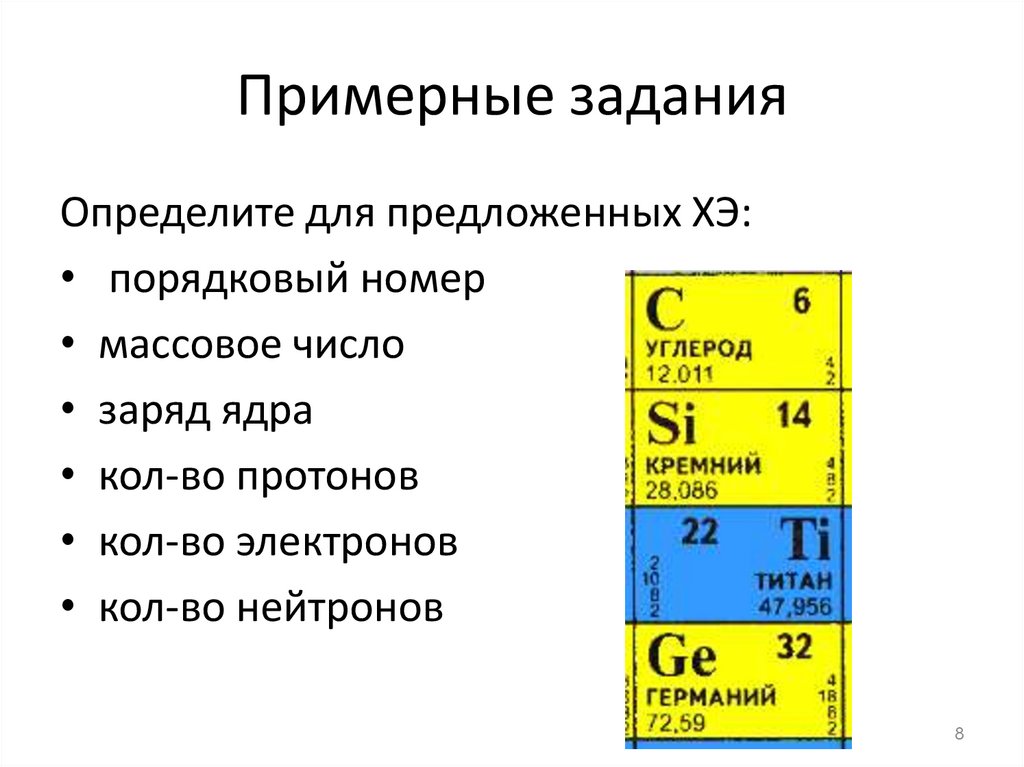
8. Примерные задания
Определите для предложенных ХЭ:• порядковый номер
• массовое число
• заряд ядра
• кол-во протонов
• кол-во электронов
• кол-во нейтронов
8
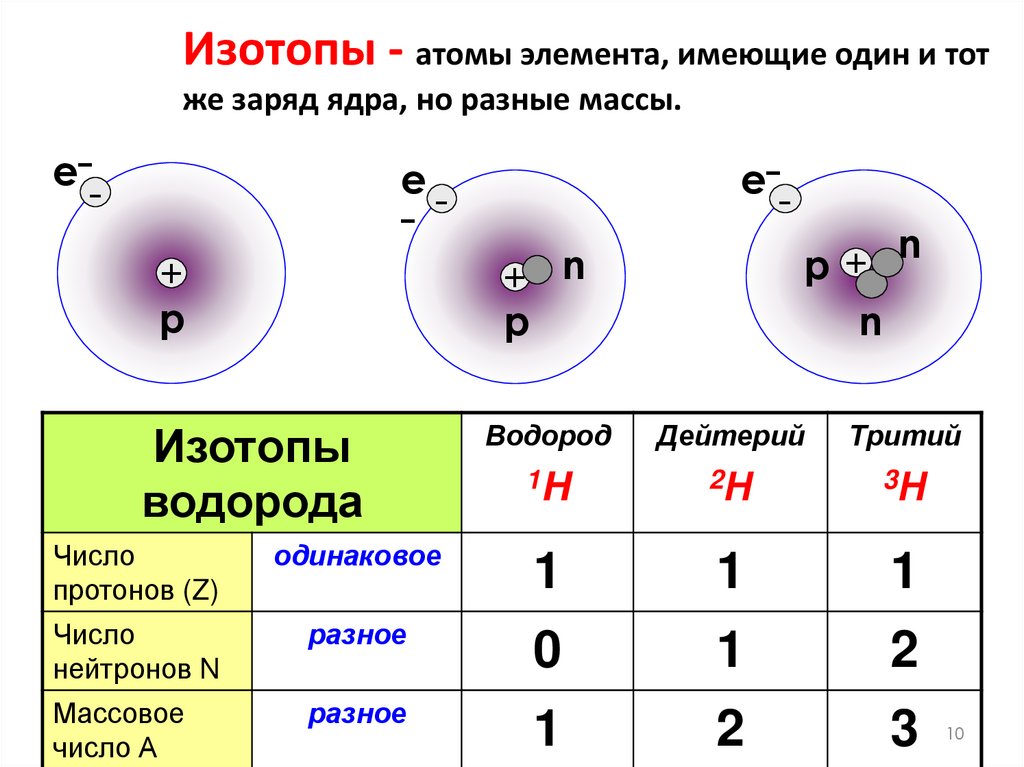
9. ИЗОТОПЫ
• Изотопы-это атомы одного и того жехимического элемента, имеющие
одинаковый заряд ядра(атомный номер),
но разные массовые числа.
• Название и символы изотопов совпадают с
названиями и символами соответствующих
элементов.
9
10.
Изотопы - атомы элемента, имеющие один и тотже заряд ядра, но разные массы.
е–
-
е
–
е–
-
-
р+
n
n
+
р
+ n
р
Изотопы
водорода
Водород
Дейтерий
Тритий
1H
2Н
3Н
Число
протонов (Z)
одинаковое
1
1
1
Число
нейтронов N
разное
0
1
2
Массовое
число А
разное
1
2
3
10
11.
Изотопы хлора35
Сl
37
75%
25%
17
17
Сl
Ar = 0.75 * 35 + 0.25 * 37 = 35.5
12. Изобары и изотоны
• Изобары-атомы с различными протоннымичислами, но с одинаковыми массовыми
числами.
Например:40 18Ar (18p, 22n) и
40 K(19p,
19
21n).
• Изотоны-атомы с одинаковым числом
нейтронов.
Например: 136 54 Xe(54p,82n) и
138
56 Ba(56p,82n)
13.
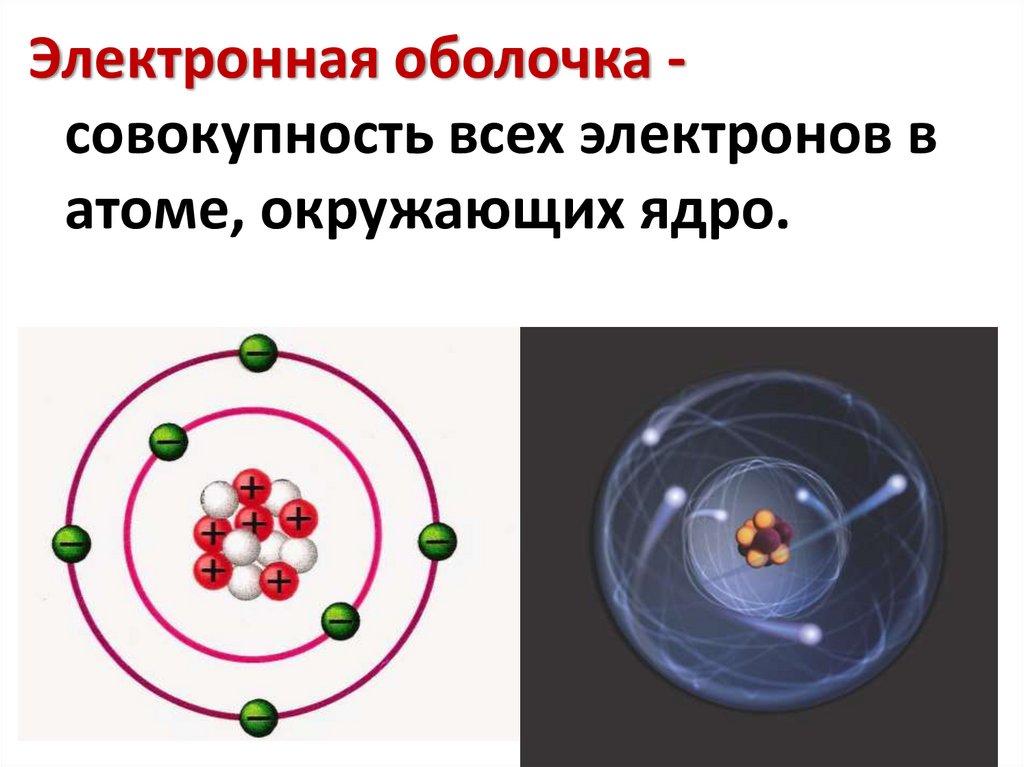
Электронная оболочка совокупность всех электронов ватоме, окружающих ядро.
13
14. Электронная оболочка
• Электрон в атоме находится в связанномсостоянии с ядром и обладает энергией,
которая определяет энергетическиий уровень,
на котором находится электрон.
14
15.
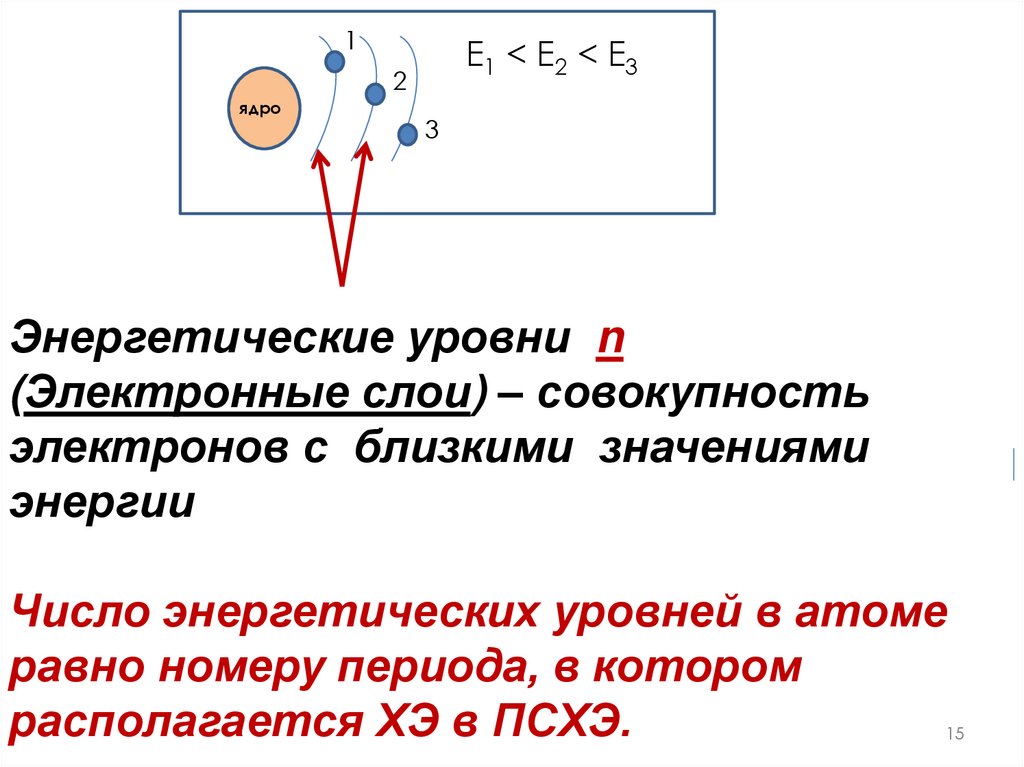
1Е1 < E2 < E3
2
ядро
3
Энергетические уровни n
(Электронные слои) – совокупность
электронов с близкими значениями
энергии
Число энергетических уровней в атоме
равно номеру периода, в котором
располагается ХЭ в ПСХЭ.
15
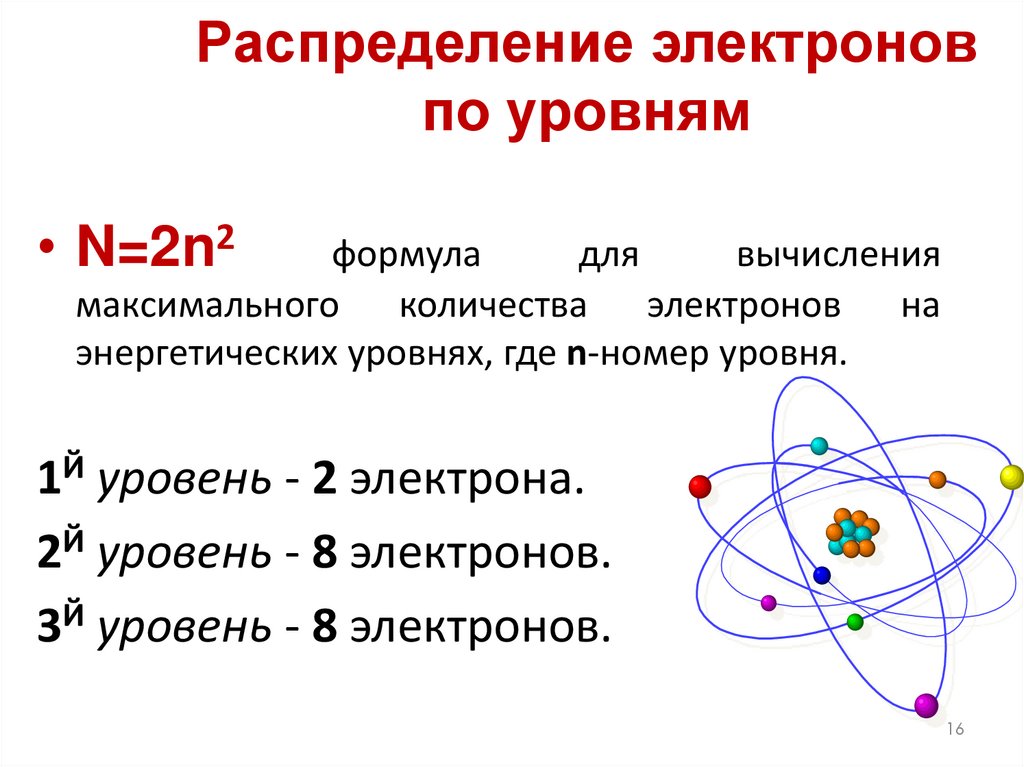
16. Распределение электронов по уровням
• N=2n2формула
для
вычисления
максимального количества электронов на
энергетических уровнях, где n-номер уровня.
1Й уровень - 2 электрона.
2Й уровень - 8 электронов.
3Й уровень - 8 электронов.
16
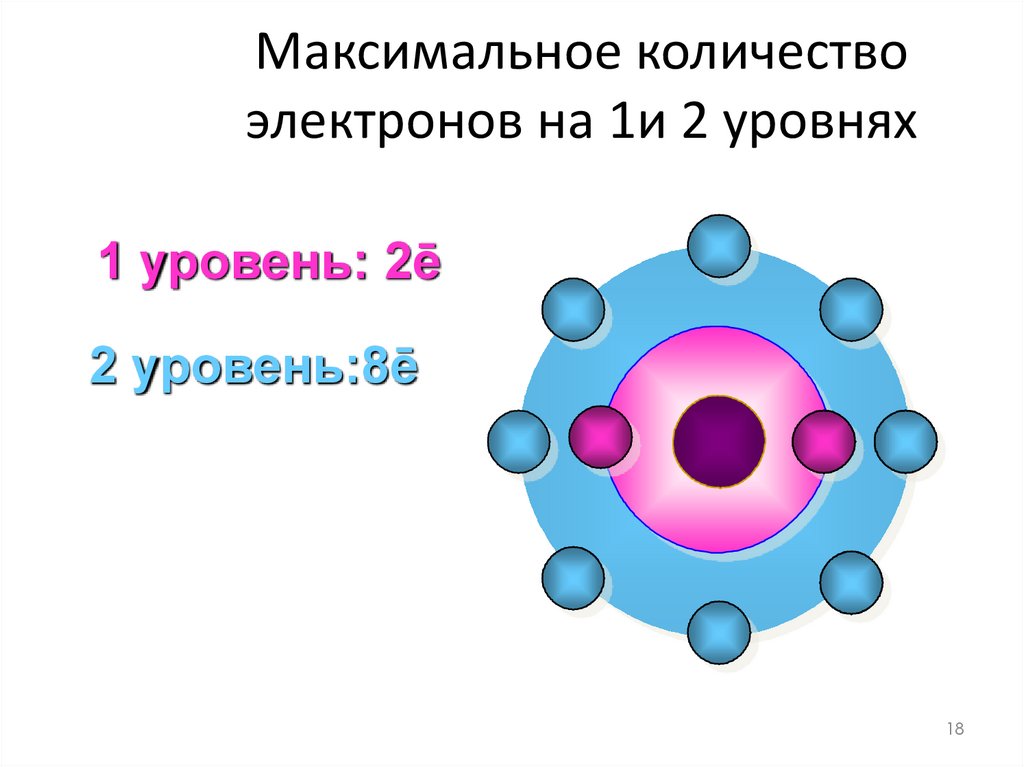
17. Максимальное количество электронов на 1 уровне
1 уровень: 2ē17
18.
Максимальное количествоэлектронов на 1и 2 уровнях
1 уровень: 2ē
2 уровень:8ē
18
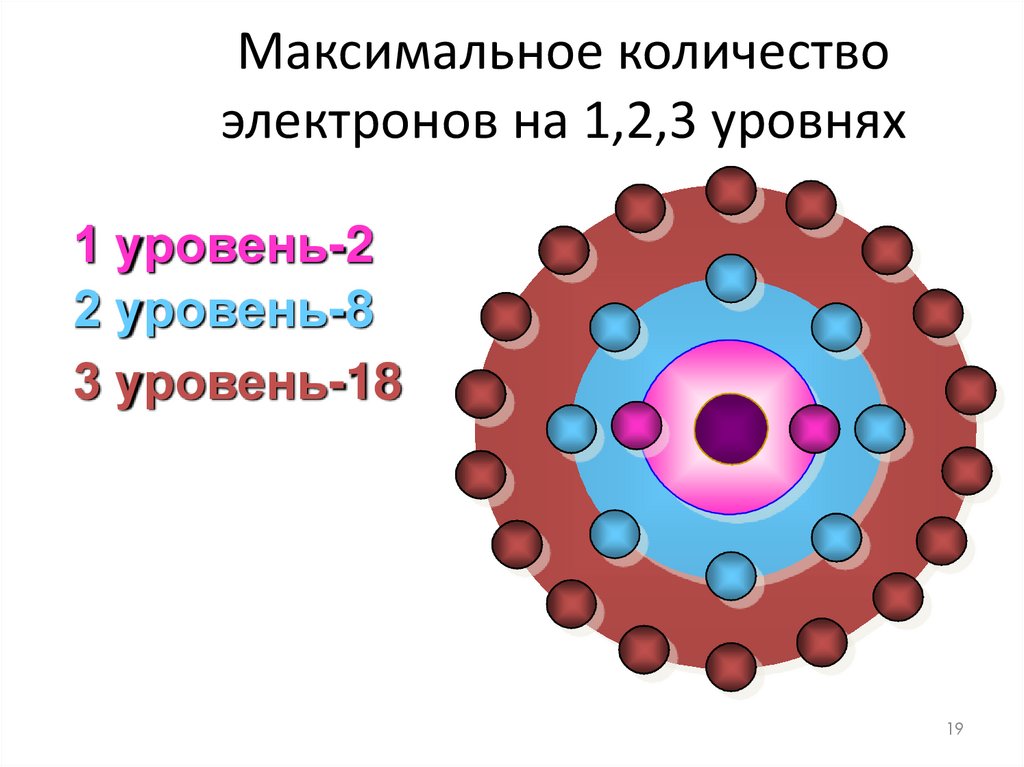
19. Максимальное количество электронов на 1,2,3 уровнях
1 уровень-22 уровень-8
3 уровень-18
19
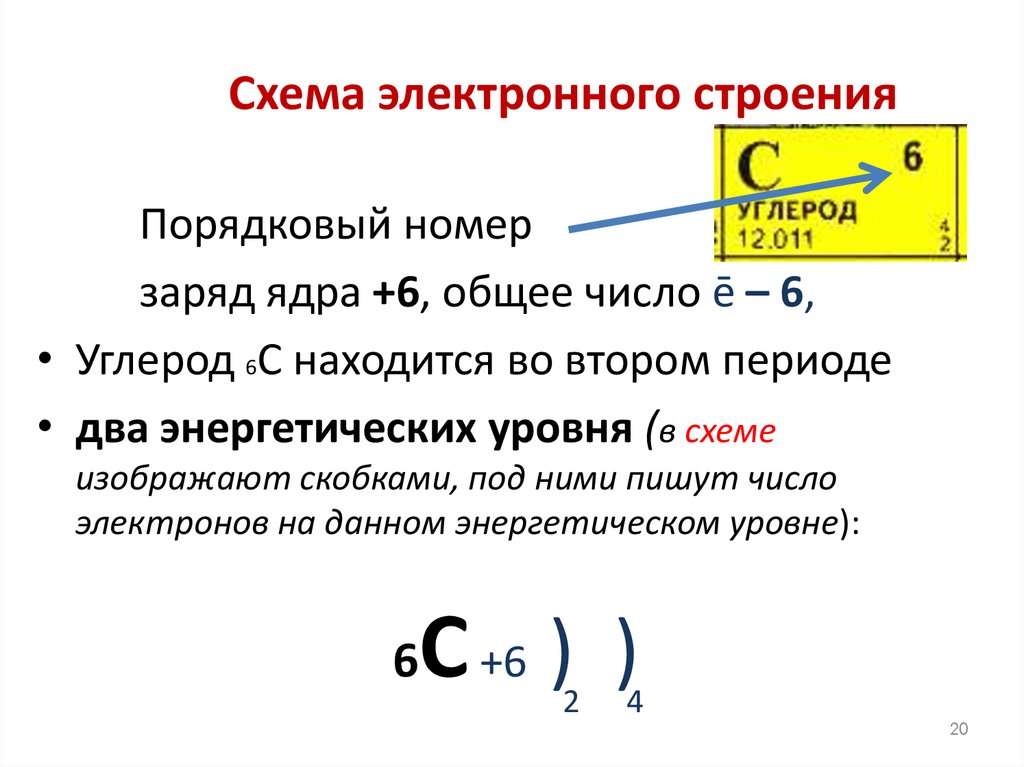
20. Схема электронного строения
Порядковый номерзаряд ядра +6, общее число ē – 6,
• Углерод 6С находится во втором периоде
• два энергетических уровня (в схеме
изображают скобками, под ними пишут число
электронов на данном энергетическом уровне):
С +6 ) )
6
2
4
20
21.
• Энергетические уровни,содержащие максимальное число
электронов, называются
завершенными.
Они обладают повышенной
устойчивостью и стабильностью
• Энергетические уровни,
содержащие меньшее число
электронов, называются
незавершенными
21
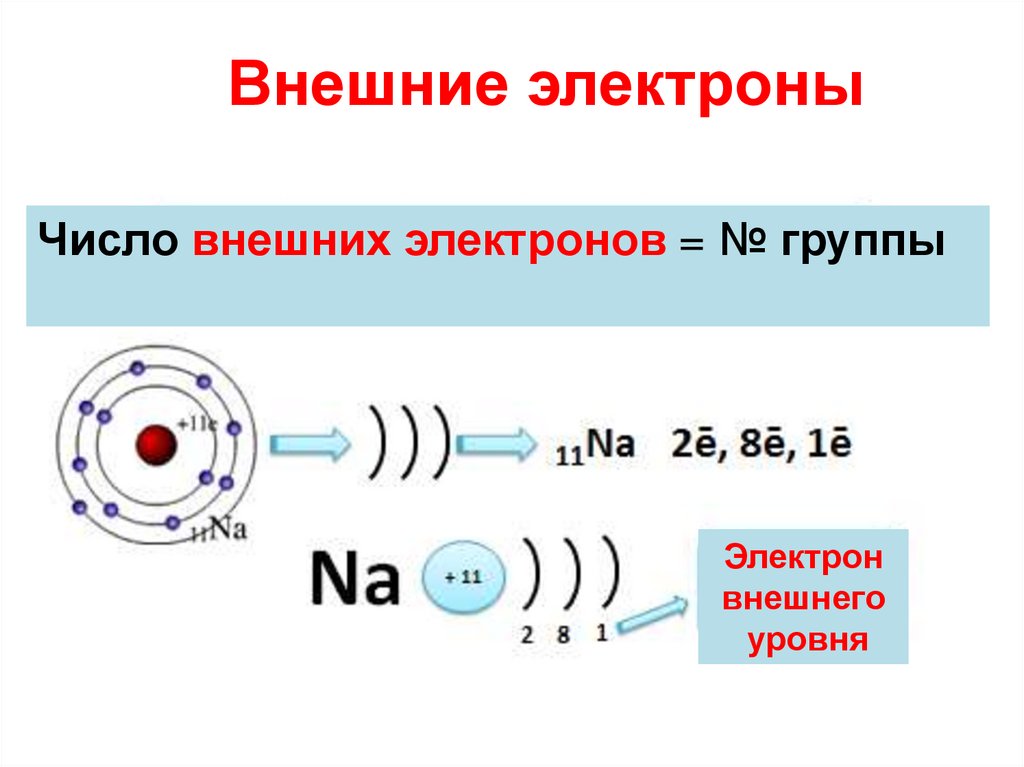
22. Внешние электроны
Число внешних электронов = № группыЭлектрон
внешнего
уровня
22
23. Строение энергетических уровней
Каждый энергетический уровеньсостоит из подуровней: s, p, d, f.
Подуровень состоит из орбиталей.
Электронная орбиталь - область
наиболее вероятного
местонахождения электрона в
пространстве
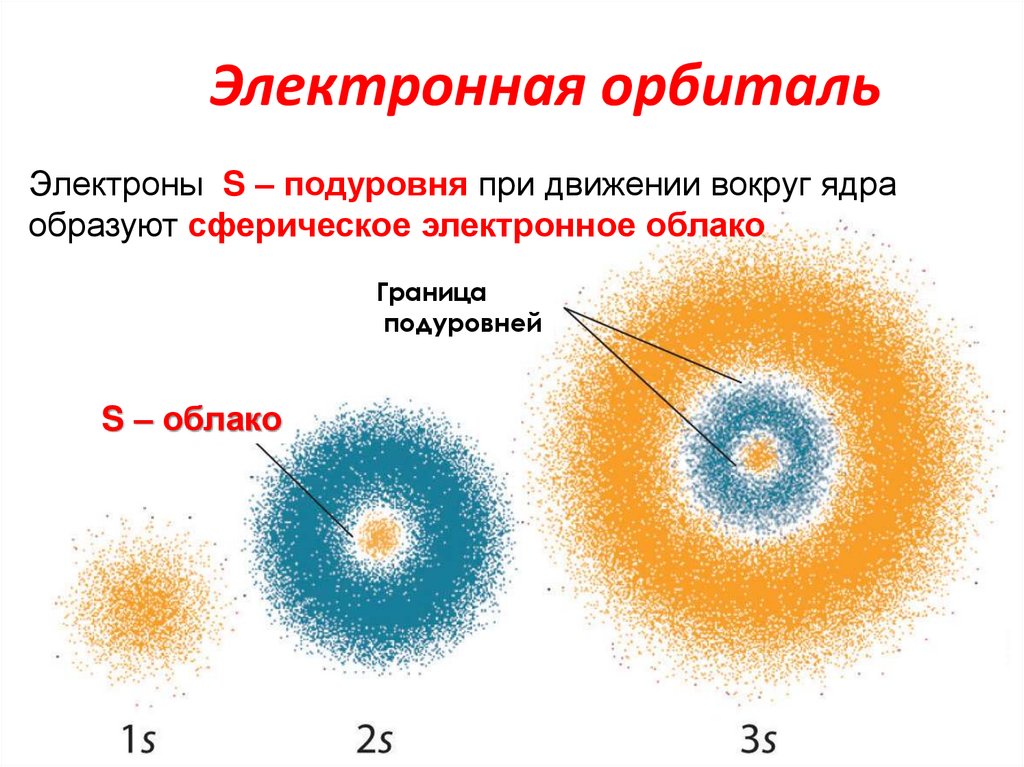
24. Электронная орбиталь
Электроны S – подуровня при движении вокруг ядраобразуют сферическое электронное облако
Граница
подуровней
S – облако
24
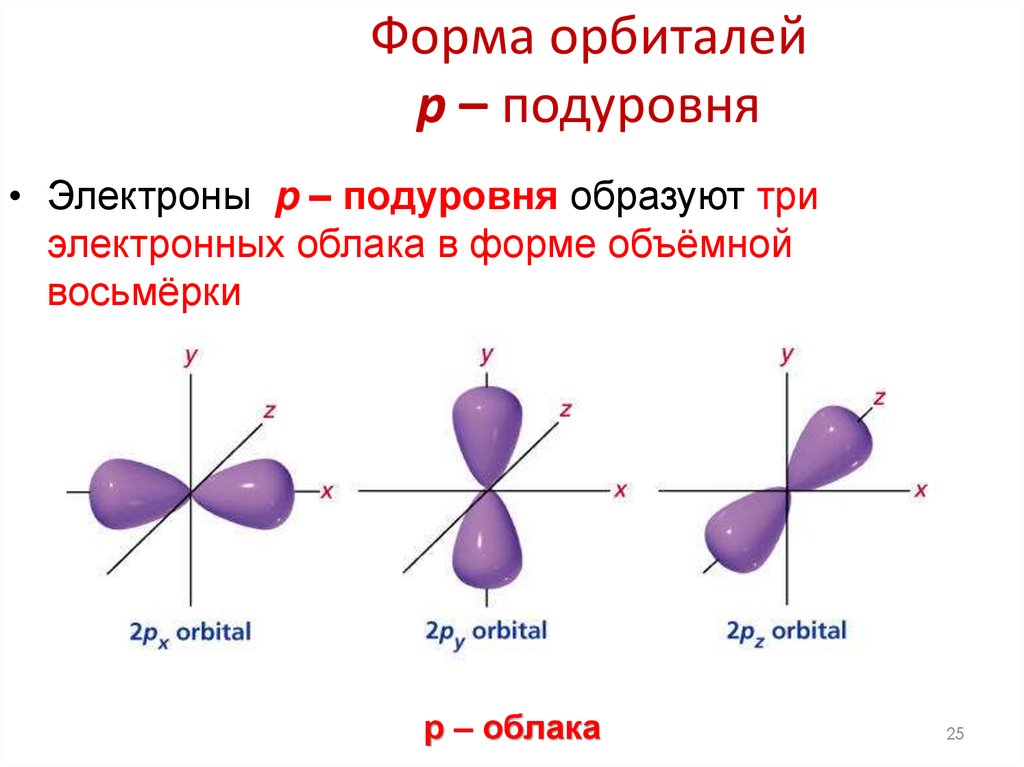
25. Форма орбиталей p – подуровня
• Электроны p – подуровня образуют триэлектронных облака в форме объёмной
восьмёрки
р – облака
25
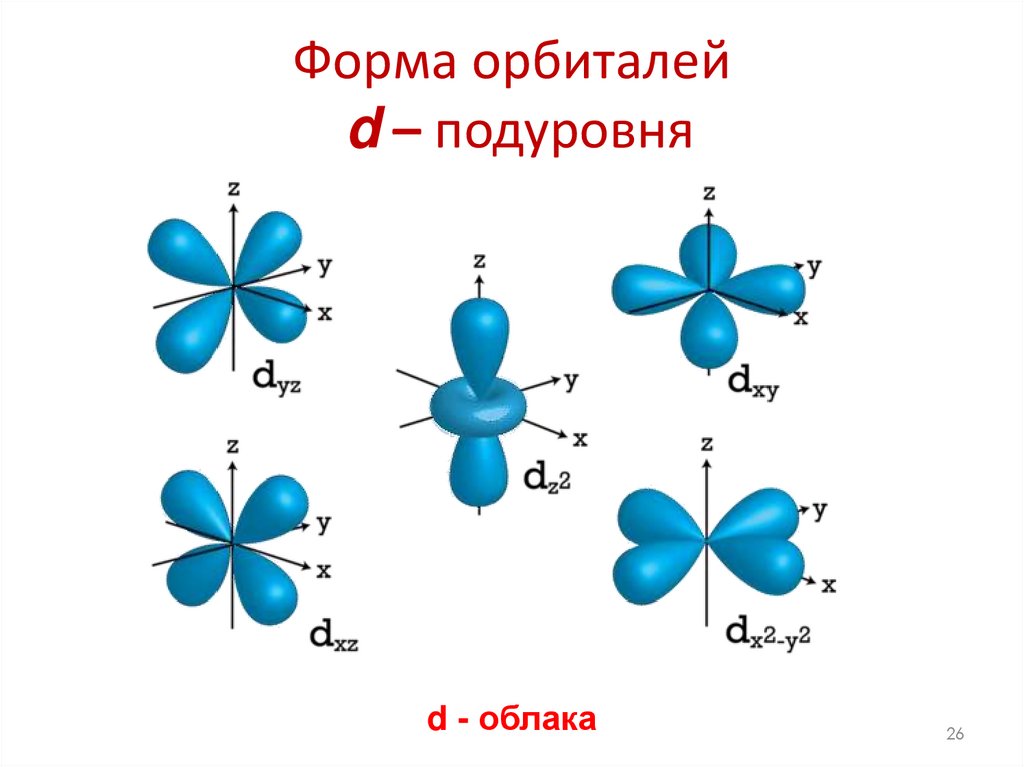
26. Форма орбиталей d – подуровня
d - облака26
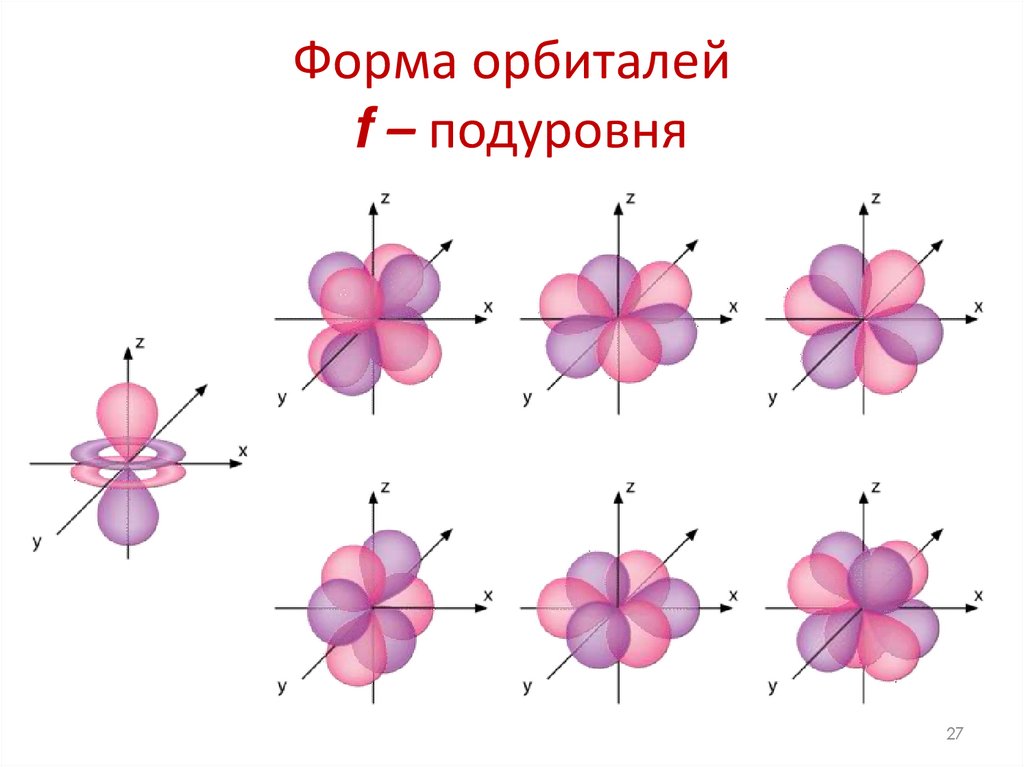
27. Форма орбиталей f – подуровня
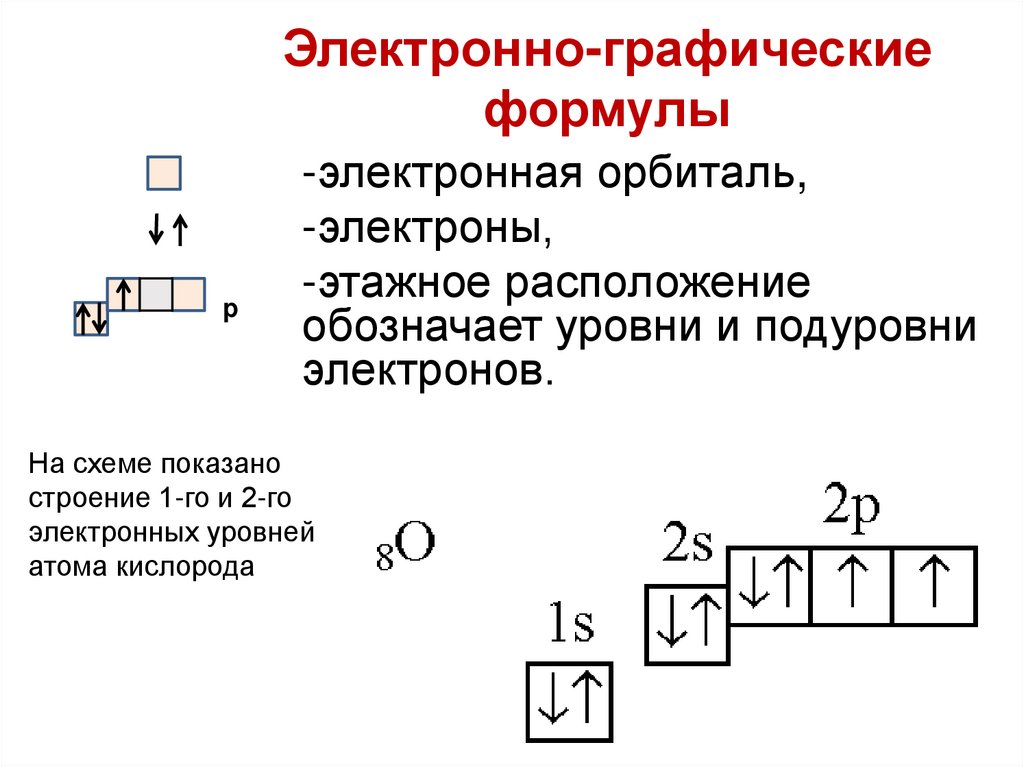
2728. Электронно-графические формулы
p-электронная орбиталь,
-электроны,
-этажное расположение
обозначает уровни и подуровни
электронов.
На схеме показано
строение 1-го и 2-го
электронных уровней
атома кислорода
28
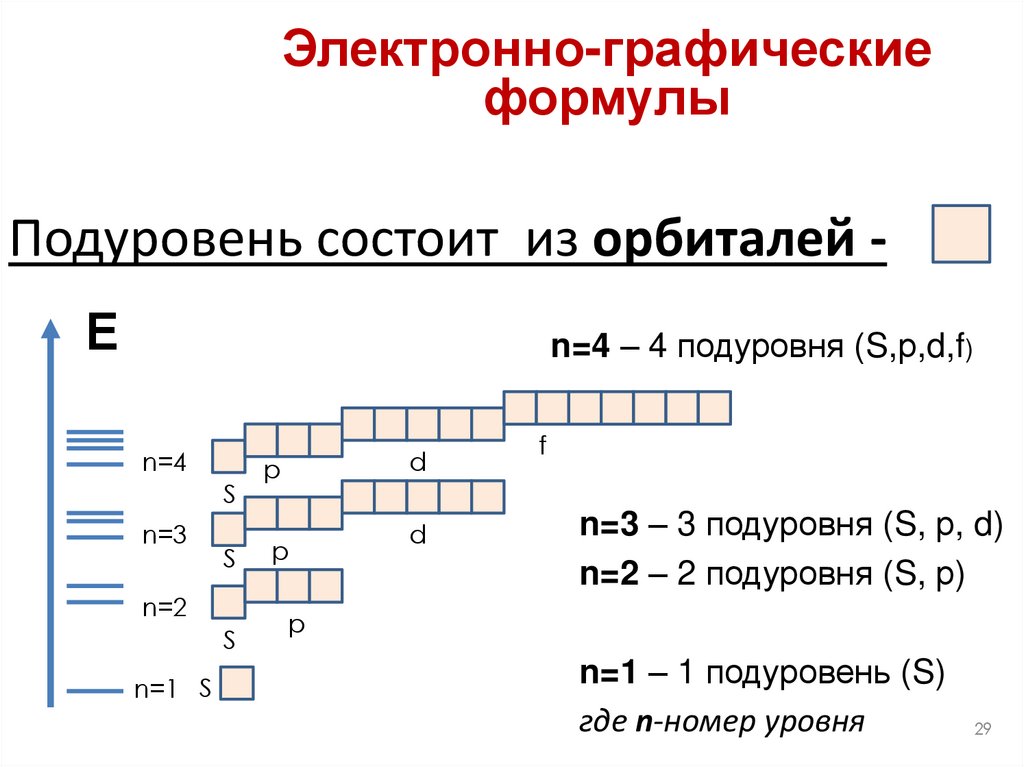
29.
Электронно-графические формулыЭлектронно-графические
формулы
Подуровень состоит из орбиталей Е
n=4 – 4 подуровня (S,р,d,f)
n=4
S
n=3
S
n=2
S
n=1 S
d
p
p
d
f
n=3 – 3 подуровня (S, р, d)
n=2 – 2 подуровня (S, р)
p
n=1 – 1 подуровень (S)
где n-номер уровня
29
30. Правила заполнения энергетических уровней
1) Запрет Паули•На одной АО могут находится не более, чем два
электрона, которые должны иметь различные
спины.
Разрешено
Запрещено!
В атоме не может быть двух электронов с
одинаковым набором всех четырех
квантовых чисел.
30
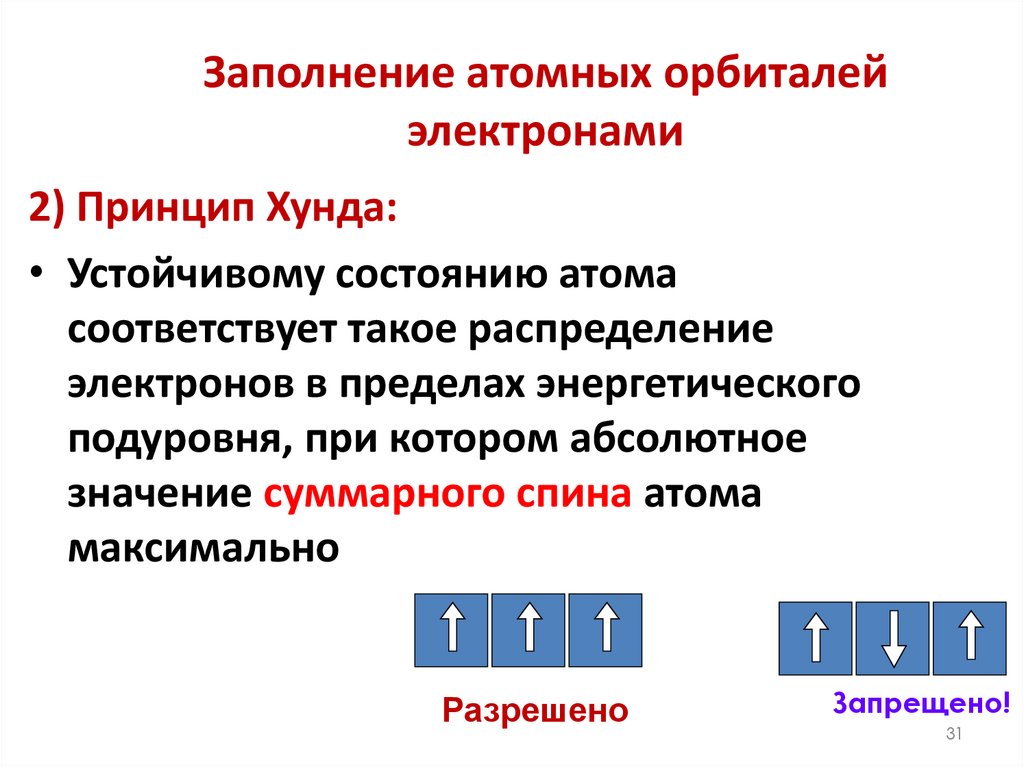
31. Заполнение атомных орбиталей электронами
2) Принцип Хунда:• Устойчивому состоянию атома
соответствует такое распределение
электронов в пределах энергетического
подуровня, при котором абсолютное
значение суммарного спина атома
максимально
Разрешено
Запрещено!
31
32. Заполнение атомных орбиталей электронами
3) Принцип устойчивости Клечковского.АО заполняются электронами в порядке
повышения энергии их энергетических
уровней.
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d
32
33.
ЭЛЕКТРОННАЯ ФОРМУЛАПример: Углерод, №6, период II,
группа IVA.
Схема электронного
строение атома
С+6 ) )
2 4
Электронная формула: 1s2 2s22p2
33
34. Алгоритм составления электронных формул.
Записываем знак химического элемента и зарядядра его атома (№ элемента).
Определяем количество энергетических уровней
(№ периода) и количество электронов на каждом
уровне.
Составляем электронную формулу, учитывая
номер уровня, вид орбитали и количество
электронов на ней (принцип Клечковского).
34
35. Алгоритм составления электронных формул.
Н+1n=1
1
S
1 S1
НЕСПАРЕННЫЙ ЭЛЕТРОН
Одиночный электрон на
незавершенной оболочке
Нe + 2
n=1
2
S
1 S2
2 спаренных электрона на
завершенной оболочке
S - элементы
35
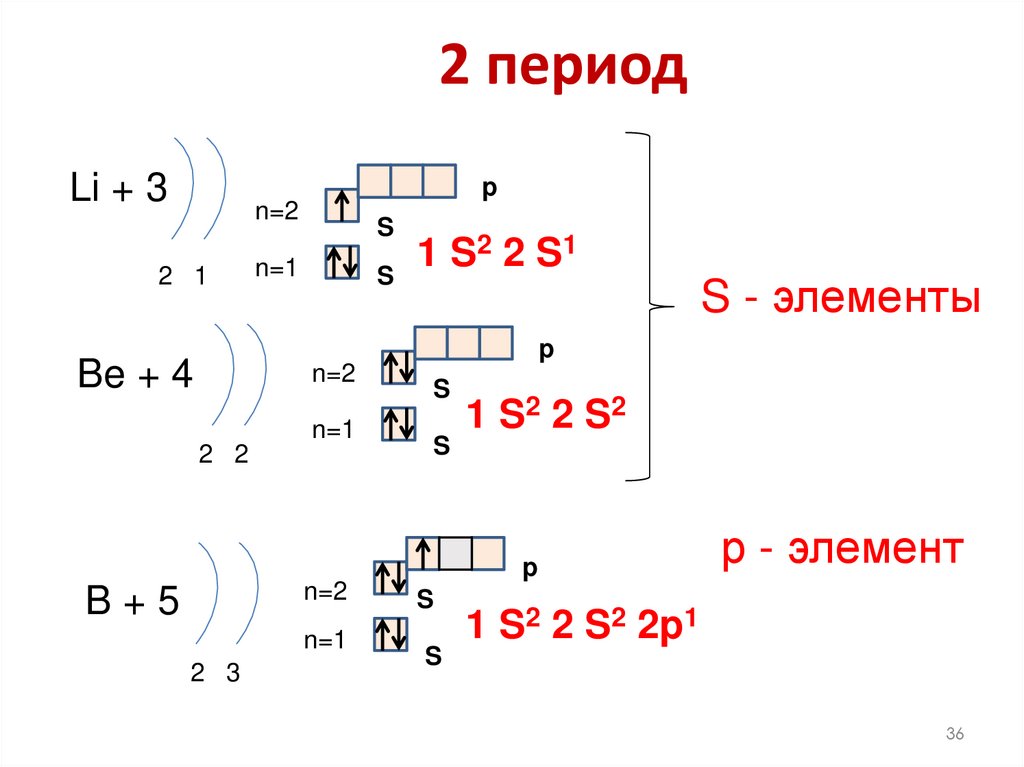
36. 2 период
Li + 3p
n=2
2 1
S
2 2 S1
1
S
S
n=1
S - элементы
p
Be + 4
n=2
n=1
2 2
S
S
1 S2 2 S 2
p
n=2
B+5
n=1
2 3
S
S
р - элемент
1 S2 2 S2 2p1
36
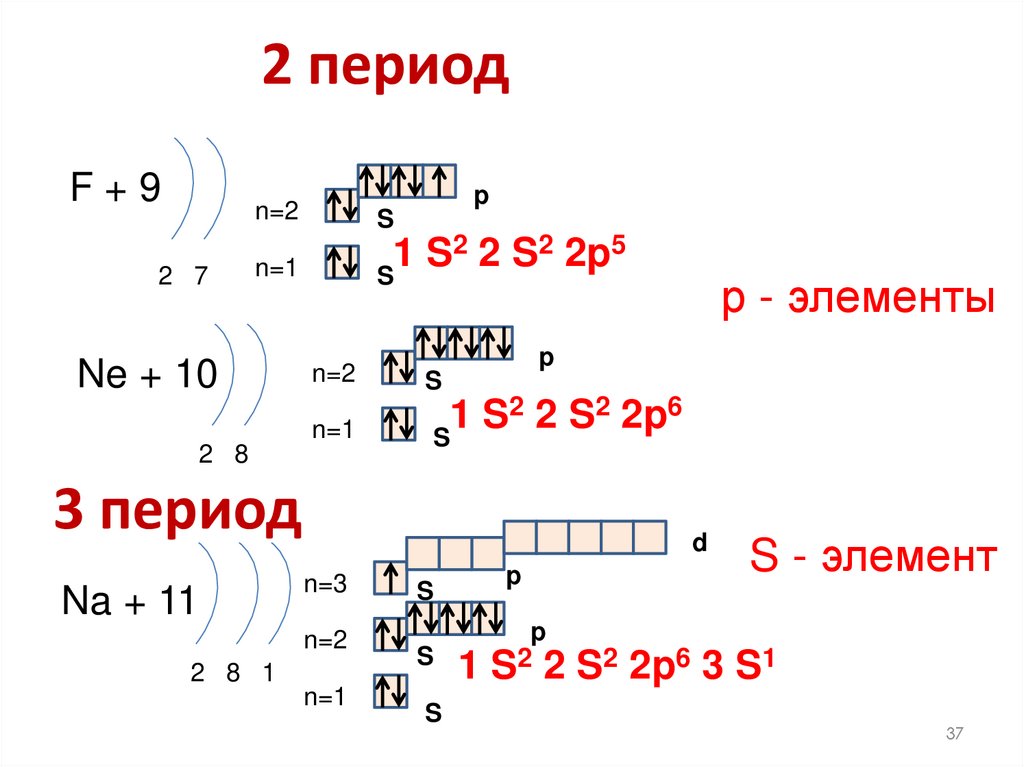
37. 2 период
F+92 7
p
n=2
S
n=1
2 2 S2 2p5
1
S
S
Ne + 10
p
n=2
S
n=1
2 2 S2 2p6
1
S
S
2 8
3 период
Na + 11
р - элементы
d
p
S - элемент
n=3
S
n=2
p
S
1 S2 2 S2 2p6 3 S1
2 8 1
n=1
S
37
38. Выводы
Строение внешних энергетическихуровней периодически повторяется,
поэтому периодически повторяются
и свойства химических элементов.
38
39. Строение атома марганца:
Mn +25) ) ) )
2
8
13
2
d - элемент
1s22s22p63s23p64s23d54p0
основное состояние атома
возбужденное состояние атома
39
40. Ионы
• Ион – положительно или отрицательнозаряженная частица, образованная при
отдаче или присоединении атомом или
группой атомов одного или нескольких
электронов
• Катион – (+) заряженная частица, Kat
• Анион – (-) заряженная частица, An
40
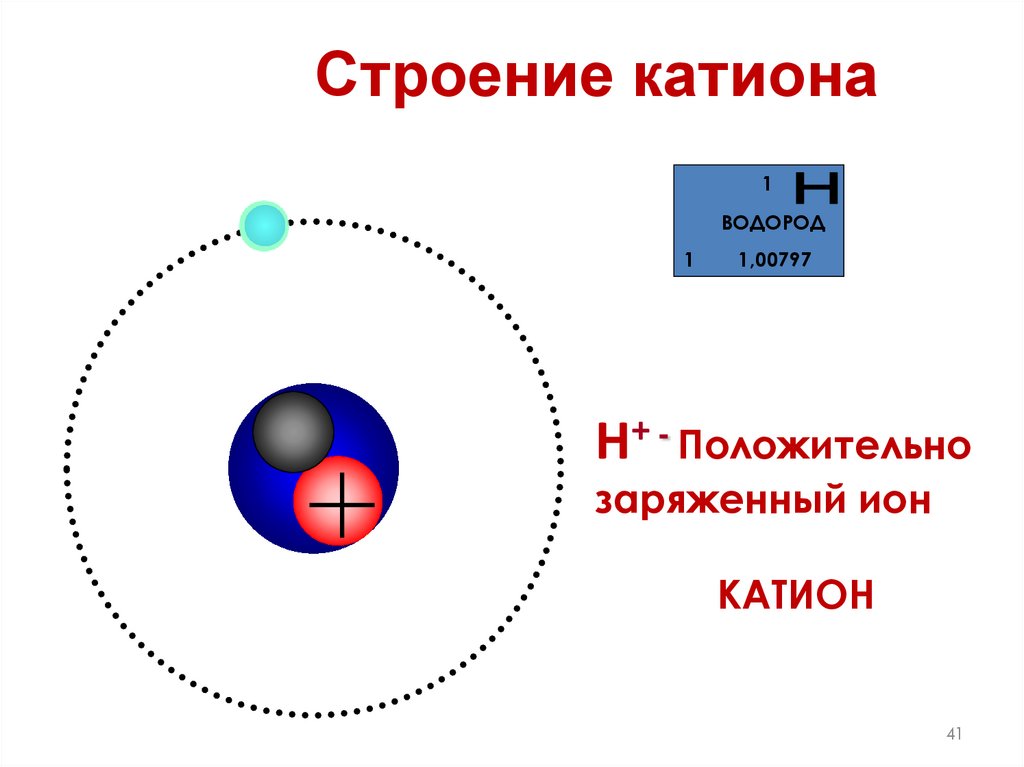
41. Строение катиона
1ВОДОРОД
1
1,00797
Н+ - Положительно
заряженный ион
КАТИОН
41
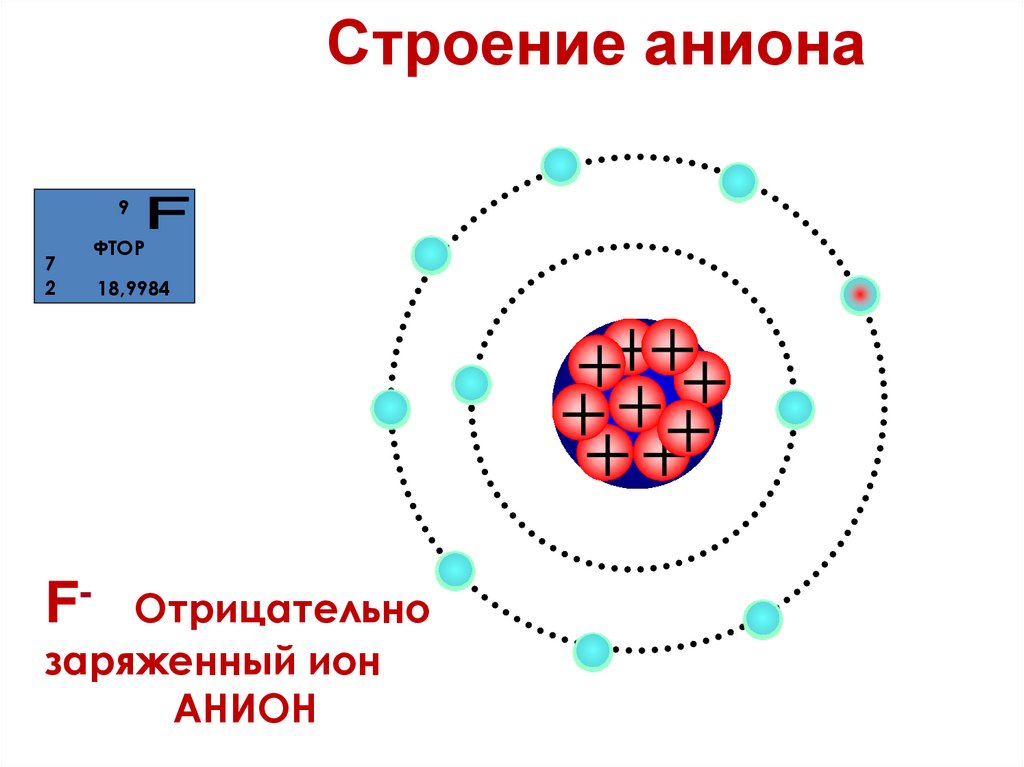
42.
Строение аниона9
7
2
F-
ФТОР
18,9984
Отрицательно
заряженный ион
АНИОН
43. ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА
1. Положение в ПСХЭ (порядковый номер,относительная атомная масса, период (какой),
группа и подгруппа).
2. Состав ядра атома, общее число электронов в
электронной оболочке, схема строения
электронной оболочки.
3. Металл, неметалл, переходный металл.
4. Сравнение металлических (неметаллических)
свойств с соседними по периоду и подгруппе
элементами.
5. Электроотрицательность, то есть сила
притяжения электронов к ядру.
43



















 Химия
Химия








