Похожие презентации:
Сера. Элемент 16-й группы, третьего периода таблицы
1.
Сера2.
SЭлемент 16-й группы, третьего
периода таблицы, с атомным
номером 16. Неметалл.
Обозначается символом S. В
водородных и кислородных
соединениях находится в
составе различных ионов,
образует многие кислоты и
соли. Практически
нерастворима в воде. Многие
серосодержащие соли
малорастворимы в воде.
3.
АллотропияЯвление, при котором
один химический
элемент образует
несколько простых
веществ.
Аллотропия происходит
из-за разного строения
или разного количества
атомов
4.
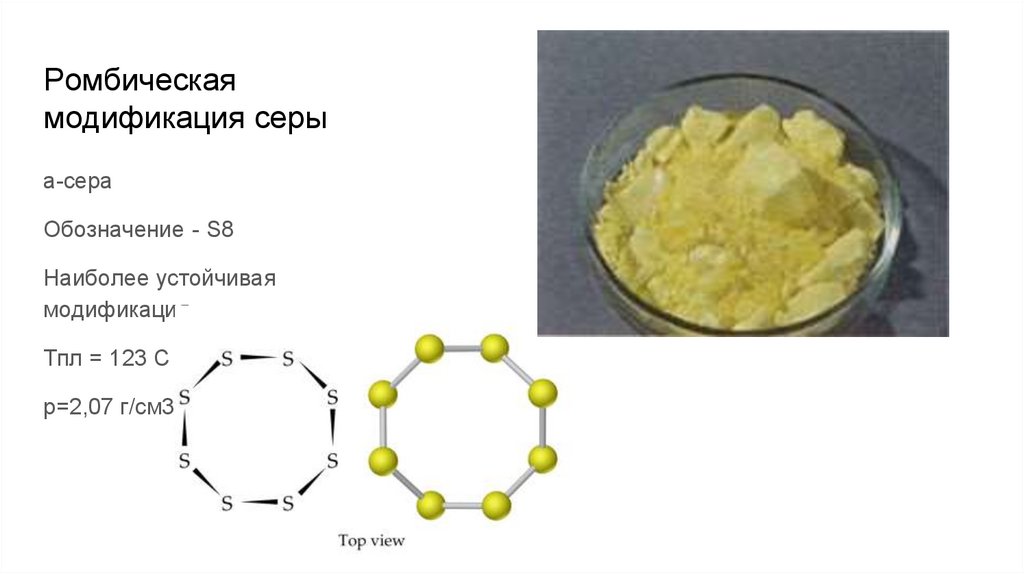
Ромбическаямодификация серы
а-сера
Обозначение - S8
Наиболее устойчивая
модификация
Тпл = 123 С
p=2,07 г/см3
5.
Моноклиннаясера
b-сера
Устойчива только при
темепературах 96+ С. Иначе
превращается в ромбическую
Tпл=119 С
p=1,96 г/см3
6.
Пластическая сераКоричневая резиноподобная
(аморфная) масса.
Неустойчива, при
затвердевании
превращается в
ромбическую.
*Видео на флешке*
7.
Получение серы1.
Промышленный
метод - выплавление из руды с
помощью водяного пара.
2.
Неполное
окисление сероводорода (при
недостатке кислорода).
2)2H2S + O2 = 2S + 2H2O
3.
Реакция
Вакенродера
3)2H2S + SO2 = 3S + 2H2O
8.
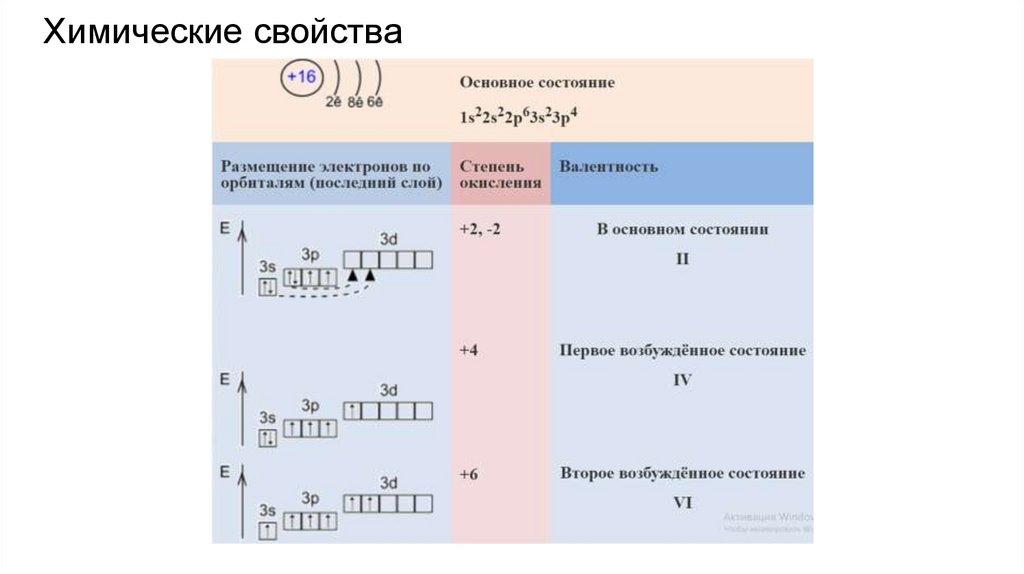
Химические свойства9.
Сера какокислитель
1) Реагирует с
щелочными металлами
без нагревания (кроме
Au и Pt)
2) С остальными
реагирует при
повышенной
температуре
3) Образует бинарные
соединения с
некоторыми
неметаллами
1)2Na + S -> Na2S
2) 2Al + 3S –t°-> Al2S3
Zn + S –t°-> ZnS
Cu + S –t°-> CuS
3)H2 + S -> H2S
2P + 3S -> P2S3
C + 2S -> CS2
10.
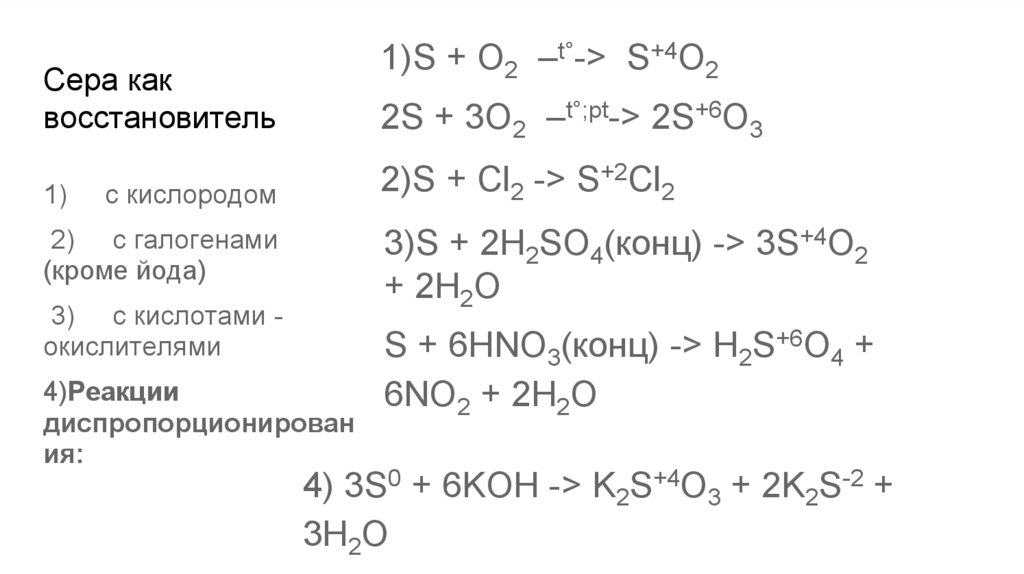
1)S + O2 –t°-> S+4O2Сера как
восстановитель
1)
2S + 3O2 –t°;pt-> 2S+6O3
2)S + Cl2 -> S+2Cl2
c кислородом
3)S + 2H2SO4(конц) -> 3S+4O2
+ 2H2O
2) c галогенами
(кроме йода)
3) c кислотами окислителями
4)Реакции
диспропорционирован
ия:
S + 6HNO3(конц) -> H2S+6O4 +
6NO2 + 2H2O
4) 3S0 + 6KOH -> K2S+4O3 + 2K2S-2 +
3H2O







 Химия
Химия








