Похожие презентации:
Термодинамические процессы. Политропные процессы
1. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
ПОЛИТРОПНЫЕ ПРОЦЕССЫ2.
Просмотр ролика:Основные законы термодинамики. Часть 2
(вторая половина – термодинамические
процессы)
Проверочный тест по основным
термодинамическим процессам
3. ПОЛИТРОПНЫЕ ПРОЦЕССЫ
Определение процесса:Политропные процессы – это процессы
изменения состояния термодинамической
системы, при которых доля тепла, идущая на
изменение внутренней энергии величина
постоянная.
Политропные процессы – это реально
существующие в природе процессы
4.
φ = u / q = constα = 1- φ (α = u / l),где
φ – доля тепла, идущая на изменение
внутренней энергии,
α – доля тепла, идущая на совершение
работы.
v = const
р = const
pv = const
φ = cv (Т2 – Т1) / cv (Т2 - Т1) = 1,
α=0
φ = cv (Т2 – Т1) / cр (Т2 - Т1) = cv /cр = 5/7,
φ = 0/ q = 0, α = 1
рvk = соnst
φ = q /0 = 0, α = ∞
α = 2/7
5.
Уравнение процесса:рvn = соnst
n- показатель политропы
v = const
n = ∞ (р 1/nv= соnst, р 1/n= 1, n = ∞)
р = const
n =0
pv = const
n =1
рvk = соnst
n =k
Для определения показателя политропы в процессе применяется
формула: (р1 v1n = р2 v2n
р1/ р2 = (v2 / v1)n )
n=
6.
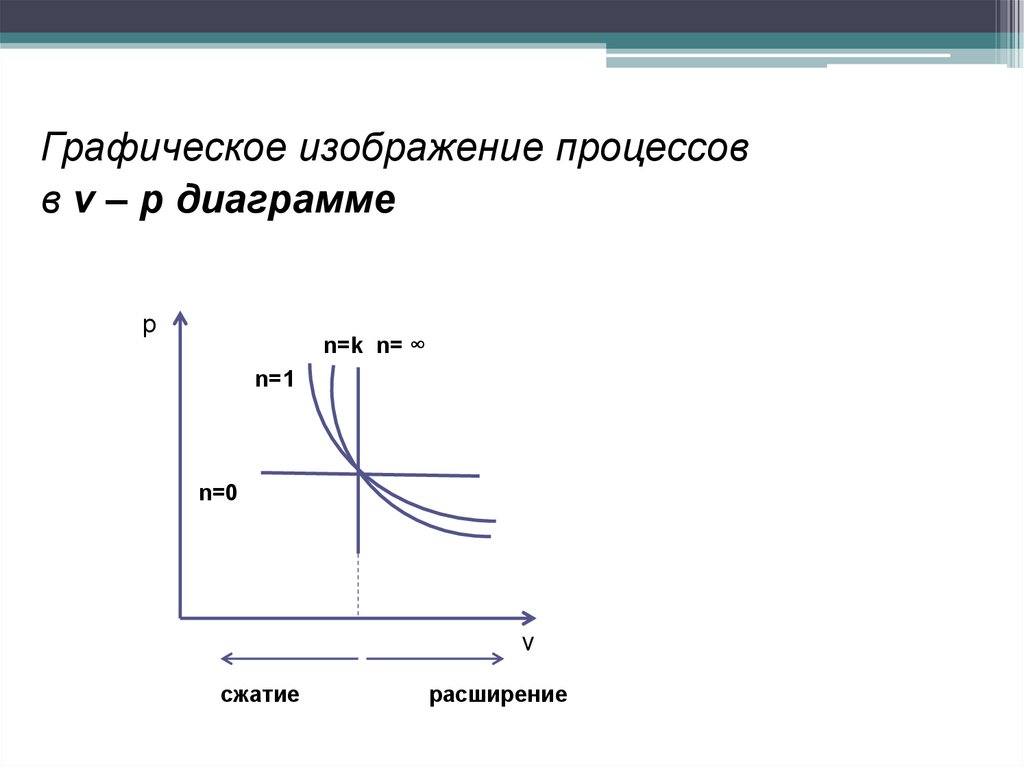
Графическое изображение процессовв v – p диаграмме
р
n=k n= ∞
n=1
n=0
v
сжатие
расширение
7.
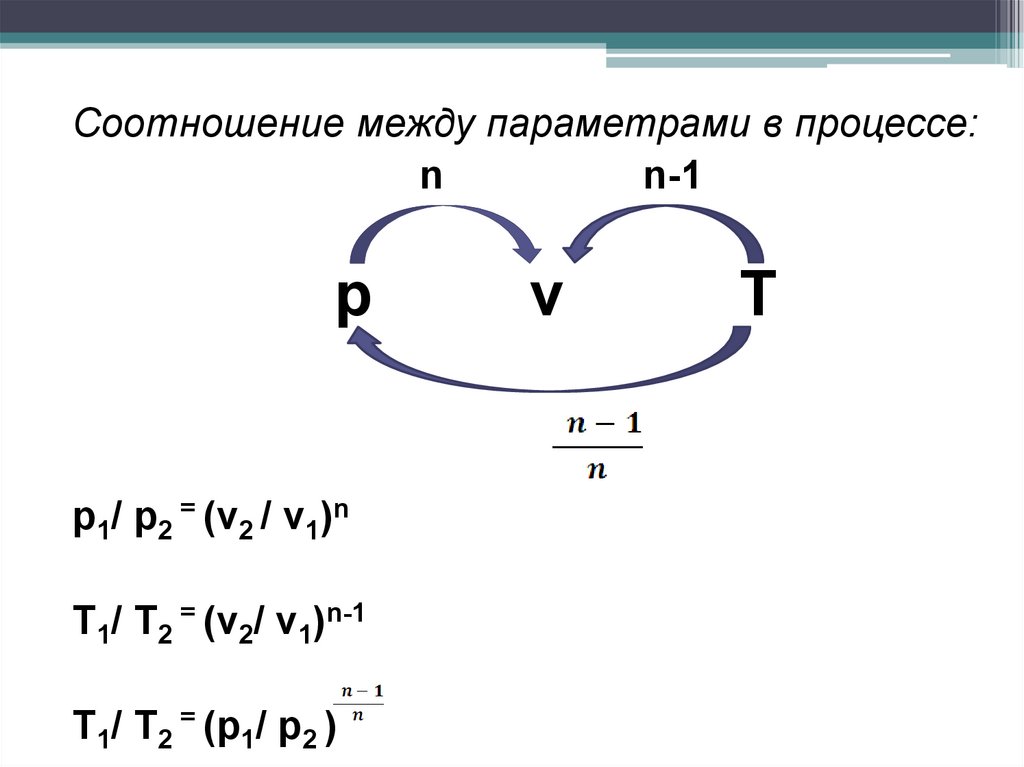
Соотношение между параметрами в процессе:n
n-1
р
р1/ р2 = (v2 / v1)n
T1/ T2 = (v2/ v1)n-1
T1/ T2 = (р1/ р2 )
v
Т
8.
Соотношение (обратное) между параметрамив процессе:
р
v1 / v2 = (р2 / р1)
v1/ v2 = (T2/ T1 )
р1/ р2 = (T1/ T2 )
v
Т
9.
Уравнение первого закона термодинамикидля процесса:
q = u + l
v = const
р = const
pv = const
рvk = соnst
q = u
q = u + l
q=l
l = - u
Изменение внутренней энергии в процессе:
u = cv (Т2 - Т1)
10.
Работа в процессе:l =
l=
l =
=
l=
l=
l =
l=
l =
11.
Теплота в процессе: (обозначим теплоемкость вполитропном процессе с) в результате преобразований
получим формулу для определения теплоемкости в
политропном процессе
c= cv
v = const
c = cv
= cv
р = const
c = cv
= cvk = cp
pv = const
c = cv
=∞
рvk = соnst
c = cv
=0
Следовательно:
q = c (Т2 - Т1) =cv
(Т2 - Т1)
12.
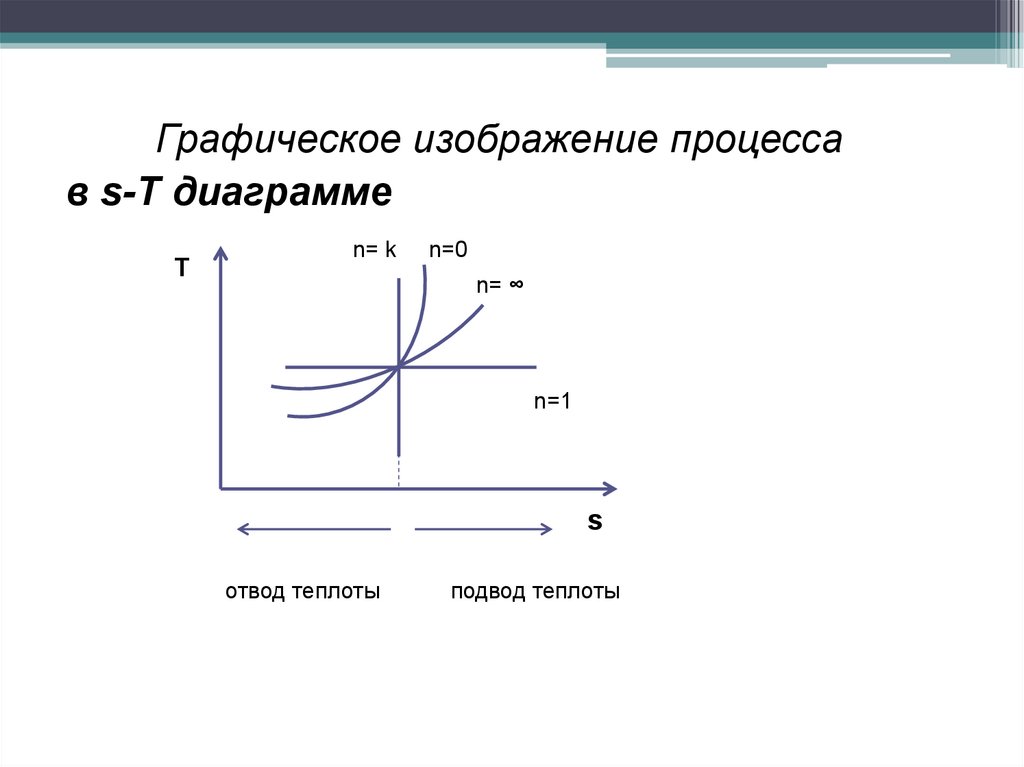
Графическое изображение процессав s-T диаграмме
Т
n= k
n=0
n= ∞
n=1
s
отвод теплоты
подвод теплоты
13. ПРАВИЛА ЗНАКОВ
• Все политропные процессы сжатия ирасширения, лежащие выше адиабаты идут с
подводом теплоты, ниже адиабаты с отводом
теплоты.
• Все политропные процессы сжатия и
расширения, лежащие выше изотермы идут с
увеличением внутренней энергии, ниже
изотермы с уменьшением внутренней
энергии.
14. РЕШЕНИЕ ЗАДАЧ
• В политропном процессе сжатия воздуха споказателем политропы n=1,38 давление
увеличивается в 3 раза, как изменится
температура, если в начале процесса она была
370С. Определите изменение внутренней
энергии и работу сжатия, если ср = 1005 Дж/кг*К,
R = 287 Дж/кг*К. Нарисуйте схему энергообмена
для данного процесса.
• В политропном процессе расширения при
уменьшении давления в два раза, объем
увеличился в три раза. Определить показатель
политропы . Как в данном политропном процессе
изменяется внутренняя энергия? Что происходит
с температурой. Объясните. Определите долю
тепла идущую на изменение внутренней энергии
в данном процессе.











 Физика
Физика








