Похожие презентации:
Уравнение состояния идеального газа
1.
Уравнение состояния идеального газа. п.70Клапейрон Бенуа Поль Эмиль
(1799–1864)
французский физик и инженер. Родился
26 января 1799 в Париже. Окончил
Политехническую школу (1818). Работал
в Институте инженеров путей
сообщения в Петербурге (1820–1830).
По возвращении во Францию стал
профессором Школы мостов и дорог в
Париже.
2.
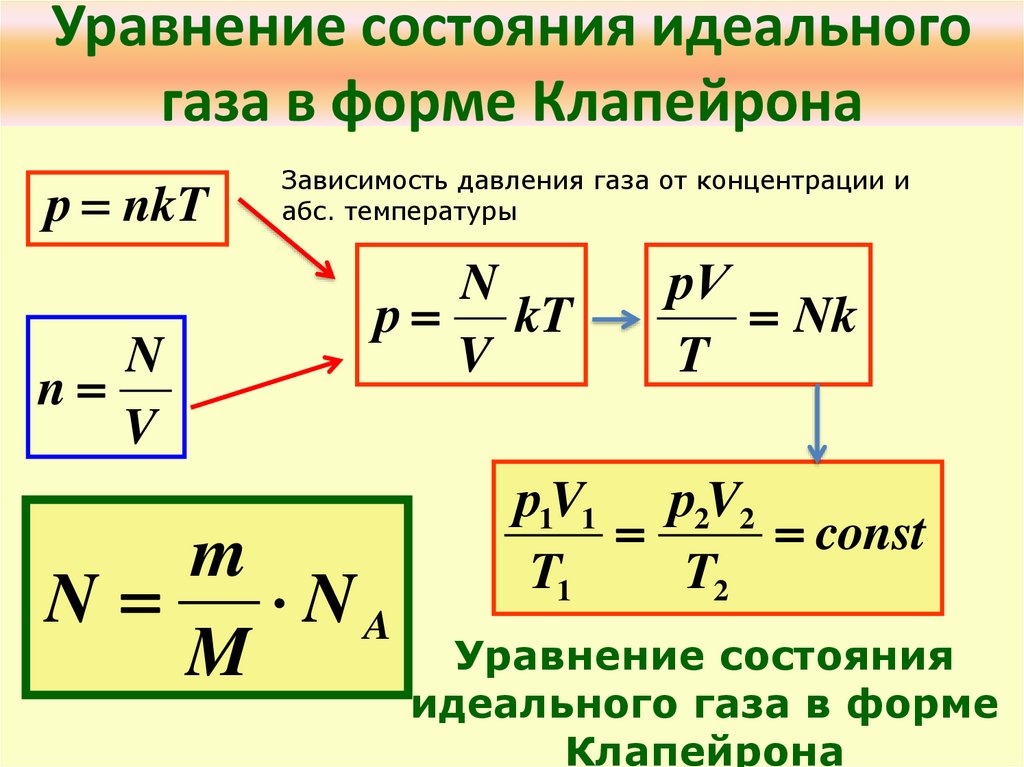
Уравнение состояния идеальногогаза в форме Клапейрона
р nkT
N
n
V
Зависимость давления газа от концентрации и
абс. температуры
N
р kT
V
m
N
NA
M
рV
Nk
T
р1V1 р2V2
const
T1
T2
Уравнение состояния
идеального газа в форме
Клапейрона
3.
Менделеев Дмитрий Иванович(8.II.1834–2.II.1907)
• Обобщив уравнение
Клапейрона,
в 1874 вывел общее
уравнение состояния
идеального газа
4.
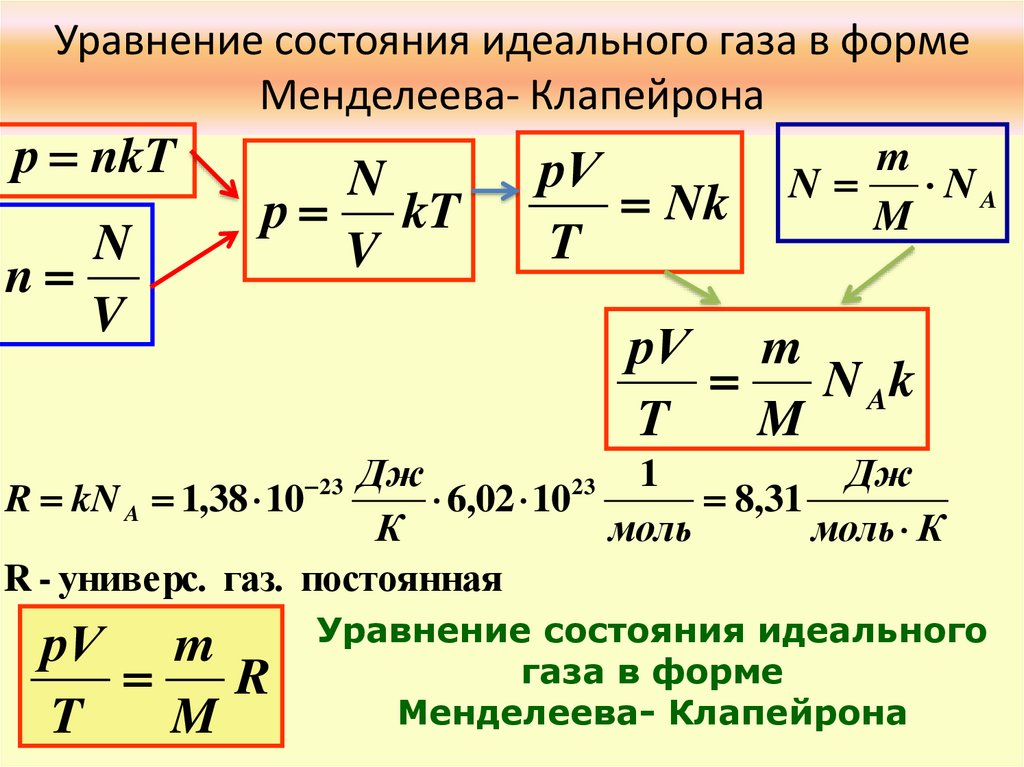
Уравнение состояния идеального газа в формеМенделеева- Клапейрона
р nkT
N
n
V
N
р kT
V
рV
Nk
T
m
N
NA
M
рV m
N Ak
T
M
Дж
1
Дж
23
R kN A 1,38 10
6,02 10
8,31
К
моль
моль К
R - универс. газ. постоянная
23
рV m
R
T
M
Уравнение состояния идеального
газа в форме
Менделеева- Клапейрона
5.
р1V1 р2V2const
T1
T2
Df. Изотермический процесс-процесс изменения
состояния термодинамической системы
макроскопических тел при постоянной
температуре Т = const
р1V1 р2V2
Закон Бойля-Мариотта:
Для газа данной массы произведение давления газа на
его объем постоянно, если температура газа
не меняется.
рV соnst
соnst
р
V
график в системе (р,V)- гипербола
(изотерма)
Э. Мариотт
Р. Бойль
6.
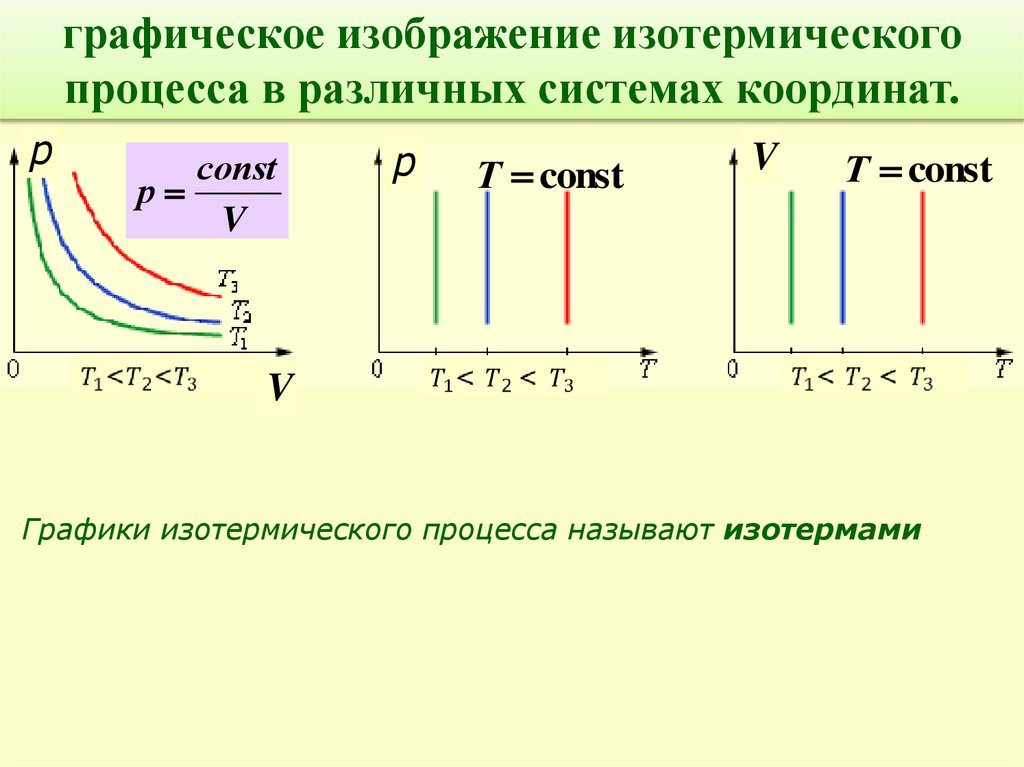
графическое изображение изотермическогопроцесса в различных системах координат.
p
соnst
р
V
p
Т const
V
Т const
V
Графики изотермического процесса называют изотермами
7.
р1V1 р2V2const
T1
T2
Изохорный процесс - процесс изменения Ж. Шарль
состояния термодинамической системы
макроскопических тел при постоянном объеме
V= const
Закон Шарля:
Для газа данной массы отношение давления газа к
температуре постоянно, если объем газа не меняется.
Df.
р1 р2
Т1 Т 2
р
const
Т
р Т соnst
8.
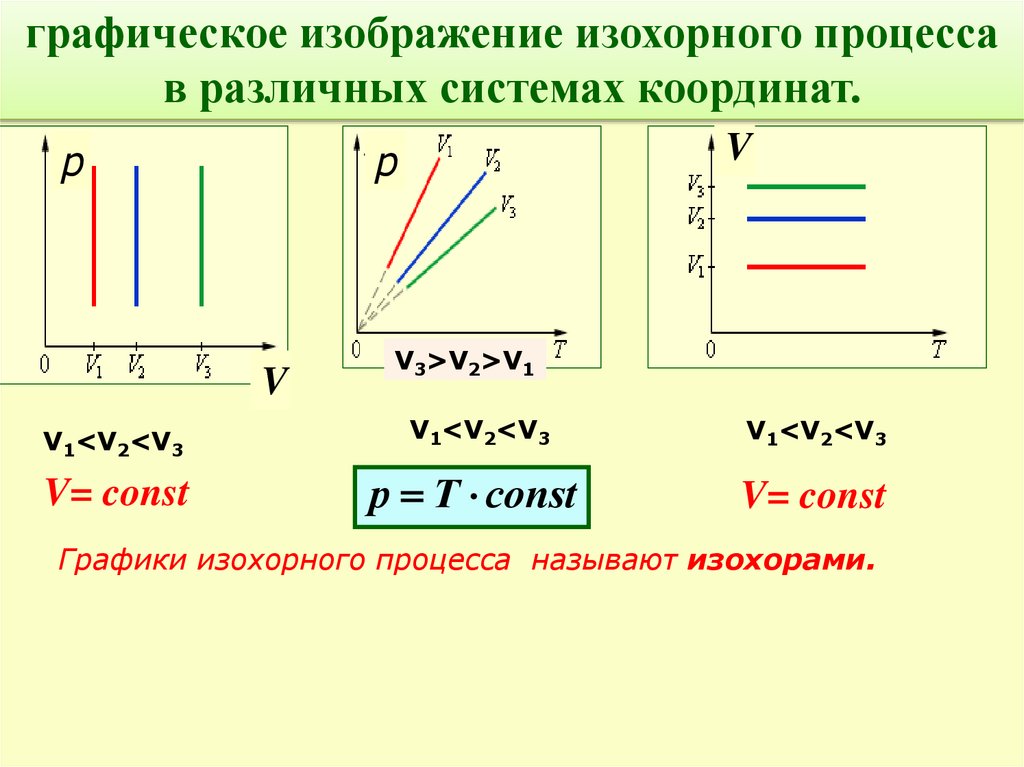
графическое изображение изохорного процессав различных системах координат.
p
V
p
V
V3>V2>V1
V1<V2<V3
V1<V2<V3
V1<V2<V3
V= const
р Т соnst
V= const
Графики изохорного процесса называют изохорами.
9.
р1V1 р2V2const
T1
T2
Df. Изобарный процесс-процесс изменения
состояния термодинамической системы
макроскопических тел при постоянном
давлении р = const
Закон Гей-Люссака:
Для газа данной массы отношение объема газа к
абсолютной температуре постоянно, если давление
газа не меняется.
V1 V2
T1 T2
V
соnst V T соnst
T
Ж. Гей-Люссак
10.
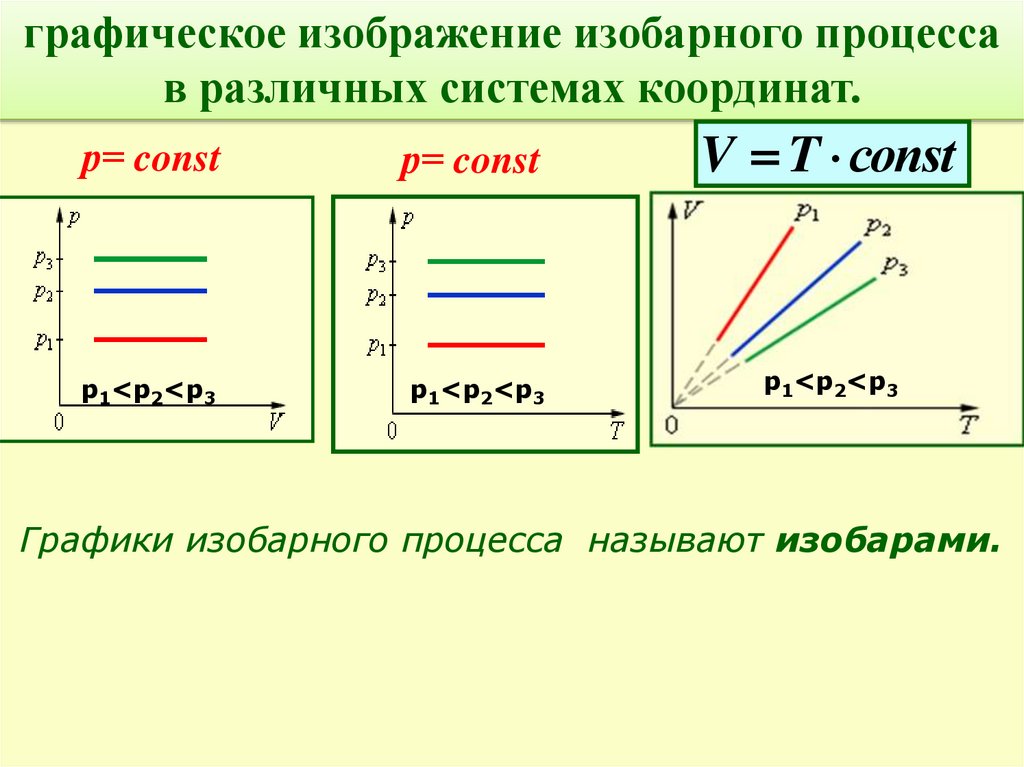
графическое изображение изобарного процессав различных системах координат.
р= const
р= const
V T соnst
р1<р2<р3
р1<р2<р3
р1<р2<р3
Графики изобарного процесса называют изобарами.
11.
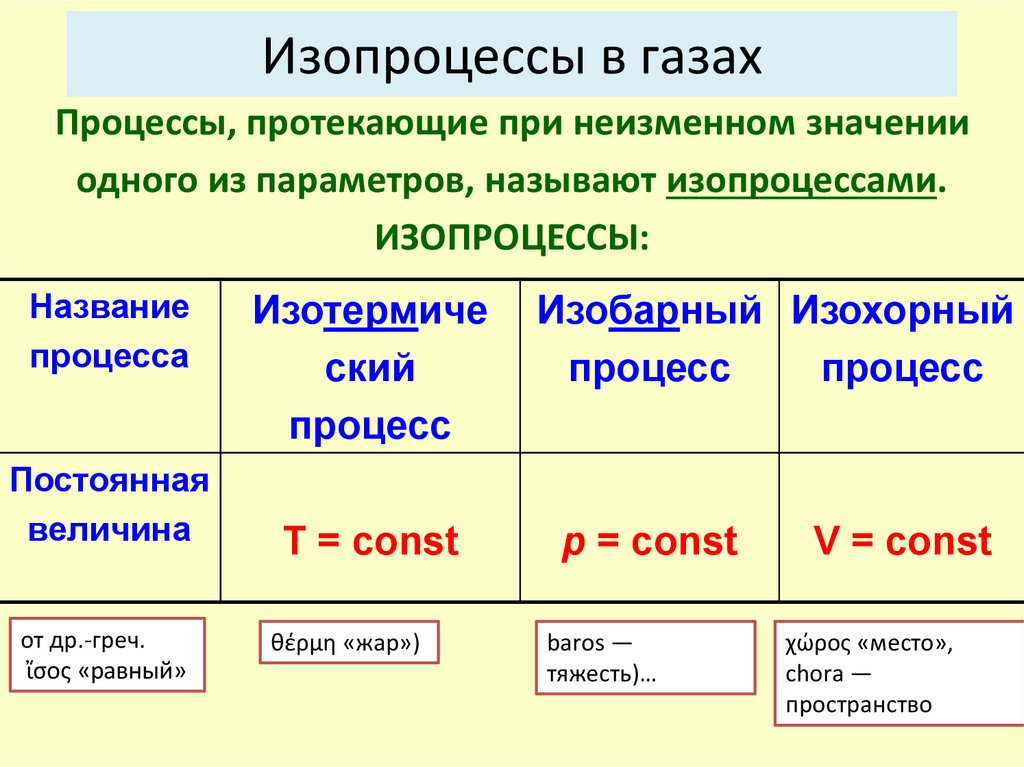
Изопроцессы в газахПроцессы, протекающие при неизменном значении
одного из параметров, называют изопроцессами.
ИЗОПРОЦЕССЫ:
Название
процесса
Постоянная
величина
от др.-греч.
ἴσος «равный»
Изотермиче
ский
процесс
Изобарный Изохорный
процесс
процесс
T = const
p = const
θέρμη «жар»)
baros —
тяжесть)…
V = const
χώρος «место»,
chora —
пространство
12.
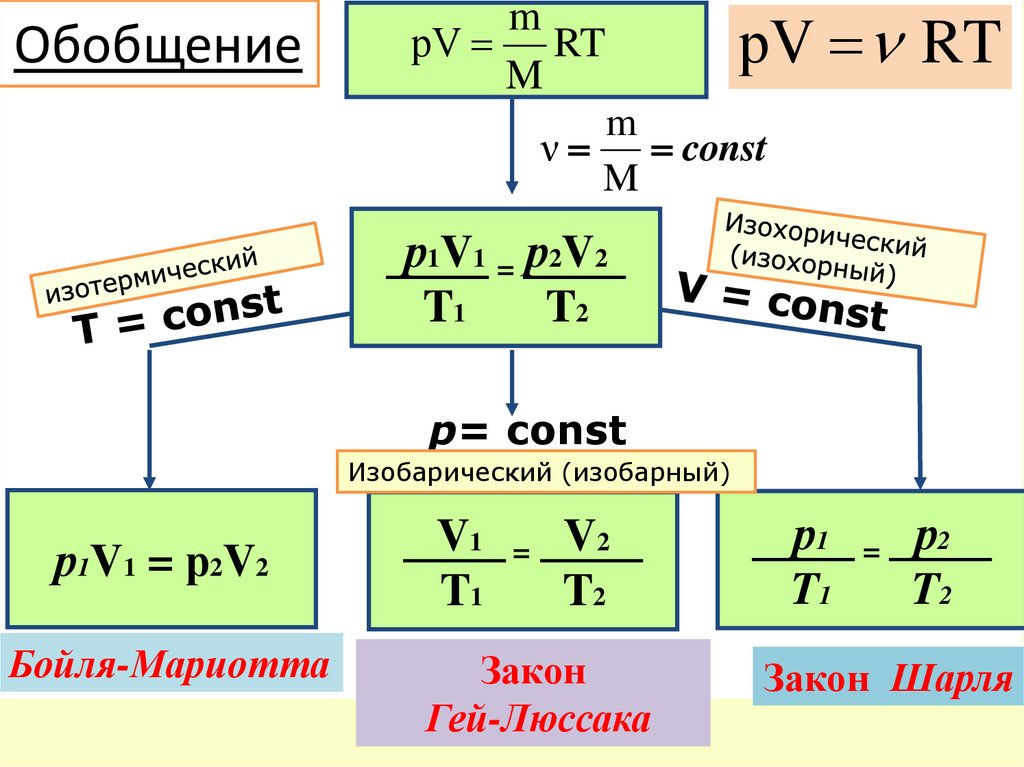
Обобщениеm
рV RT
M
рV RT
m
ν
const
M
р1V1 = р2V2
T1
T2
р= const
Изобарический (изобарный)
р1V1 = р2V2
V1 = V2
T1
T2
р1 = р 2
T1
T2
Бойля-Мариотта
Закон
Гей-Люссака
Закон Шарля





 Физика
Физика








