Похожие презентации:
Газовые законы. Уравнение состояния идеального газа
1.
«Газовые законы.Уравнение состояния
идеального газа».
2. Макропараметры (термодинамические) – это физические величины, характеризующие состояние тела в целом.
Уравнение состояния идеального газа определяетсвязь температуры, объема и давления тел:
позволяет определить одну из величин,
характеризующих состояние газа, по двум другим
(используется в термометрах);
определить, как протекают процессы при
определенных внешних условиях;
определить, как меняется состояние системы, если
она совершает работу или получает тепло от внешних
тел.
3.
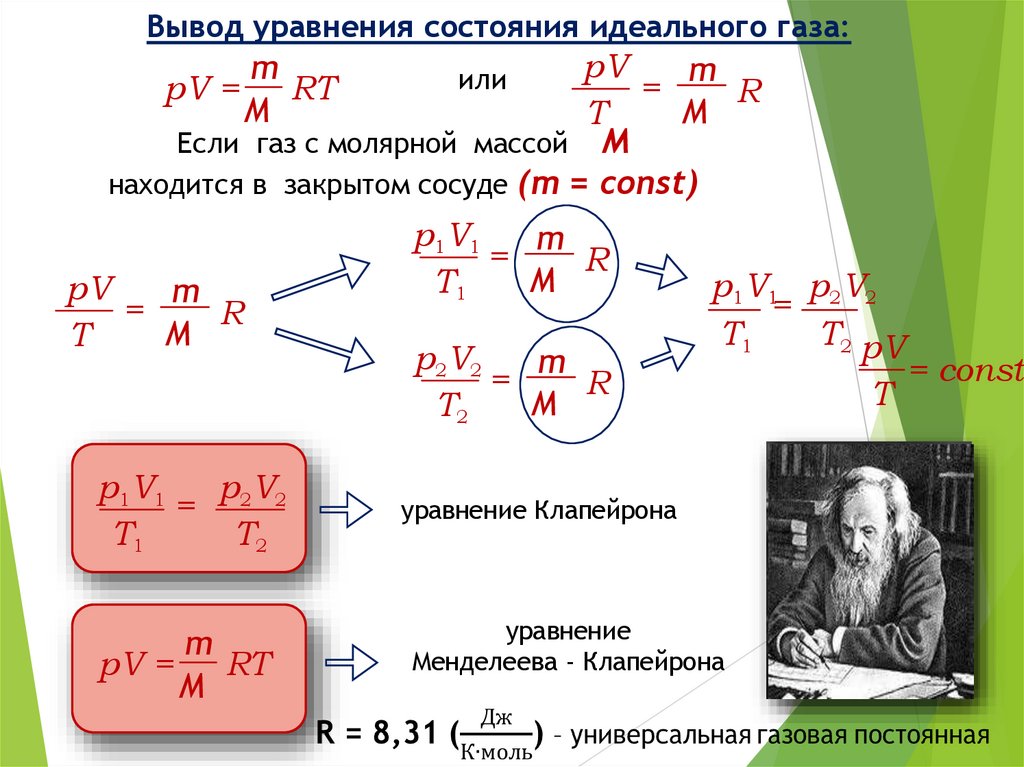
Вывод уравнения состояния идеального газа:pV
m
=
R
M
T
Если газ с молярной массой М
находится в закрытом сосуде (m = const)
m
pV =
RT
M
pV
m
=
R
M
T
p1V1
pV
= 2 2
T1
T2
m
pV =
RT
M
или
p1V1
m
=
R
M
T1
p2V2
m
=
R
M
T2
p1V1 p2V2
=
T1
T2 pV
уравнение Клапейрона
уравнение
Менделеева - Клапейрона
T
= const
4.
Закон Дальтона: давление смеси химическиневзаимодействующих газов равно сумме их
парциальных давлений: p = p1+p2+… pi,
где pi– парциальное давление i-й компоненты смеси.
Парциальное давление – давление отдельно взятого
компонента газовой смеси, равное давлению, которое
он будет оказывать, если занимает весь объём при той
же температуре.
Закон Авогадро: один моль любого газа при нормальных
условиях занимает один и тот же объём равный:
V0 = 0,0224 м³/моль.
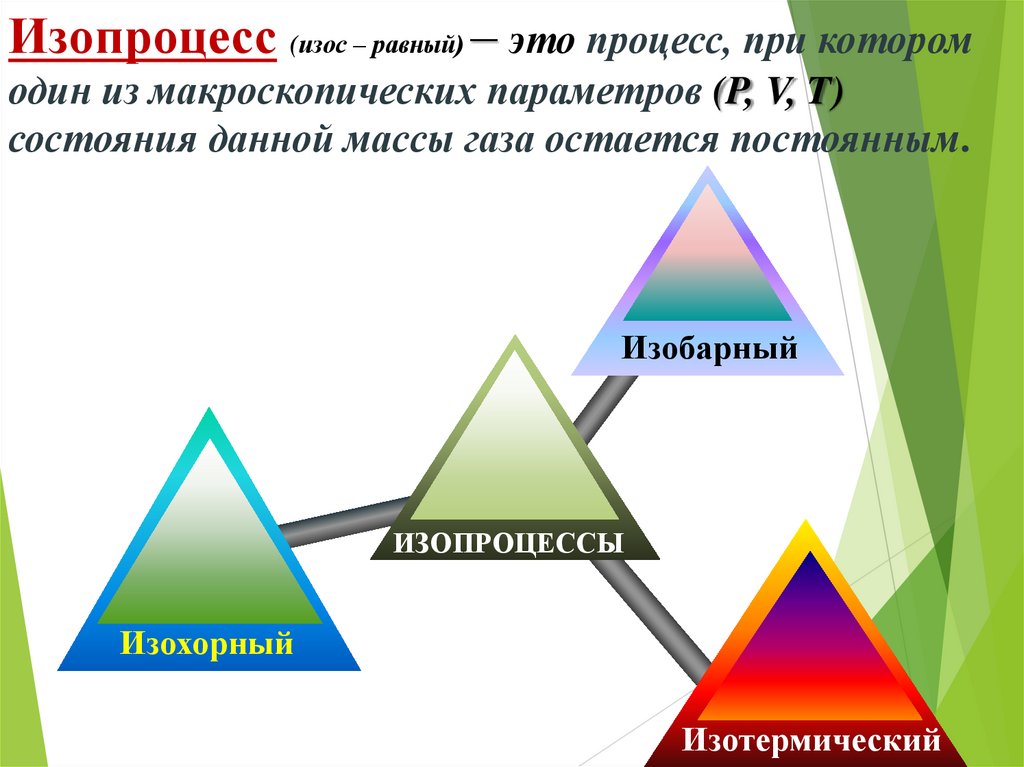
5. Изопроцесс (изос – равный) – это процесс, при котором один из макроскопических параметров (P, V, T) состояния данной массы газа
остается постоянным.Изобарный
ИЗОПРОЦЕССЫ
Изохорный
Изотермический
6.
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС- это процесс изменения состояния газа при
постоянной температуре
pV
= const
T
при Т = const
pV = const
Закон Бойля – Мариотта: для газа данной массы
произведение давления на объем постоянно,
если температура не меняется
Пример: медленное расширение (сжатие)
воздуха под поршнем в сосуде
р1V1 = р2V2
p изотермическое
сжатие
2
V р
изотермическое
расширение
1
1/2
1/4
1/4 1/2 1
2
V
7.
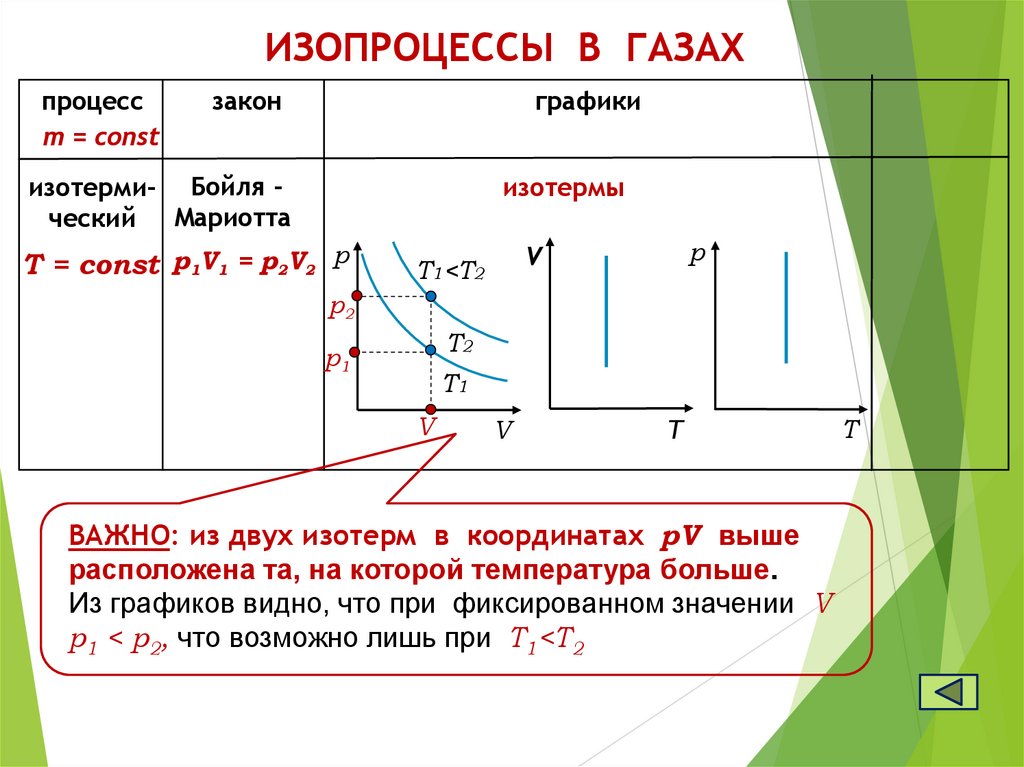
ИЗОПРОЦЕССЫ В ГАЗАХпроцесс
m = const
закон
графики
изотерми- Бойля ческий Мариотта
изотермы
Т = const р1V1 = р2V2 р
р
V
T1<T2
р2
T2
р1
T1
V
V
T
ВАЖНО: из двух изотерм в координатах pV выше
расположена та, на которой температура больше.
Из графиков видно, что при фиксированном значении V
р1 < р2, что возможно лишь при T1<T2
T
8.
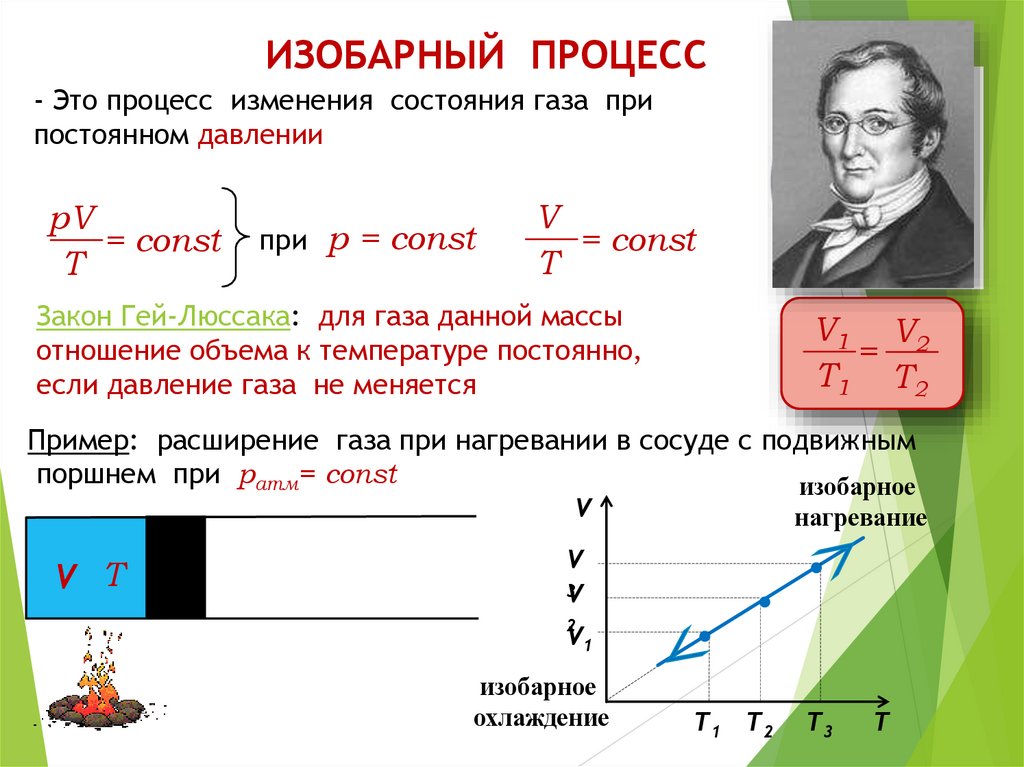
ИЗОБАРНЫЙ ПРОЦЕСС- Это процесс изменения состояния газа при
постоянном давлении
pV
= const
T
при р = const
V
= const
T
Закон Гей-Люссака: для газа данной массы
отношение объема к температуре постоянно,
если давление газа не меняется
V1 V2
=
T1 T2
Пример: расширение газа при нагревании в сосуде с подвижным
поршнем при ратм= const
изобарное
V
V Т
нагревание
V
3
V
2
V1
изобарное
охлаждение
T1 T2
T3
T
9.
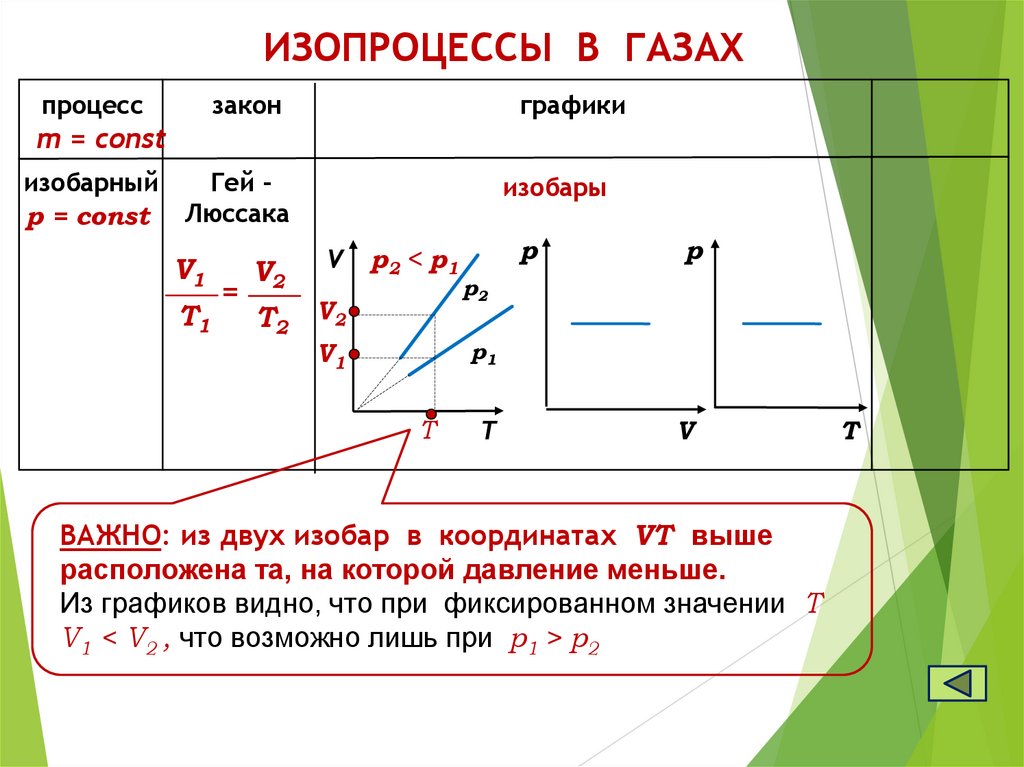
ИЗОПРОЦЕССЫ В ГАЗАХпроцесс
закон
графики
m = const
изобарный
Гей р = const Люссака
V1
T1
=
изобары
V2
V
T2
V2
p2 < p1
V1
р
р
р2
р1
T
T
V
ВАЖНО: из двух изобар в координатах VТ выше
расположена та, на которой давление меньше.
Из графиков видно, что при фиксированном значении Т
V1 < V2 , что возможно лишь при p1 > p2
T
10.
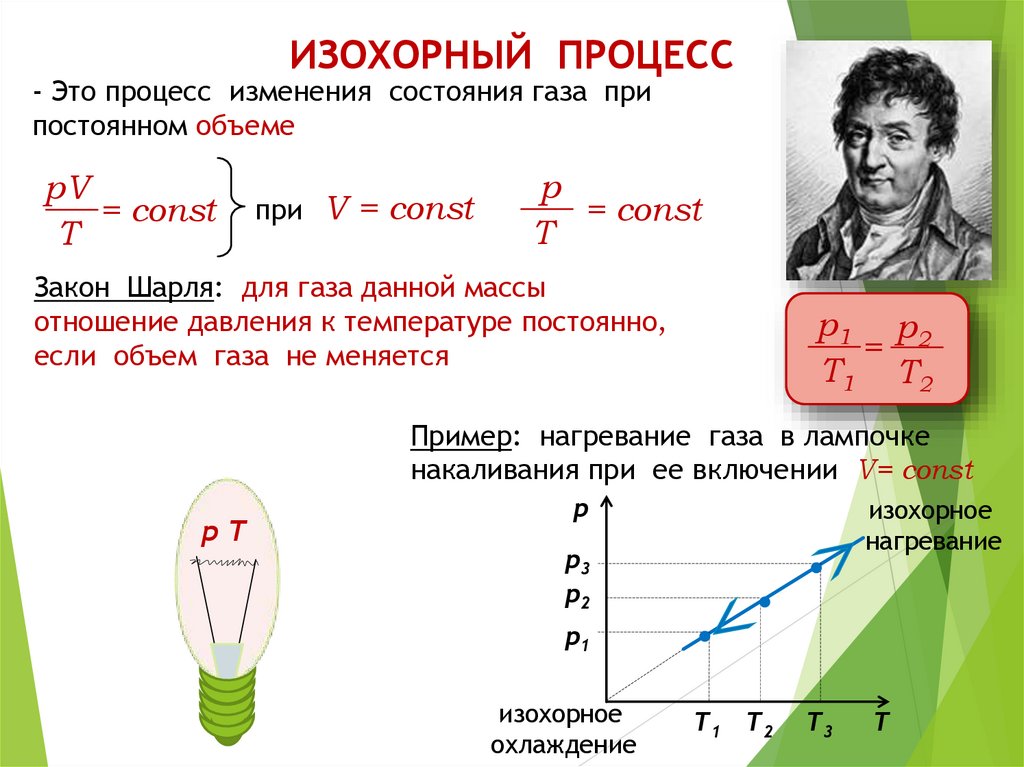
ИЗОХОРНЫЙ ПРОЦЕСС- Это процесс изменения состояния газа при
постоянном объеме
pV
= const
T
при V = const
p
= const
T
Закон Шарля: для газа данной массы
отношение давления к температуре постоянно,
если объем газа не меняется
р1 р 2
=
T1 T2
Пример: нагревание газа в лампочке
накаливания при ее включении V= const
рТ
р
изохорное
нагревание
р3
р2
р1
изохорное
охлаждение
T1 T2
T3
T
11.
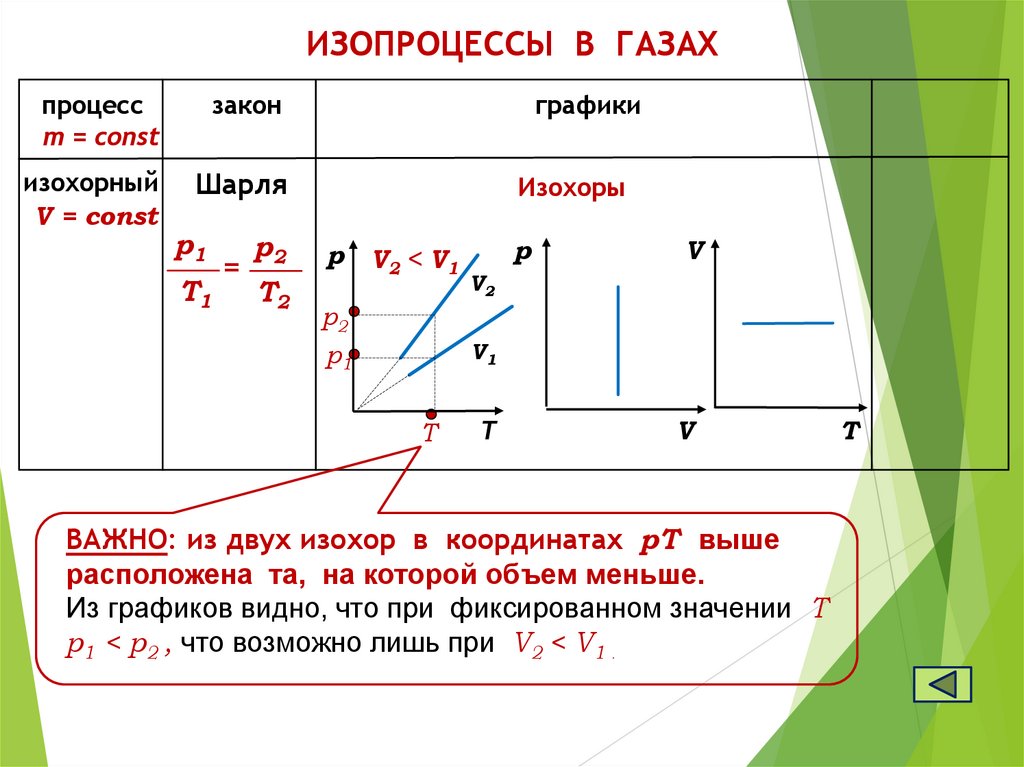
ИЗОПРОЦЕССЫ В ГАЗАХпроцесс
m = const
закон
графики
изохорный
V = const
Шарля
Изохоры
p1
T1
=
p2
T2
р
V2 < V1
p2
p1
р
V
V2
V1
T
T
V
ВАЖНО: из двух изохор в координатах pТ выше
расположена та, на которой объем меньше.
Из графиков видно, что при фиксированном значении Т
р1 < р2 , что возможно лишь при V2 < V1 .
T
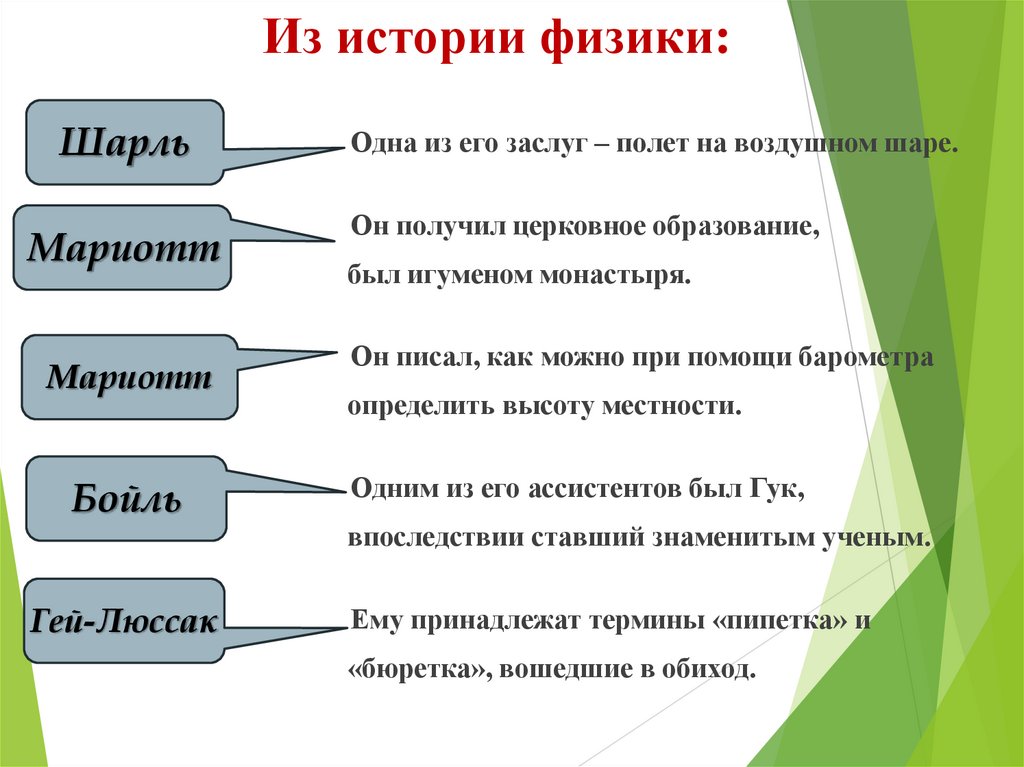
12. Из истории физики:
ШарльМариотт
Мариотт
Бойль
Гей-Люссак
Одна из его заслуг – полет на воздушном шаре.
Он получил церковное образование,
был игуменом монастыря.
Он писал, как можно при помощи барометра
определить высоту местности.
Одним из его ассистентов был Гук,
впоследствии ставший знаменитым ученым.
Ему принадлежат термины «пипетка» и
«бюретка», вошедшие в обиход.
13.
14.
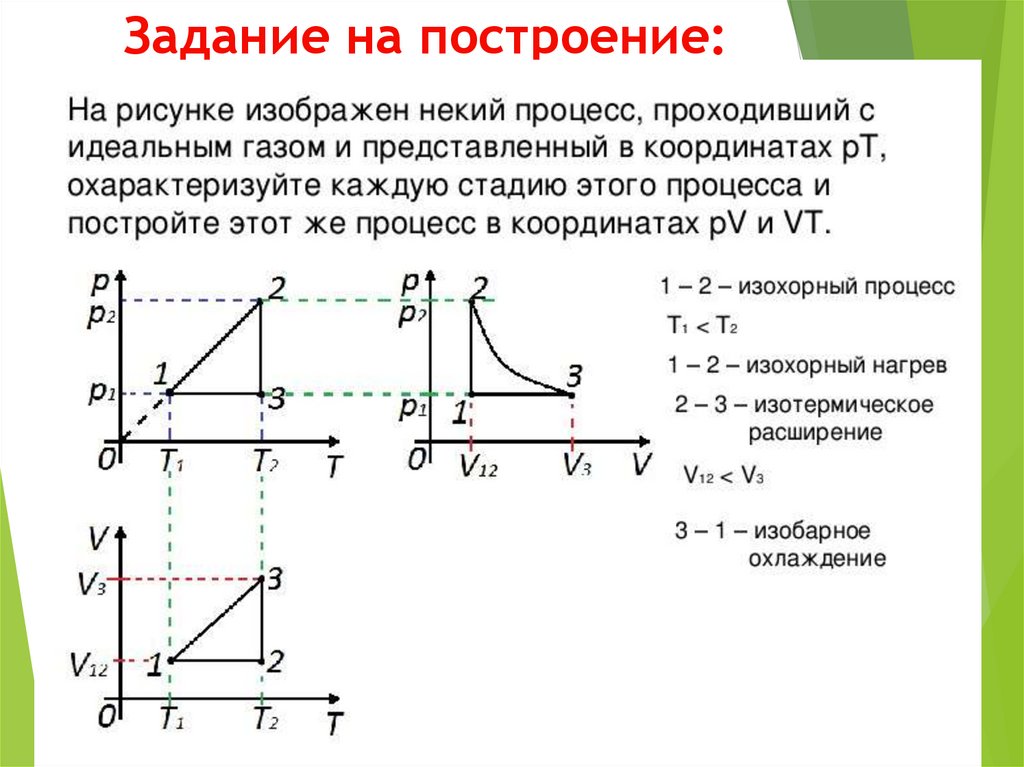
15. Задание на построение:
16. Домашнее задание:
1. Газ находится в баллоне притемпературе 288К и давлении 1,8МПа. При
какой температуре давление газа станет
равным 1,55МПа? Объем баллона считать
неизменным.
2. Газ занимает объём 2м3 при температуре
2730С. Каков будет его объём при
температуре 5460С и прежнем давлении?
3. Воздух под поршнем насоса имеет
давление 105Па и объем 260см3. При каком
давлении этот воздух займет объем 130см3,
если его температура не изменится?







 Физика
Физика








