Похожие презентации:
Щелочные металлы. Общая характеристика
1.
2.
Дать общую характеристикущелочным металлам.
Рассмотреть их электронное
строение, сравнить физические и
химические свойства.
Узнать о важнейших соединениях
металлов и их тривиальных
названиях.
Определить области применения
этих соединений.
3.
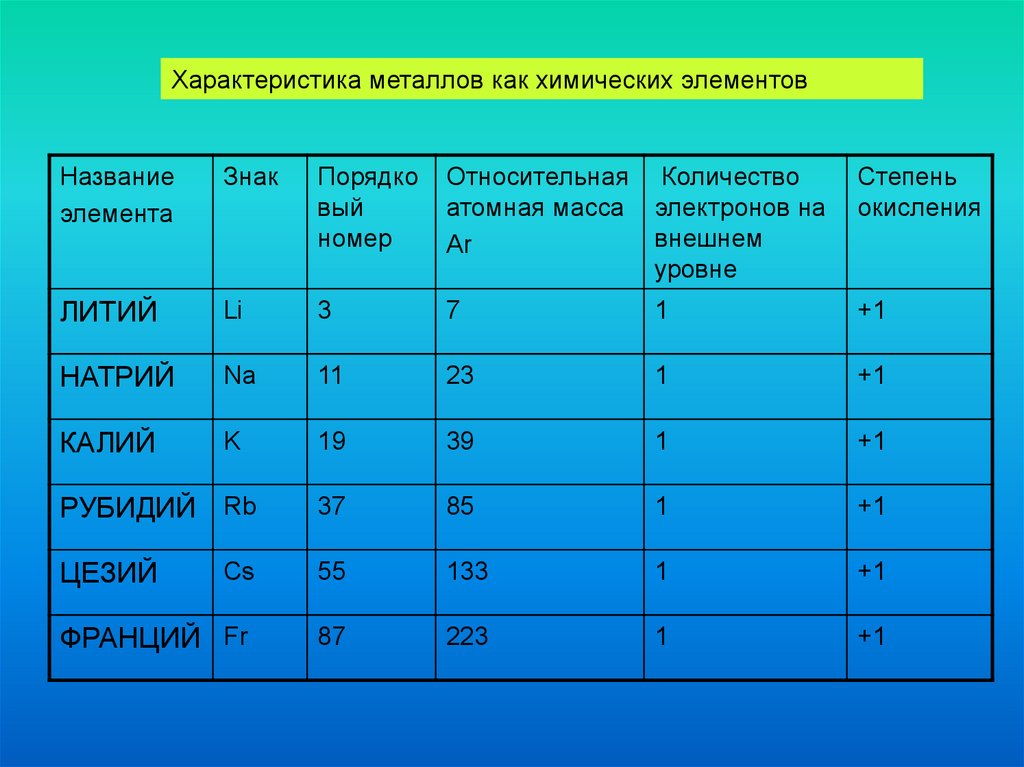
Характеристика металлов как химических элементовНазвание
элемента
Знак
Порядко
вый
номер
Относительная Количество
атомная масса электронов на
внешнем
Ar
уровне
Степень
окисления
ЛИТИЙ
Li
3
7
1
+1
НАТРИЙ
Na
11
23
1
+1
КАЛИЙ
K
19
39
1
+1
РУБИДИЙ Rb
37
85
1
+1
ЦЕЗИЙ
Cs
55
133
1
+1
ФРАНЦИЙ Fr
87
223
1
+1
4.
•В 1807 г. в Англии Г. Деви открыл натрий и калий.«Натрун» - сода, «алкали» - щелочь.
•В 1817г. в Швеции А. Арфедсоном был открыт литий.
«Литос» - камень.
•В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий
«темно-красный» и цезий «небесно-голубой».
•В 1939г. во Франции М. Пере открыл радиоактивный элемент
франций, который назвал в честь своей страны – Франции.
5.
6.
Плотность металловТемпература плавления
Li- 0,534 г/см3
Li - 180оС
Na- 0,971 г/см3
Na - 98оС
K - 0,863 г/см3
K
Rb – 1,532 г/см3
Rb - 39оС
Cs - 2,44 г/см3
Cs - 27оС
- 64оС
7.
Цель: Изучить химические свойства щелочных металлов.Опыт № 1.
Взаимодействие натрия с
кислородом
Опыт №4. Горение солей
лития.
Опыт №2.
Взаимодействие натрия с
водой
Опыт № 5. Горение
солей натрия.
Опыт № 3.
Взаимодействие натрия,
калия, лития с водой
Опыт №6. Горение
солей калия.
8.
Самые распространенные соединения металлов и ихприменение
NaOH – едкий натр, каустическая сода.
KOH - едкое кали.
Na2CO310H2O –кристаллическая сода.
NaHCO3 – пищевая сода.
K2CO3 -поташ.
Na2SO410H2O – глауберова соль.
Используют для
очистки
нефтепродуктов,
производства
бумаги, мыла,
волокон, стекла,
удобрений.
Применяют в
медицине и
фармакологии.
9.
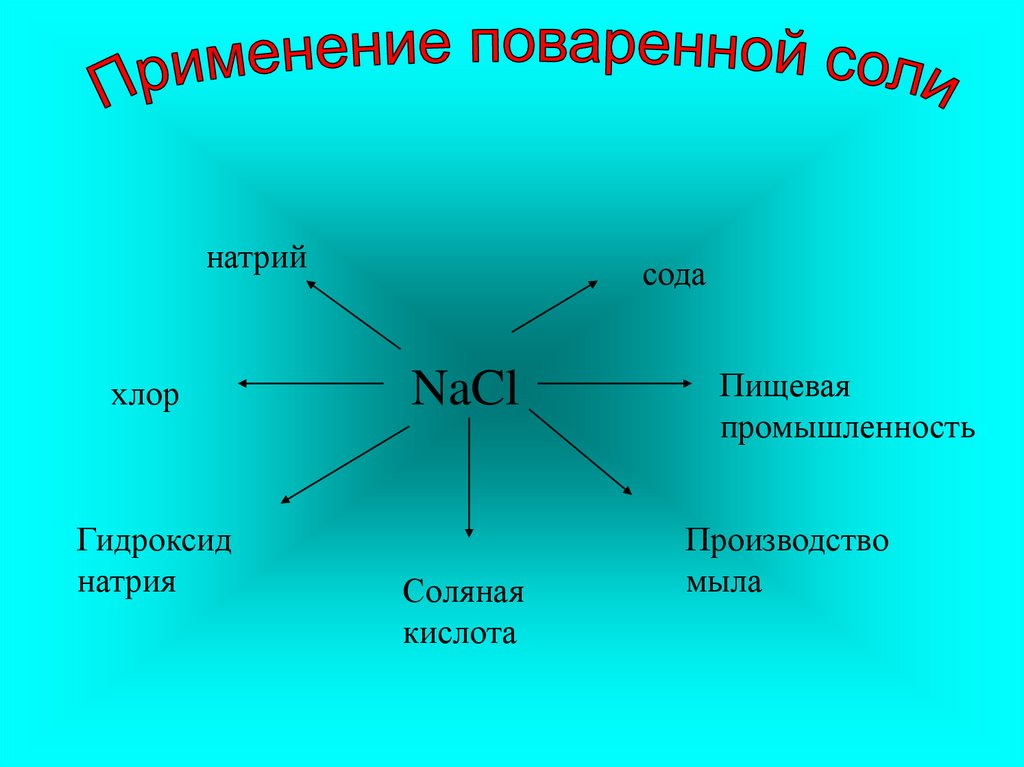
натрийхлор
Гидроксид
натрия
сода
NaCl
Соляная
кислота
Пищевая
промышленность
Производство
мыла
10.
Na+- внутриклеточный ион, содержится в кровии лимфе, создает в клетках осмотическое
давление.
K+ - внеклеточный ион, поддерживает
работу сердца и мышц.
Большое количество калия содержится в
кураге, сои, фасоли, зеленом горошке,
черносливе, изюме.
11.
Задание №1.Определите «лишний» элемент в ряду.
А) Fr, K, Cu, Na;
Б) P, Li, O, Cl;
В) Al, Ag, Ra, Cs.
Объясните свой выбор.
12.
1.Какой металл при взаимодействии с водой образуетщелочь?
Si
Cu
Cs
2. Определите электронные
формулу щелочных металлов.
Na
Li
Zn
4s2
1s1
3s1
6s1
3s23p1 4s1
Fr
Pb
K
2s2
2s1
6s2
13.
Вариант - 1Вариант - 2
1.Соединение Na2SO410H 2 O называется
1.Соединение NaOH называется
1) каустическая сода, 2) кристаллическая сода,
1) глауберова соль
3) питьевая сода,
2) пищевая сода
4) поташ.
2.Используется в производстве стекла, бумаги,
мыла
2) поваренная соль
4) поташ
2. Разъедает ткани и бумагу. Используется при
производстве мыла и волокон
1) Na 2 CO 3 10 H 2 O
2) Na 2 SO 4 10H 2 O
1) Na 2 CO 3 10 H 2 O
2) Na 2 SO 4 10H 2 O
3) NaCl
4) NaOH
3) NaCl
4) NaOH
3. Предложил назвать литием от греческого
слова литос – камень
3. Предложил назвать калий от арабского алкали щелочь
1)Й. Берцеллиус
2) И. Арфведсон
1)Й. Берцеллиус
2) И. Арфведсон
3) Г.Деви
4) Г.Агрикола
3) Г.Деви
4) Г.Агрикола
4. Цвет пламени, в который его окрашивают
ионы натрия
4. Цвет пламени, в который его окрашивают ионы
калия
1) желтый
2) фиолетовый
1) желтый
2) фиолетовый
3) красный
4) зеленый
3) красный
4) зеленый
5. В 100 г фасоли содержится 1,075 г калия.
Сколько фасоли нужно съесть, чтобы
получить суточную норму калия (5 г/сутки)
1) 465 г
2)0,053 г
3)107 г
4)21,5 г
5. В 100 г изюма содержится 3,055 г калия. Сколько
изюма нужно съесть, чтобы получить
суточную норму калия (5 г/сутки)?
1) 0,15 г
2) 164 г
3) 61,5 г
4) 305 г
14.
П. 11, зад.1- (письменно); 3- (устно).15.
16.
2Na + O2 = 2Na2O17.
2Na + 2H2O = 2NaOH + H218.
2Na + 2H2O = 2NaOH + H22K + 2H2O = 2KOH + H2
Уравнение взаимодействия
лития с водой напишите
самостоятельно.



















 Химия
Химия








