Похожие презентации:
Методические особенности подготовки к ЕГЭ по химии в 2019 году
1.
«Методические особенности подготовки к ЕГЭ похимии в 2019 году»
Реакции окисления
углеводородов
Колодиева О.А.
Учитель химии и биологии
МБОУ СОШ № 3
2.
Окисление кислородомАЛКАНЫ
СН4 + 2О2 = СО2 + 2 H2O
С4Н10+ 13 О2= 8 СО2 + 10 H2O
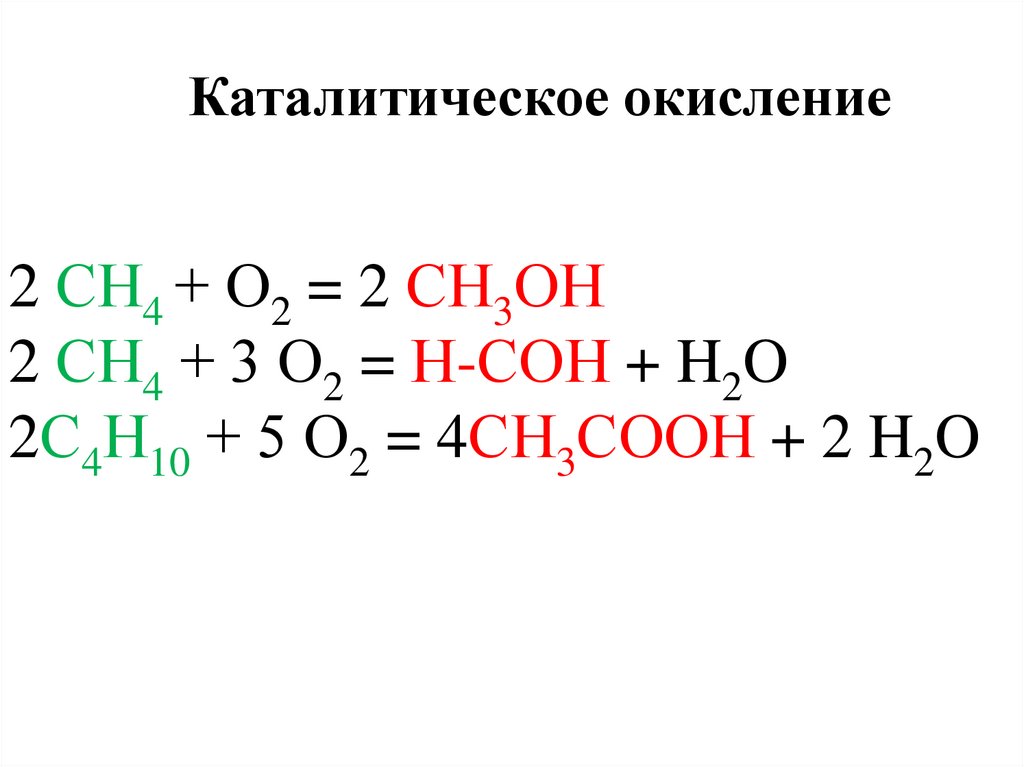
3.
Каталитическое окисление2 СН4 + О2 = 2 СН3ОН
2 СН4 + 3 О2 = Н-СОН + H2O
2С4Н10 + 5 О2 = 4СН3СООН + 2 H2O
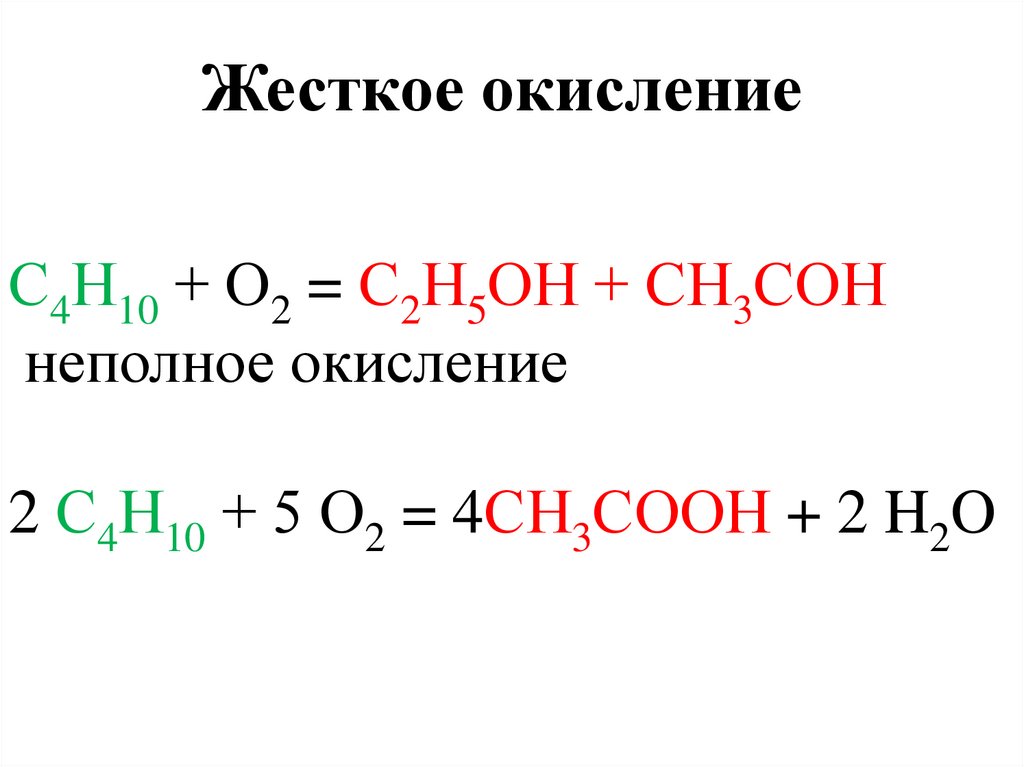
4.
Жесткое окислениеС4Н10 + О2 = С2Н5ОН + СН3СОН
неполное окисление
2 С4Н10 + 5 О2 = 4СН3СООН + 2 H2O
5.
АЛКЕНЫС2Н4 + 3 О2 = 2 СО2 + 2 H2O
(горит несветящим бесцветным пламенем)
Каталитическое окисление
Реакция Прилежаева, 2500С, kat – Ag+
С2Н4 + О2 = 2СН2-СН2
О
Этиленоксид (эпоксиэтан)
С2Н4 + О2 = 2СН3СОН (t, kat – Pd2+)
6.
АЛКАДИЕНЫ2 С4Н6 + 11 О2 =8 СО2 + 6 H2O
7.
АЛКИНЫ2 С2Н2 + 5 О2 = 4 СО2 + 2 H2O
8.
Кислая средаАЛКАНЫ
алканы + КМnО4 = реакция не идет
алканы + К2Сr2О7 = реакция не идет
9.
АЛКЕНЫЖесткое окисление с разрывом двойной связи при нагревании
СН3СН=СН2 + 2КМnО4(конц) + 3Н2SО4 = СН2СООН + СО2 + 2MnSO4 + K2SO4 + 4H2O
5С2Н4 + 12КМnО4(конц) + 18Н2SО4 = 10СО2 + 12MnSO4+6K2SO4 + 28H2O
5(СН3)2С=СН2 + 8КМnО4 + 12Н2SО4 = 5СН3СОСН3 + 5СО2 + 8MnSO4 + 4K2SO4 + 17H2O
(неполное окисление)
СН3СН=СНСН3 + 8КМnО4 + 12Н2SО4= 10СН3СООН + 8MnSO4+ 4K2SO4 + 12H2O
Симметричная молекула
5(СН3)2С=С(СН3)2 + 4КМnО4 + 6Н2SО4 = 10СН3СОСН3 + 4MnSO4 + 2K2SO4 + 6H2O
CН3СН=С(СН3)2 + 6КМnО4 + 9Н2SО4 = 5 СН3СООН + 5(СН3)2СО + 6MnSO4 + 3K2SO4 + 9H2O
диметилкетон
10.
ЦИКЛОАЛКАНЫС3Н6 + 2КМnО4 + 2Н2SО4 = НООС-СН2-СООН + 2MnSO4 + K2SO4 + 4H2O
С5Н10 + 2КМnО4 + 3Н2SО4 = НООС-(СН2)3-СООН + 2MnSO4 + K2SO4 + 4H2O
АЛКАДИЕНЫ
СН2=СН-СН=СН2 + 4КМnО4 + 6Н2SО4 =
НООС-СООН + 4MnSO4 + 2K2SO4 + 2CO2 + 8H2O
СН2=СН-СН2-СН=СН2 + 4 КМnО4 + 6 Н2SО4 =
НООС-СН2-СООН + 4 MnSO4 + 2 K2SO4 + 2 CO2 + 8 H2O
11.
АЛКИНЫЖесткое окисление при температуре с разрывом С-С связи
С2Н2 →НСООН →CO2
С2Н2 + 2 КМnО4(конц) + 3 Н2SО4 = 2 CO2+ 2 MnSO4 + K2SO4 + 4 H2O
СН3-С ≡ С-СН3 + 6 КМnО4(конц) + 9 Н2SО4 =
10СН3СООН + 6 MnSO4 + 3 K2SO4 + 4 H2O
СН3-СН2-С ≡СН + 4 КМnО4 + 6 Н2SО4 =
5СН3СН2СООН+ 5 CO2 + 4 MnSO4 + 2 K2SO4 + 6 H2O
12.
АРЕНЫМягкое окисление на холоду без разрыва С-С связи
5С6Н5-СН3 + 6 КМnО4 + 3 Н2SО4 =
5С6Н5-СООН + 6 MnSO4 + 3 K2SO4 + 14 H2O
Мягкое окисление, перевод толуола в бензальдегид
С6Н5СН3 + 2 MnO2 + 2 Н2SО4 =
С6Н5СНО + 2 MnSO4 + 3 H2O
13.
Жесткое окисление сильными окислителямис разрывом боковой цепи
5 С6Н5-С2Н5 + 12 КМnО4 + 18 Н2SО4 =
5С6Н5СООН + 5 CO2+ 12 MnSO4 + 6 K2SO4 + 28 H2O
С6Н5-С3Н7 + КМnО4 + 3 Н2SО4 =
С6Н5СООН + СН3СООН + 2 MnSO4 + K2SO4 + H2O
5С6Н5-СН(СН3)2 + 18 КМnО4 + 27 Н2SО4 =
5С6Н5СООН + 10 CO2 + 18 MnSO4 + 9 K2SO4 + 42 H2O
5С6Н5-СН2-С≡ СН + 14КМnО4 + 21Н2SО4 =
5С6Н5СООН + 10CO2 + 14MnSO4 + 7K2SO4 +21H2O
14.
Нейтральная и щелочная средаАЛКЕНЫ
Реакия Вагнера(на холоду)
2С2Н4 + 2 КМnО4(3%) + 4 H2O =
3С2Н4(ОН)2 + 2 MnO2 + 2 КОН
СН3СН = СН2 + 2 КМnО4(3%) + 4H2O =
3СН3СН(ОН)СН2(ОН) + 2MnO2 + 2КОН
Мягкое окисление H2O2 на холоду
СН2=СН2 + H2O2 = СН2ОН-СН2ОН
СН3СН = СН2 + H2O2 = СН3СН(ОН)СН2(ОН)
15.
Жесткое окисление с разрывом С=С связи3СН3СН = СНСН3 + 8 КМnО4(конц) =
6СН3СООК + 8MnO2 + 2КОН
3СН3СН = СН2 + 10КМnО4(конц) =
3 СН3СООК + 3 K2CO3 + КОН + 10 MnO2 + 4 H2O
Образование карбонатов
3С2Н4 + 12 КМnО4 (конц) =
6 K2CO3 + 12 MnO2 + 6 H2O
16.
АЛКАДИЕНЫМягкое окисление (обесцвечивание КМnО4)
3С4Н6 + 2 КМnО4 + 4 H2O =
НО-СН2-СН=СН-СН2-ОН + 2 MnO2 + 2 КОН
17.
АЛКИНЫМягкое окисление на холоду без разрыва С-С связи
2С2Н2 + 8 КМnО4 =
3КООС-СООК + 8 MnO2 + 2 КОН + 2 H2O
3СН3СН≡СНСН3 + 4КМnО4 + 2H2O =
3СН3С(О)-(О)ССН3 + 4MnO2 + 4КОН
18.
Жесткое окисление при повышенной температурес разрывом С≡С связи
СН3СН≡СНСН3 + 2 КМnО4(конц) =
2СН3СООК + 2 MnO2
3 СН3СН≡СН + 8 КМnО4(конц) =
3 СН3СООК + 2 K2CO3 + KНCO3 +8 MnO2 + H2O



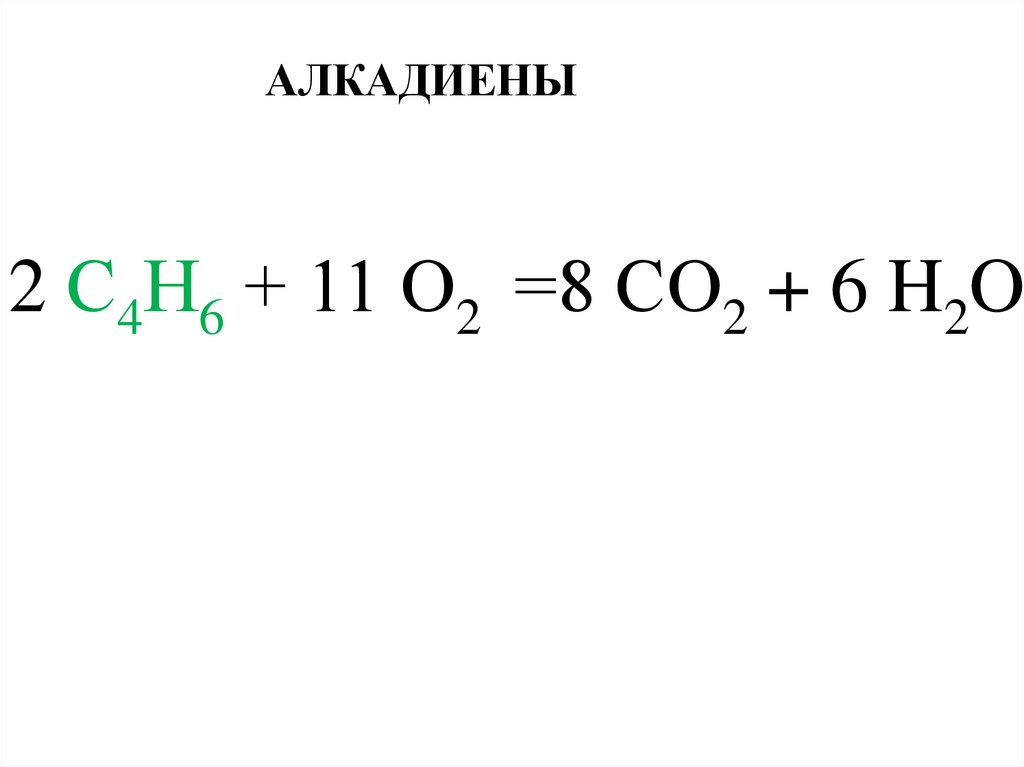
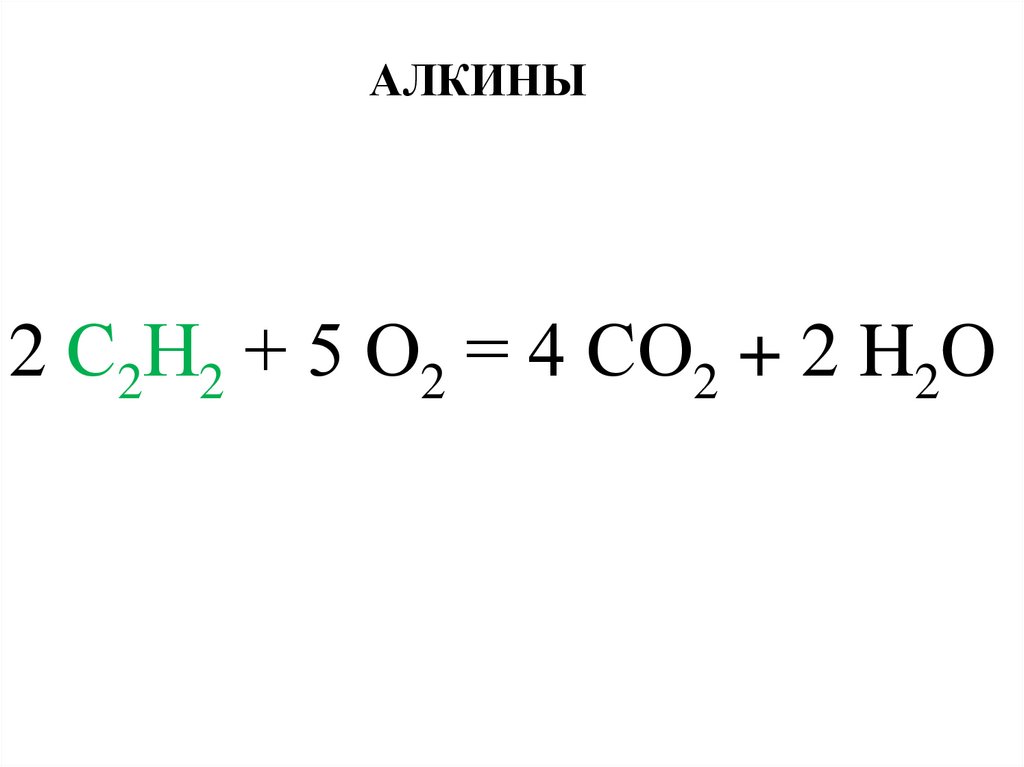











 Химия
Химия








