Похожие презентации:
Химические свойства металлов
1. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
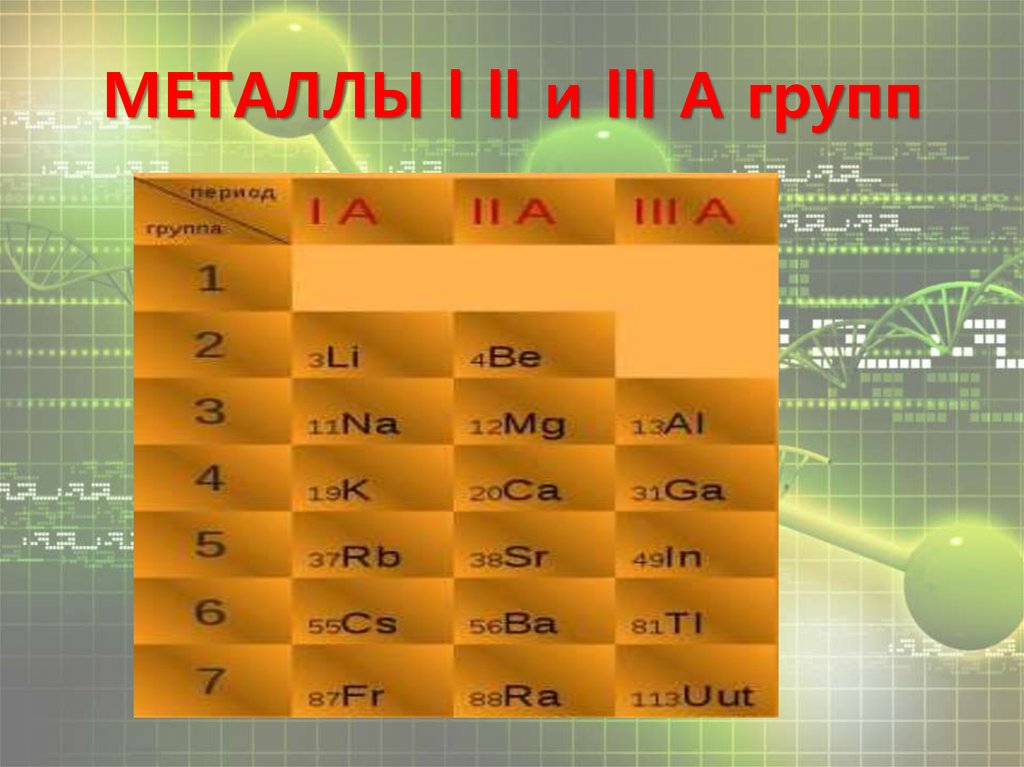
Полковников Григорий, 9Б класс2. МЕТАЛЛЫ l ll и lll А групп
3.
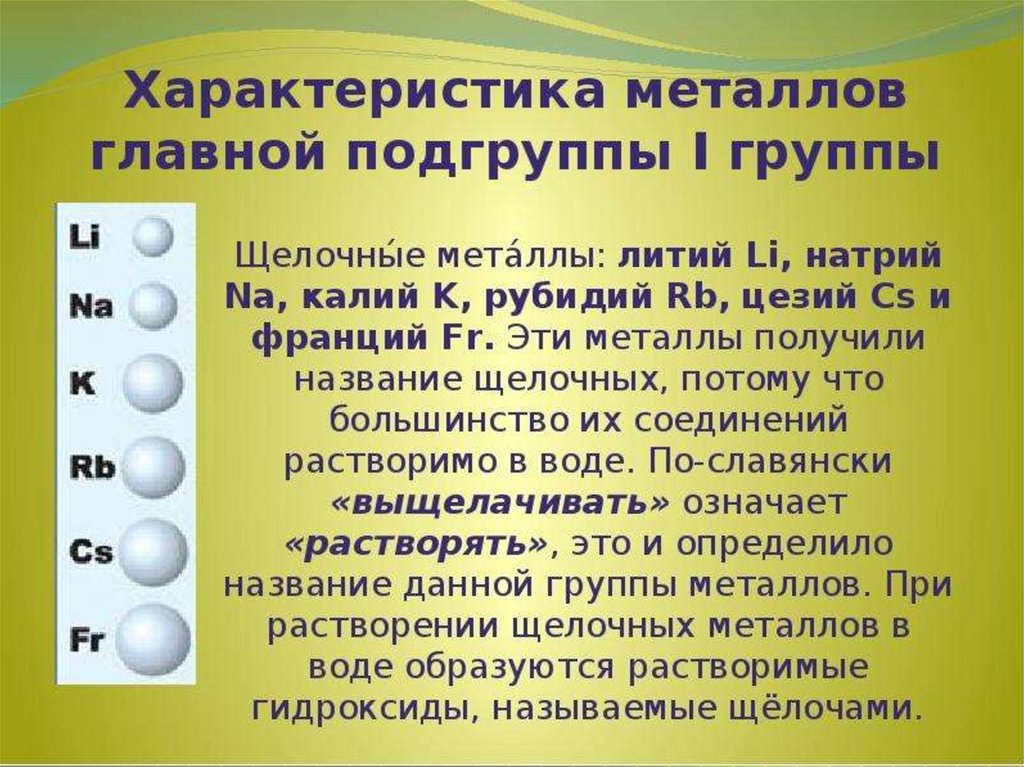
МЕТАЛЛЫ l группы4.
5.
6.
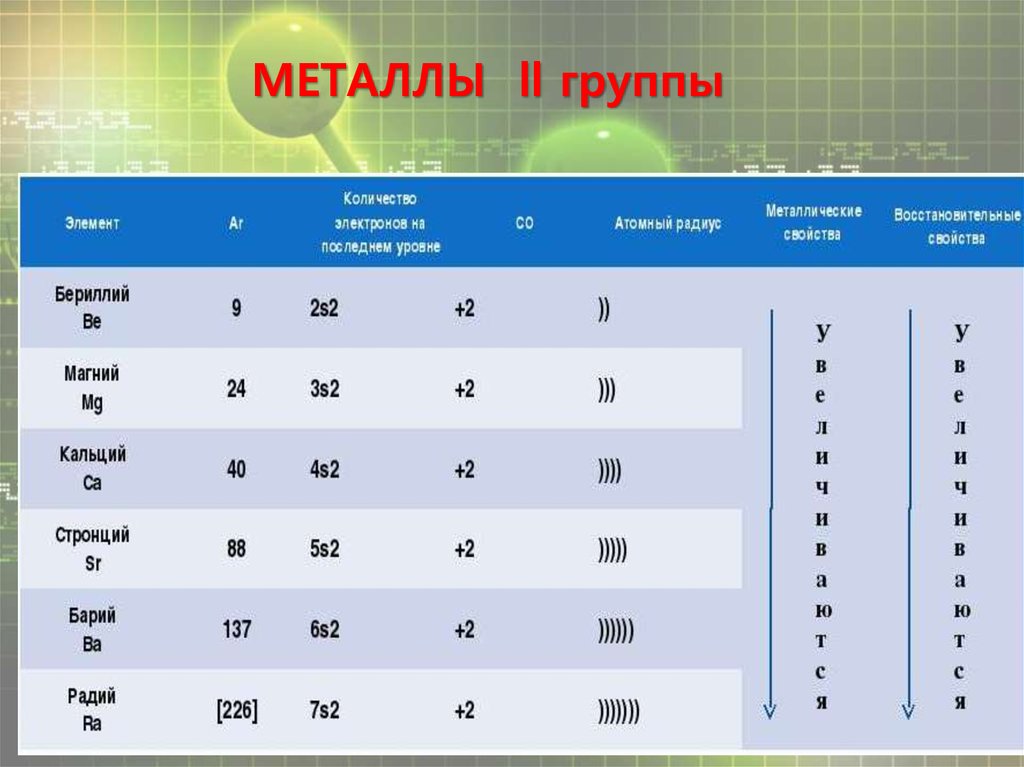
МЕТАЛЛЫ ll группы7.
8. Химические свойства металлов второй группы
Взаимодействие с неметаллами9.
Химические свойства металловтретьей группы
Металлические свойства элементов главной
подгруппы III группы выражены слабее, чем у элементов
главных подгрупп I и II групп, т.к. тенденция к отдаче
электронов у них меньше
Увеличение радиуса от Аl к Тl менее значительно, чем у
щелочных щелочно-земельных металлов, поэтому
усиление основного характера соединений происходит
медленнее.
Из всей подгруппы самым известным является Аl, это
самый распространенный элемент в природе. Чистый
Аl обладает высокими пластическими свойствами,
теплопроводностью, электропроводимостью.
Делится на особочистый, высокой чистоты, технически
чистый.
10.
Свойства металлов I-III группПо своим химическим свойствам все металлы
являются восстановителями, все они
сравнительно легко отдают валентные
электроны, переходят в положительно
заряженные ионы, то есть окисляются.
Восстановительную активность металла в
химических реакциях, протекающих в водных
растворах, отражает его положение
в электрохимическом ряду напряжений
металлов, или ряду стандартных электродных
11.
Чем левее стоит металл в рядустандартных электродных потенциалов,
тем более сильным восстановителем он
является, самый сильный
восстановитель – металлический литий,
золото – самый слабый, и, наоборот,
ион золото (III) – самый сильный
окислитель, литий (I) – самый слабый.
12.
Каждый металл способен восстанавливатьиз солей в растворе те металлы, которые
стоят в ряду напряжений после него,
например, железо может вытеснять медь
из растворов ее солей.
Следует помнить, что металлы щелочных
и щелочно-земельных металлов будут
взаимодействовать непосредственно с
водой.
13.
Металлы, стоящее в ряду напряженийлевее водорода, способны вытеснять
его из растворов разбавленных кислот,
при этом растворяться в них.
14.
Восстановительная активность металлане всегда соответствует его положению в
периодической системе, потому что при
определении места металла в ряду
учитывается не только его способность
отдавать электроны, но и энергия,
которая затрачивается на разрушение
кристаллической решетки металла, а
также энергия, затрачиваемая на
гидратацию ионов.












 Химия
Химия








