Похожие презентации:
Многокомпонентный ионный обмен
1.
Многокомпонентныйионный обмен
2.
• Многокомпонентнойионообменной
системой считается система, содержащая
более двух обменивающихся ионов.
• Простейшая многокомпонентная система –
трехкомпонентная.
• Реальные ионообменные системы всегда
многокомпонентны.
3.
Задачи многокомпонентногоионного обмена
* Описание многокомпонентных ионообменных систем –
нахождение К, ∆G, ∆Н, Т∆S.
- независимость бинарных (псевдобинарных)обменов
- взаимовлияние ионов при обмене
*Прогнозирование многокомпонентных ионообменных систем –
рассчитать состав фазы ионообменника для любого
выбранного состава фазы раствора и наоборот
- Численные методы (на основе эксперимента по зависимости
концентрации обменивающихся ионов в одной фазе от
концентрации в другой фазе )
- Аналитическое (использование функциональной зависимости
одних величин от других у=ах2+вх+с)
- Графическое (использование правил и приемов построения
графиков)
_
C
Cp
4.
1 z A 1 zB1 z A 1 zB
A B
A B
zA
zB
zA
zB
1 z A 1 zС
1 z A 1 zС
A С
A С
zA
zС
zA
zС
1 z A 1 zD
1 z A 1 zD
A
D
A
D
zA
zD
zA
zD
1
K
В
А
aB
1
aA
1
K
С
А
aС
1
aA
zB
zA
zС
zA
1
K
D
А
aD
1
aA
1 z A 1 zК
1 z A 1 zК
A
К
A
К
zA
zК
zA
zК
1
K
К
А
aК
1
aA
1
aA zA
1
aB zB
1
aA zA
1
aС zС
1
zD
zA
zК
zA
aA zA
1
a D zD
1
aA zA
1
aК zК
n-компонентная система описывается (n-1) уравнениями
1 z A 1 z B 1 zÑ 1 z D 1 z Ê
A B Ñ
D
Ê
zA
zB
zÑ
zD
zÊ
1 z A 1 z B 1 zÑ 1 z D 1 z Ê
A B Ñ
D
Ê
zA
zB
zÑ
zD
zÊ
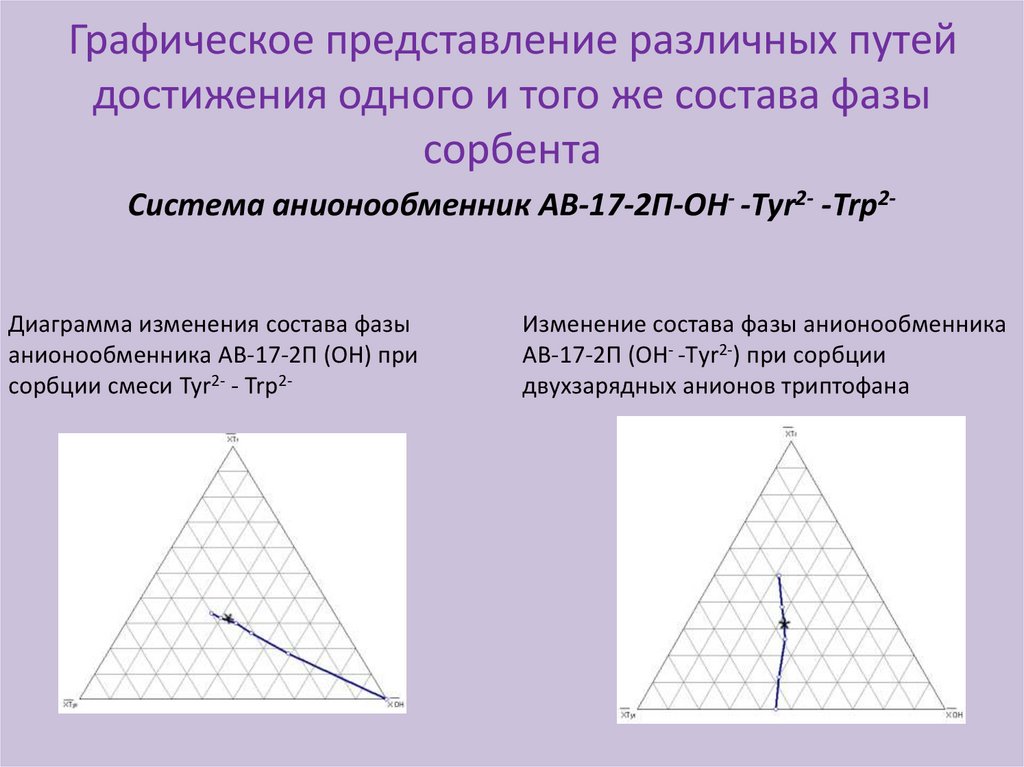
К одному и тому же составу ионообменника можно прийти различными путями
5.
Представление многокомпонентногоионного обмена
,
r
n
r
Il I Il
zl
l 1
i 1
z
i
i
l 1
zl
r
n
r
l
= Il I Il
l 1
zl
i 1
z
i
i
z
l 1
I - компонент обмена, z - заряд иона,
n
zi
i 1
r
zl
l 1
n
r
q
a
K l 1
i 1
l
r
zl
n
a i l 1
i 1
r
n
a
i 1
zi
i
n
zl r
l 1
a
l 1
zi
i 1
l
n - общее число обменивающихся ионов;
r - число ионов в фазе сорбента в исходном состоянии;
q - наибольший общий делитель
6.
Константа n -ионного обмена может бытьпредставлена
в
виде
некоторого
произведения констант бинарных обменов.
n
K Kl
i
где Kil - константа бинарного обмена.
i 1
1/ z
i
l
K
a i l a l1/ zi
1/ z
a1l / zi a i l
K ll 1
Т.О. целесообразно рассматривать ионообменные равновесия, включающие n
ионов в виде совокупности (n - 1) биионных обменов
В системах с идеальным обменом коэффициенты равновесия псевдобинарных
обменов не зависят от присутствия посторонних ионов.
7.
Расчет коэффициентов активностикомпонентов фазы сорбента
Для установления влияния посторонних ионов на состояние данного
иона необходимо учитывать коэффициенты активности компонентов
фазы сорбента.
Решается система трех уравнений – уравнения Гиббса-Дюгема и двух
уравнений логарифмированных и дифференцированных констант
равновесия.
c A d ln f A cB d ln f B cC d ln f C d c A cB cC 0
1 z A 1 zB
1 z A 1 zB
A B
A B
zA
zB
zA
zB
~
d ln K AВ 1
1 z A 1 zС
1 z A 1 zС
A С
A С
zA
zС
zA
zС
~
d ln K AC 1
zВ
zC
d ln f В 1
d ln f С 1
zA
zA
d ln f A 0
d ln f A 0
8.
Коэффициенты активности компонентов фазысорбента в трехкомпонентной системе
( x1, x 2 , x 3)
1
~2
~
~3
ln f 1 X 2 ln K 1(3) ln K 1( 3) dX 2 X 3 ln K1( 2)
z1
(1, 0 , 0 )
2
( x ,x ,x )
( x1, x 2 , x 3)
C o ( x1, x 2 , x 3)
1, 0 , 0
C o (1, 0 , 0 )
~3
ln
K
1(2) dX 3
1 2 3
1
~3
~3
~2
ln f 2 X 3 ln K1( 2) ln K1( 2) dX 3 (1 X 2) ln K 1( 3)
z2
( 0 ,1, 0 )
( x ,x ,x )
( x1, x 2 , x 3)
C o ( x1, x 2 , x 3)
0 ,1, 0
C o ( 0 ,1, 0 )
~2
ln K1( 3) dX 2
( x ,x ,x )
dC 0
z1c 1 z 2c 2 z 3c 3
dC 0
z1c 1 z 2c 2 z 3c 3
C o( x , x , x )
1 2 3
1 2 3
1 2 3
1
dC 0
~2
~2
~3
~3
ln f 3 X 2 ln K 1( 3) ln K 1( 3) dX 2 (1 X 3) ln K1( 2) ln K1( 2) dX 3
z3
z1c 1 z 2c 2 z 3c 3
( 0 , 0 ,1)
( 0 , 0 ,1)
C o ( 0 , 0 ,1)
За отсчетное состояние принимается равновесие ионообменника в
моноионной форме с бесконечно разбавленным раствором
9.
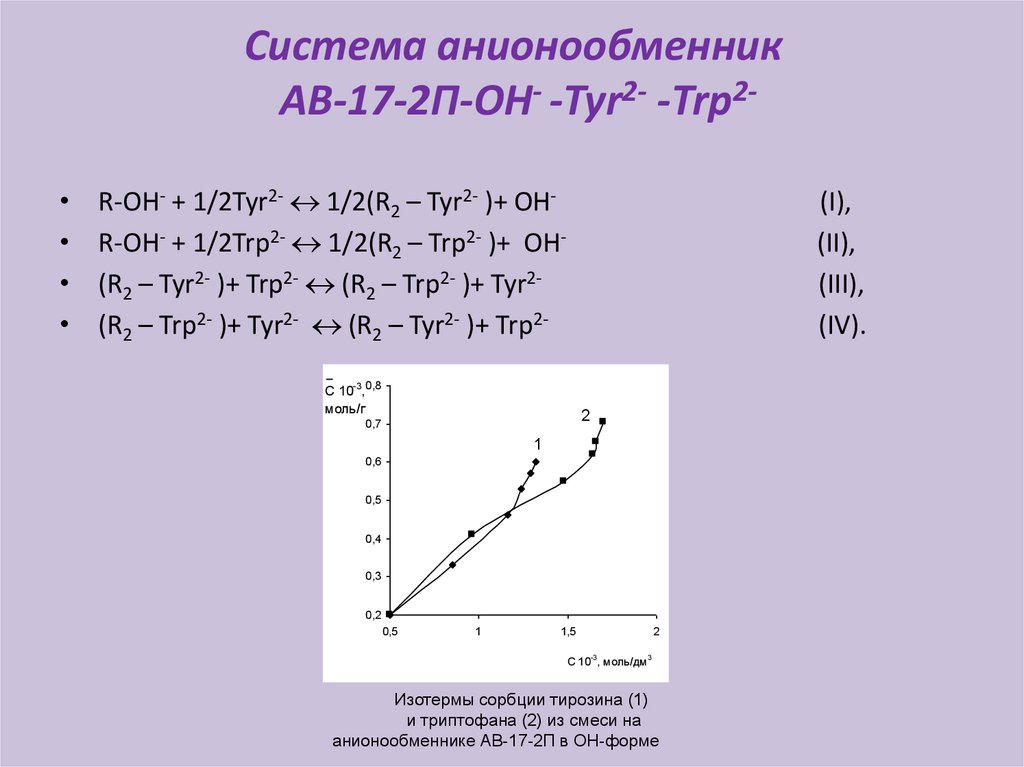
Система анионообменникАВ-17-2П-ОН- -Tyr2- -Trp2
R-ОН- + 1/2Tyr2- 1/2(R2 – Tyr2- )+ ОНR-ОН- + 1/2Trp2- 1/2(R2 – Trp2- )+ ОН(R2 – Tyr2- )+ Trp2- (R2 – Trp2- )+ Tyr2(R2 – Trp2- )+ Tyr2- (R2 – Tyr2- )+ Trp2-
(I),
(II),
(III),
(IV).
_
С 10-3,0,8
моль/г
2
0,7
1
0,6
0,5
0,4
0,3
0,2
0,5
1
1,5
2
С 10-3, моль/дм 3
Изотермы сорбции тирозина (1)
и триптофана (2) из смеси на
анионообменнике АВ-17-2П в ОН-форме
10.
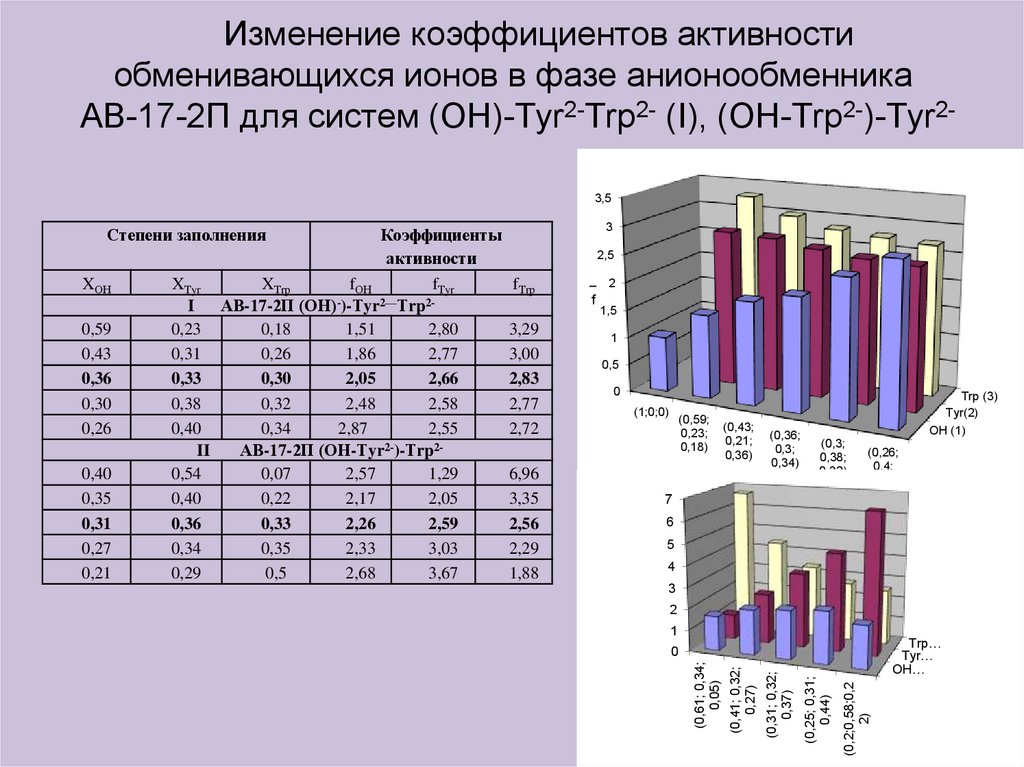
Изменение коэффициентов активностиобменивающихся ионов в фазе анионообменника
АВ-17-2П для систем (ОН)-Тyr2-Тrp2- (I), (ОН-Тrp2-)-Тyr23,5
1,5
1
0,5
0
(1;0;0)
(0,59;
0,23;
0,18)
(0,43;
0,21;
0,36)
(0,36;
0,3;
0,34)
(0,3;
0,38;
0,32)
Trp (3)
Tyr(2)
ОН (1)
(0,26;
0,4;
0,24)
7
6
5
4
3
2
1
Trp…
Tyr…
ОН…
(0,2;0,58;0,2
2)
0
(0,25; 0,31;
0,44)
f
(0,31; 0,32;
0,37)
0,40
0,35
0,31
0,27
0,21
_ 2
(0,41; 0,32;
0,27)
0,59
0,43
0,36
0,30
0,26
2,5
(0,61; 0,34;
0,05)
XОН
Коэффициенты
активности
XТyr
XТrp
fОН
fТyr
fТrp
2—
2I
АВ-17-2П (ОН) )-Тyr Тrp
0,23
0,18
1,51
2,80
3,29
0,31
0,26
1,86
2,77
3,00
0,33
0,30
2,05
2,66
2,83
0,38
0,32
2,48
2,58
2,77
0,40
0,34
2,87
2,55
2,72
22II
АВ-17-2П (ОН-Тyr )-Тrp
0,54
0,07
2,57
1,29
6,96
0,40
0,22
2,17
2,05
3,35
0,36
0,33
2,26
2,59
2,56
0,34
0,35
2,33
3,03
2,29
0,29
0,5
2,68
3,67
1,88
3
Степени заполнения
11.
Пример расчета константСистема анионообменник АВ-17-2П-ОН- -Tyr2- -Trp2R-ОН- + 1/2Tyr2- 1/2(R2 – Tyr2- )+ ОНR-ОН- + 1/2Trp2- 1/2(R2 – Trp2- )+ ОН-
Tyr f Trp f OH
Tyr Trp OH f
1
2
2
Tyr Trp
K OH
2
Tyr
2
Trp
1
2
Tyr 2
Tyr f OH
Tyr OH f
K
Tyr
OH
1
Tyr 2
2
Trp
K OH
(Tyr 2 )
2
1
2
Trp 2
Trp
2
OH
Ионообменная
Термодинамичес
система
кие константы
АВ-17-2П (ОН)-)-Тyr2-Тrp2- (293 К)
трехионная
17,68±0,23
ОН-Tyr2-
3,97±0,04
ОН-Trp2-
4,45±0,04
OH
1
2
2
OH
Trp f OH
Trp OH f
2
2
2
2
2
2
OH
1
Trp 2
1
2
2
2
2
2
Tyr 2
OH (Trp 2 )
1
2
2
2
OH
12.
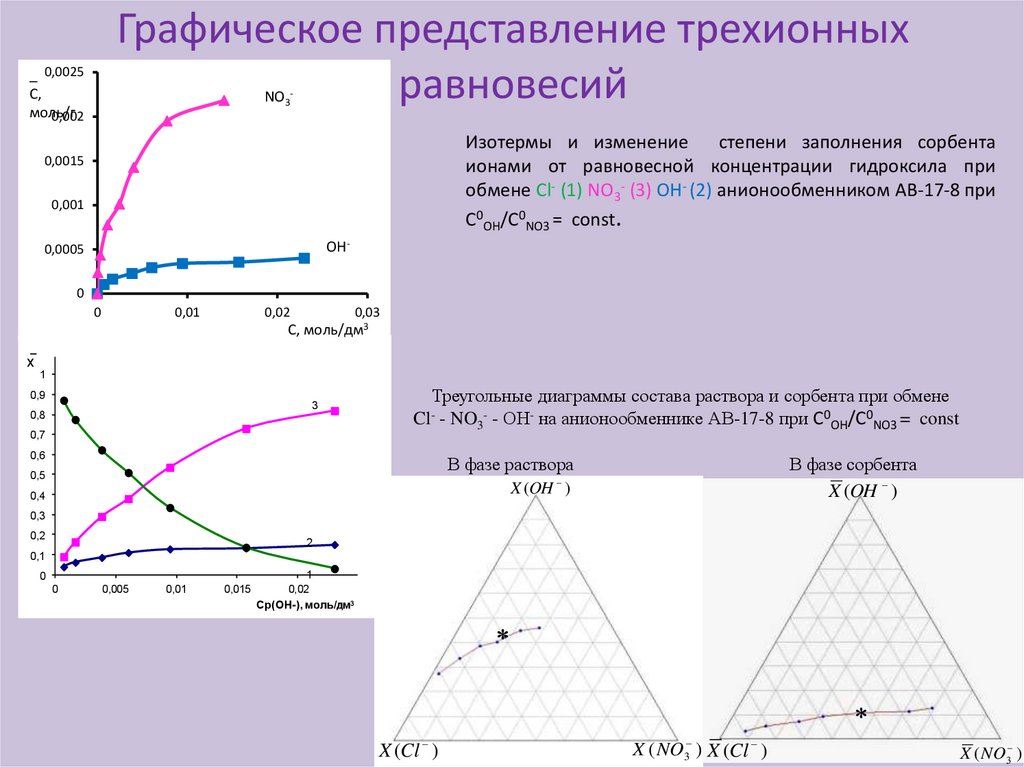
Графическое представление трехионныхравновесий
_ 0,0025
С,
моль/г
0,002
NO3-
Изотермы и изменение
степени заполнения сорбента
ионами от равновесной концентрации гидроксила при
обмене Cl- (1) NO3- (3) OH- (2) анионообменником АВ-17-8 при
С0ОН/С0NO3 = const.
0,0015
0,001
OH-
0,0005
0
0
0,01
0,02
0,03
С, моль/дм3
_
X
1
0,9
3
0,8
0,7
Треугольные диаграммы состава раствора и сорбента при обмене
С0ОН/С0NO3 = const
Cl- - NO3- - ОН- на анионообменнике АВ-17-8 при
0,6
В фазе раствора
0,5
В фазе сорбента
X (OH )
X (OH )
0,4
0,3
0,2
2
0,1
0
0
0,005
0,01
0,015
1
0,02
Cр(OH-), моль/дм3
X (Cl )
X ( NO3 ) X (Cl )
X ( NO3 )
13.
Графическое представление различных путейдостижения одного и того же состава фазы
сорбента
Система анионообменник АВ-17-2П-ОН- -Tyr2- -Trp2-
Диаграмма изменения состава фазы
анионообменника АВ-17-2П (ОН) при
сорбции смеси Tyr2- - Trp2-
Изменение состава фазы анионообменника
АВ-17-2П (ОН- -Тyr2-) при сорбции
двухзарядных анионов триптофана
14.
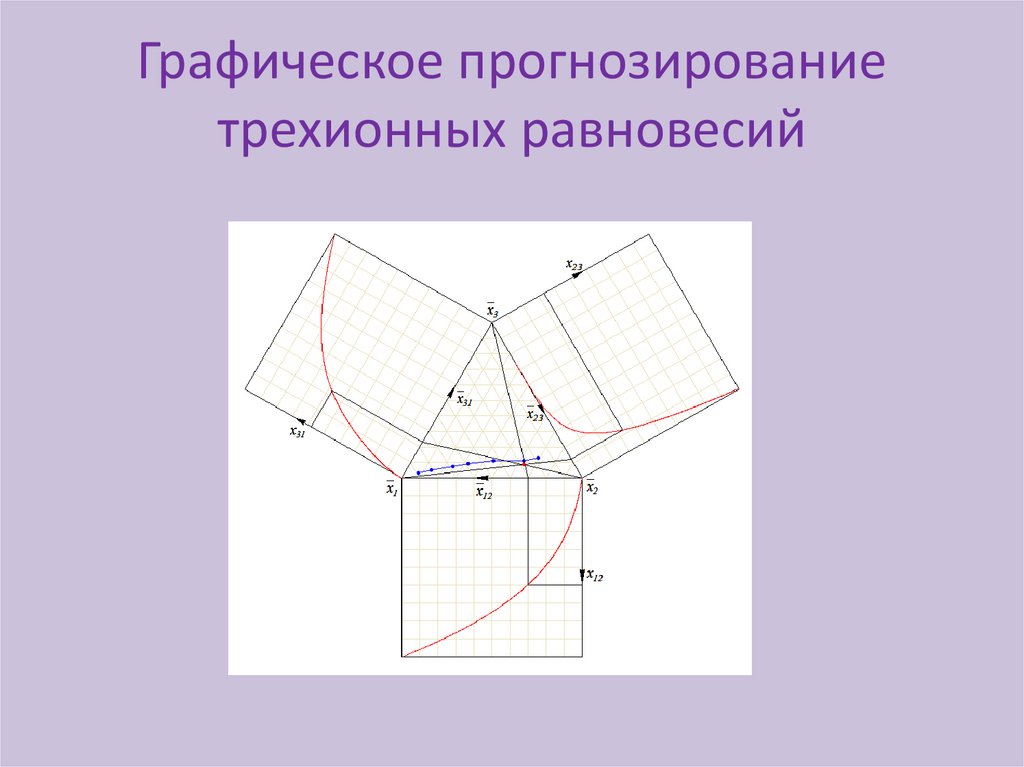
Графическое прогнозированиетрехионных равновесий
15.
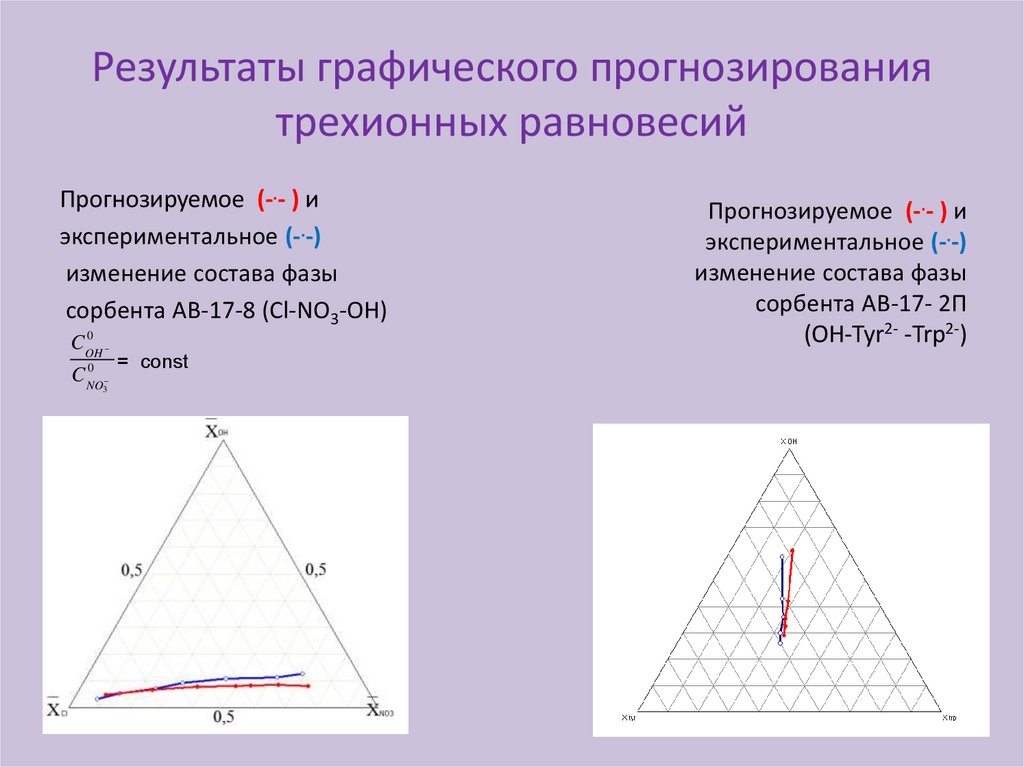
Результаты графического прогнозированиятрехионных равновесий
Прогнозируемое (-.- ) и
экспериментальное (-.-)
изменение состава фазы
сорбента АВ-17-8 (Сl-NO3-OH)
0
COH
0
C NO
3
= const
Прогнозируемое (-.- ) и
экспериментальное (-.-)
изменение состава фазы
сорбента АВ-17- 2П
(ОН-Tyr2- -Trp2-)









 Биология
Биология








