Похожие презентации:
Задачи на моль. Теория
1.
2.
3.
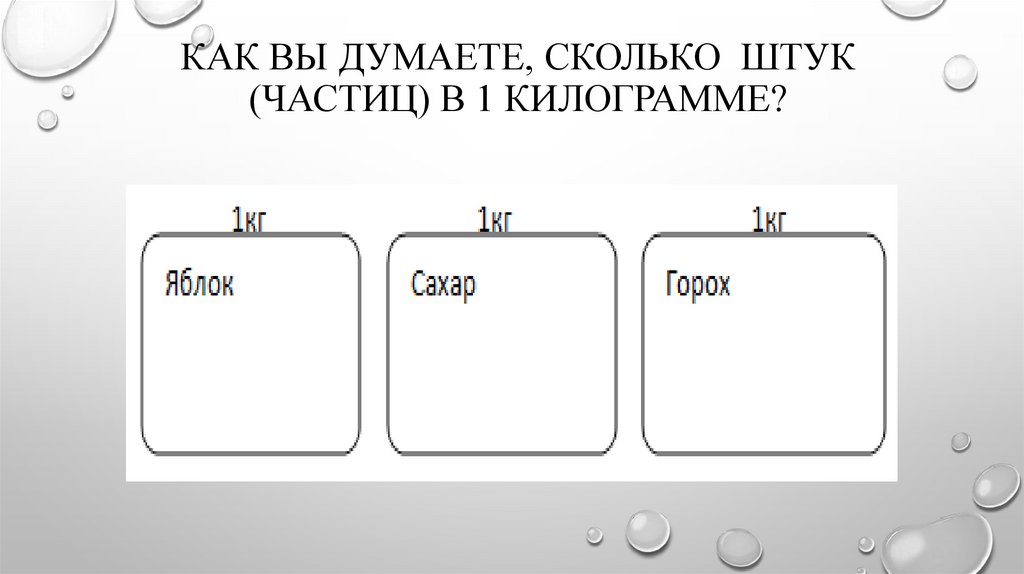
КАК ВЫ ДУМАЕТЕ, СКОЛЬКО ШТУК(ЧАСТИЦ) В 1 КИЛОГРАММЕ?
4.
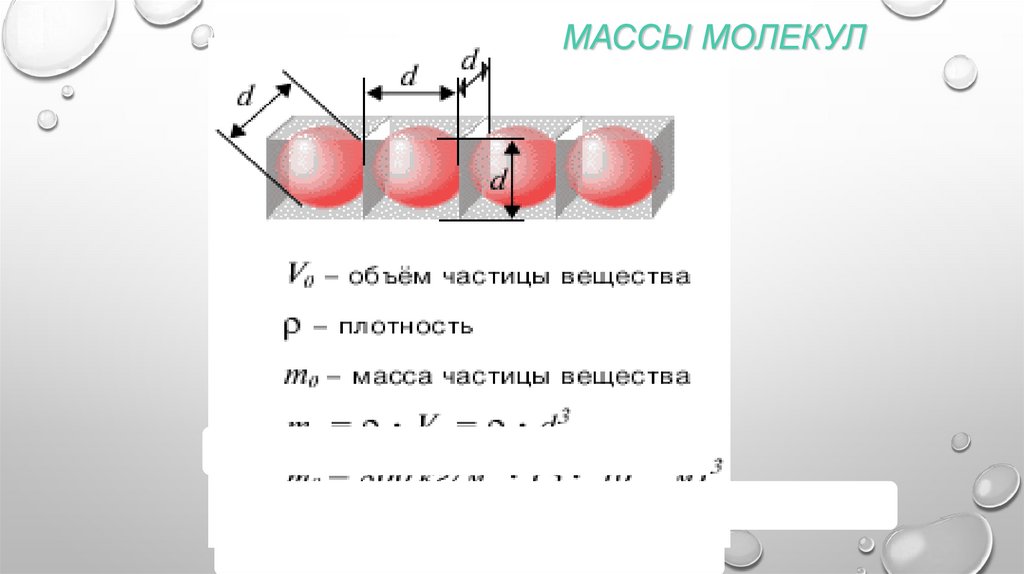
МАССЫ МОЛЕКУЛ5.
РАССКАЖУ СЕГОДНЯ, ЧТО ЛИ, О ЗЛОВРЕДНОЙ РОЛИ МОЛИ.МОЛЬ СЪЕДАЕТ ШЕРСТЬ И МЕХ – ПРОСТО ПАНИКА У ВСЕХ…
НУ, А В ХИМИИ – ИЗВОЛЬ! ЕСТЬ ДРУГОЕ СЛОВО «МОЛЬ».
ПРОСТ, КАК НЕБО И ТРАВА, МОЛЬ ЛЮБОГО ВЕЩЕСТВА.
НО ТРУДНА ЕГО ДОРОГА: В МОЛЕ ТАК МОЛЕКУЛ МНОГО!
6.
7.
8.
Одинаковоечисло
молекул
(атомов) вещества содержится
в массах численно равных их
относительным молекулярным
(атомным) массам
NA – постоянная Авогадро
Лоренцо Авогадро
(1776 – 1856 гг.)
9.
МАССА 1 МОЛЬ ВЕЩЕСТВАНАЗЫВАЕТСЯ МОЛЯРНОЙ МАССОЙ (M)
M (г/моль) = Mr
10.
11.
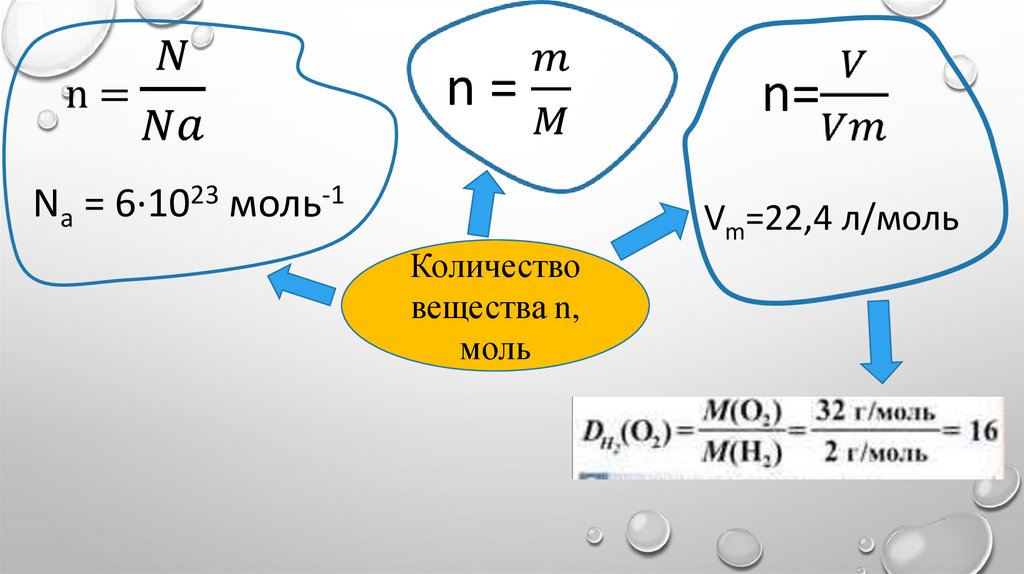
УСТАНОВИМ ВЗАИМОСВЯЗЬОСНОВНЫХ ВЕЛИЧИН
12.
Самостоятельная работа.Заполнить таблицу в тетради, формулы и решение записать под таблицей, под соответствующими номерами.
Указывать единицы измерений. В таблицу вписать только ответы.
Вещество
O3
m
М
1
C6H12O6
FeCl3
KMnO4
Ca3(PO4)2
2
n
5 моль
N
3
90 г
4
5
6
7
8
9
12 х1023
7 моль
4 х1023
13.
• Молярный объем – это объем 1 молягаза
• Обозначается Vm
• Измеряется в л/моль
V = nVm
14.
Na = 6∙1023 моль-1Vm=22,4 л/моль
Количество
вещества n,
моль
15.
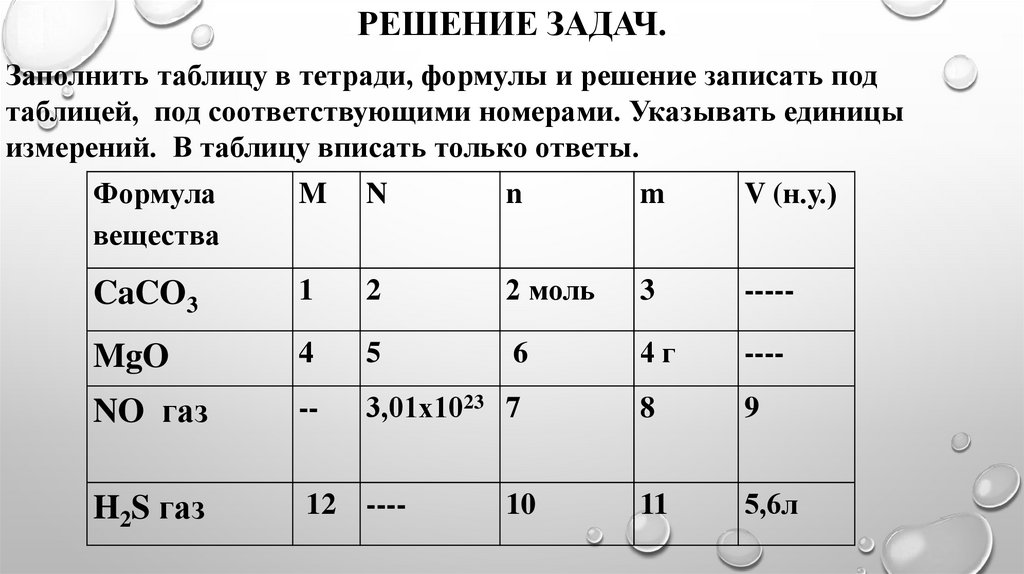
РЕШЕНИЕ ЗАДАЧ.Заполнить таблицу в тетради, формулы и решение записать под
таблицей, под соответствующими номерами. Указывать единицы
измерений. В таблицу вписать только ответы.
Формула
вещества
M
N
n
m
V (н.у.)
CaCO3
1
2
2 моль
3
-----
MgO
4
5
6
4г
----
NO газ
--
3,01х1023 7
8
9
H2S газ
12
----
11
5,6л
10










 Химия
Химия