Похожие презентации:
Решение задачи по химическому уравнению
1.
ChemistryРЕШЕНИЕ ЗАДАЧИ ПО ХИМИЧЕСКОМУ
УРАВНЕНИЮ
Поповой Дарьи
8 класс, Луковецкая
школа
2.
ChemistryУсловие задачи :
Найти объём выделившегося водорода
(н.у.),который образовался при взаимодействии
серной кислоты с магнием . Магний массой 48
грамм.
Дано:
m(Mg)=48г
Найти:
V(H2O)
Формулы:
N=m/M;
V=nVm
(Vm=22/4л/моль)
3.
ChemistryРешение:
1)H2SO4+Mg=MgSO4+H2
2)Находим количество известного вещества( по данным задачи):
Формула: n=m/M,
где n- количество вещества, моль
m – масса вещества,
М – молярная масса вещества, г/моль(данные берём из таблицы
Менделеева)
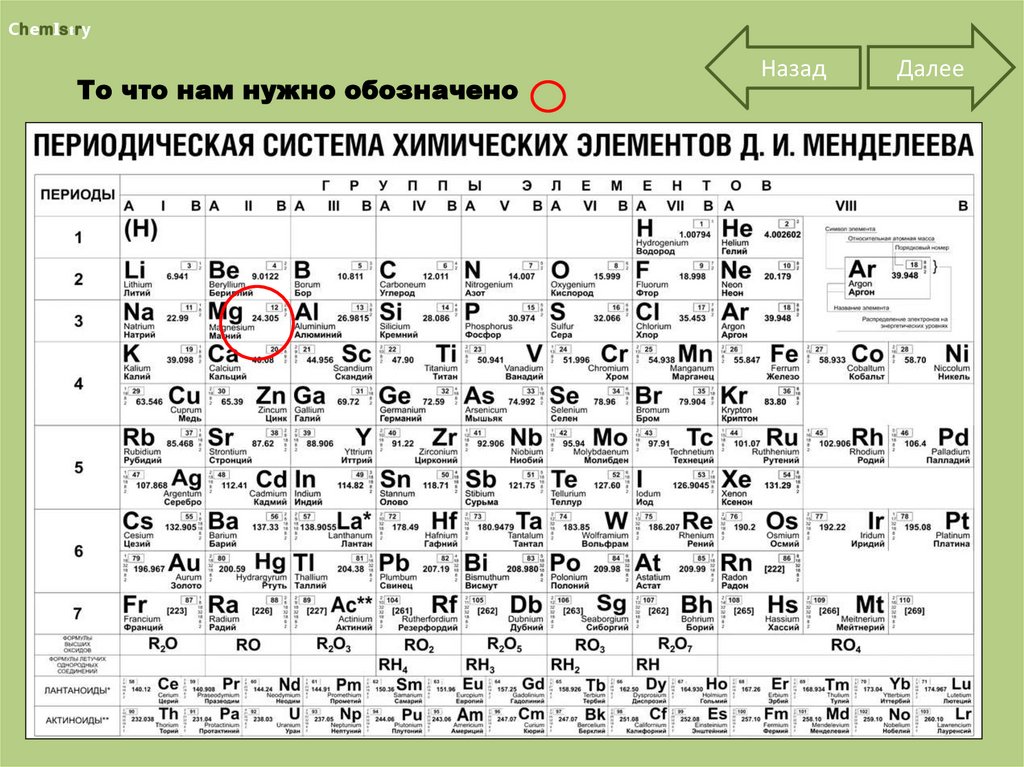
М (Mg) = 24 г/моль
N (Mg) = m(Mg) : М (Mg)= 48 : 24 = 2 (моль)
Таблица
4.
ChemistryТо что нам нужно обозначено
Назад
Далее
5.
Chemistry2моль
nмоль
3) H2SO4 + Mg = MgSO4 + H2
1моль
1моль
n(H2) = (2 * 1) : 1 = 2 моль
4) V =nVm Vm=22,4 л/моль
V(H2)=n(H2) * 22,4 = 2 * 22,4 = 44,8(л)
Ответ: Объём водорода равен 44,8 л
6.
ChemistryАлгоритм решения:
1) Записываем условие задачи: Дано: Найти:
Формулы:
2)Приступаем к решению задачи, записываем уравнение (Составляем все
формулы, используя таблицу растворимости), уравниваем левую и правую
части уравнения
3) Находим количество известного вещества( по данным задачи):
Формула: n = m/M,
где n- количество вещества, моль
m – масса вещества,
М – молярная масса вещества, г/моль(данные берём из таблицы
Менделеева)Атомная масса умножается на индекс, который стоит в формуле.
Например: H2SO4 = 1*2 т.е атомная масса водорода 1 а их в формуле два
поэтому надо умножить на 2
По формуле n = m/M получены данные (моль)
4)Записываем полученные данные над формулой в уравнении (моль)
7.
Chemistry5) Над веществом, которое надо найти ставим n (моль)
6)Под эти формулы сносим цифры (коэффициенты), которые стоят в
уравнении перед молекулами (моль)
7)Находим количество вещества неизвестного (моль)
8)По формуле высчитываем , если найти массу используем формулу
m = n *M , если необходимо найти объём, то используем формулу
V = nVm , где Vm – молярный объем. Для любых газов(при.н.у.):
Vm=22,4л/моль






 Химия
Химия








